ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Оценка рациональности проведения периоперационной антимикробной профилактики инфекционных осложнений у пациентов после хирургических вмешательств
Кафедра клинической фармакологии и пропедевтики внутренних болезней, лечебный факультет, Первый Московский государственный медицинский университет имени И. М. Сеченова (Сеченовский Университет), Москва
Назначение антибактериальных препаратов (АБП) для проведения периоперационной антимикробной профилактики (ПАП) пациентам хирургического профиля необходимо для снижения частоты возникновения инфекционных осложнений в послеоперационном периоде, в том числе инфекций области хирургических вмешательств. Целью работы была оценка рациональности и безопасности выбора АБП для проведения ПАП инфекционных осложнений у пациентов после хирургических вмешательств. Проведен фармакоэпидемиологический анализ 576 историй болезней пациентов в возрасте от 18 до 87 лет после хирургических вмешательств, средний возраст (М ± SD) составил 57,4 ± 14,5 года, мужчин — 347 (60,2%), женщин — 229 (39,8%). В финальный анализ рациональности схем ПАП вошли 481 история болезни. Оценивали рациональность выбора антибактериальной терапии, частоту развития неблагоприятных побочных реакций (НПР), частоту и характер инфекционных осложнений. Показано, что выбор схем ПАП соответствовал рекомендациям в 207 (43,04%) случаях. Выявлена высокая частота несоблюдения рекомендаций по проведению ПАП (274; 56,96%) и нарушения сроков проведения ПАП (364; 75,7%). Общее число случаев нарушения режимов дозирования составило 225 (46,8%). Обнаружена взаимосвязь нерациональных схем ПАП с длительностью пребывания в ОРИТ (р = 0,003 и р < 0,005), частотой повторных оперативных вмешательств, ассоциированных с инфекцией (р = 0,001), уровнем летальности (р = 0,002) и выделением полирезистентных штаммов (р = 0,016). Таким образом, у пациентов хирургического профиля в условиях реальной клинической практики сохраняется высокая частота несоблюдения рекомендаций по проведению ПАП, нарушения сроков проведения ПАП и режимов дозирования АБП, что негативно сказывается на госпитальных показателях.
Ключевые слова: антибактериальные препараты, периоперационная антимикробная профилактика инфекционных осложнений хирургического вмешательства, рациональность применения, неблагоприятные побочные реакции
Благодарности: авторы благодарят Бабенко Олега Васильевича из УКБ № 1 Первого МГМУ им. И. М. Сеченова за возможность доступа к архиву историй болезней.
Для корреспонденции : Мария Владимировна Лукина
ул. Большая Пироговская, д. 2, стр. 4, каб. 106, г. Москва, 119435; ur.xednay@0102kul-iram
Проведение периоперационной антимикробной профилактики (ПАП) с использованием антибактериальных препаратов (АБП) является общемировым стандартом ведения пациентов хирургического профиля и преследует цель снизить частоту развития инфекционных осложнений, в том числе инфекций области хирургических вмешательств (ИОХВ). Любые инфекционные осложнения в послеоперационном периоде негативно сказываются на результатах оперативного вмешательства, удлиняют время пребывания в стационаре, повышают затраты на лечение, потребность в проведении повторных оперативных вмешательств, влияют на показатели общебольничной летальности и требуют проведения дополнительной фармакотерапии [1].
Согласно данным Европейского центра профилактики и контроля заболеваний (ECDC) и Всемирной организации здравоохранения, в настоящее время отмечается высокая частота инфекционных осложнений, ассоциированных с поли- и панрезистентными штаммами [2, 3].
Проблема растущей резистентности к АБП связана с различными факторами, ведущее значение среди которых имеет неоправданно высокая частота назначения и нерациональный выбор АБП [4]. В связи с этим особое значение приобретают вопросы проведения рациональной антибактериальной терапии в условиях реальной клинической практики [5]. Использование нерациональных доз препаратов, назначение субтерапевтических дозировок АБП как с лечебной, так и с профилактической целью, необоснованная длительность ПАП в послеоперационном периоде (более 24 ч) являются факторами, снижающими эффективность ПАП и способствующими росту антибиотикорезистентности [6, 7].
В РФ активно разрабатываются меры по сдерживанию роста антибиотикорезистентности. Согласно обновленным рекомендациям национальной программы СКАТ (Стратегия Контроля Антимикробной Терапии), необходимо активно проводить мероприятия по сдерживанию роста антибиотикорезистентности и контролю за распространением нозокомиальных инфекций в условиях многопрофильных стационаров [8]. При этом важными инструментами реализации данной стратегии являются проведение системного мониторинга распространения антимикробной резистентности и совершенствование мер по осуществлению контроля за оборотом противомикробных препаратов [9].
Таким образом, рациональность назначения АБП в лечебно-профилактических учреждениях в различных клинических ситуациях — это один из способов снижения частоты ИОХВ, риска развития неблагоприятных побочных реакций (НПР) и сдерживания роста антибиотикорезистентности.
Целью исследования было оценить рациональность и безопасность выбора АБП для проведения ПАП инфекционных осложнений у пациентов после хирургических вмешательств.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен анализ структуры назначения АБП у пациентов хирургического профиля с профилактической целью, рациональности выбора схем ПАП и их соответствия национальным и международным клиническим рекомендациям [1, 10]. В базу данных вносили клинико-демографические данные пациентов (пол, возраст, основное и сопутствующие заболевания, уровень креатинина, клиренс креатинина до и после оперативного вмешательства), информацию о характере оперативного вмешательства (в том числе объем кровопотери и тип операционных ран, наличие осложнений, случаи НПР, режим дозирования АБП для периоперационной профилактики).
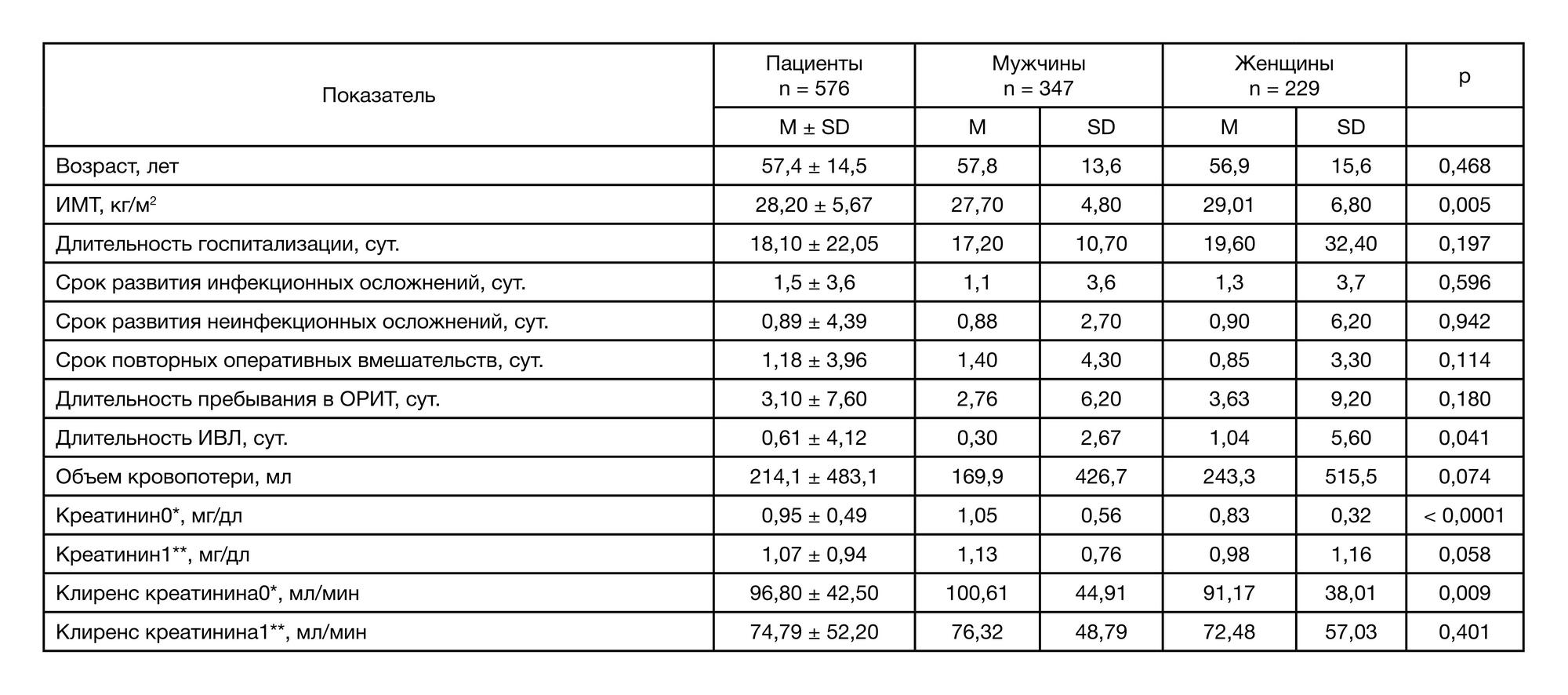
Для анализа были отобраны 576 историй болезни пациентов после хирургических вмешательств в период с июня по декабрь 2016 г. в возрасте от 18 до 87 лет; средний возраст (М ± SD) составил 57,4 ± 14,5 года, мужчин — 347 (60,2%), женщин — 229 (39,8%). Подробная характеристика выборки представлена в табл. 1.
По профилю оперативных вмешательств можно выделить следующие группы: общая хирургия (356; 61,8%), кардиохирургия (177; 30,7%), онкохирургия (21; 3,6%). Большинству пациентов проводили плановые оперативные вмешательства (468; 81,3%). Среди типов операционных ран преобладали чистые раны — 310 (53,8%). Инфицированные раны были у 113 (19,6%) пациентов с гнойно-септическими заболеваниями различной локализации. Условно-чистые и контаминированные раны встречались в 70 (12,2%) и 84 (14,6%) случаях соответственно.
В финальный анализ рациональности выбора схем ПАП вошли 481 история болезни в связи с отсутствием в 95 (16,5%) картах достоверной информации о проведении ПАП.
С целью оценки рациональности и безопасности, проводимой ПАП анализировали: – структуру назначения АБП; – рациональность выбора препаратов и использованных схем ПАП, время введения, длительность приема АБП; – частоту случаев НПР.Рассматривали общую частоту инфекционных осложнений и ИОХВ в послеоперационном периоде.
Дополнительно проведен анализ влияния различных факторов, таких как схемы ПАП, клинико-демографические особенности пациентов (возраст, пол, ИМТ, характер основного заболевания, функционального состояния почек, вид оперативного вмешательства, тип ран, объем кровопотери), на риск развития инфекционных осложнений, общую длительность госпитализации, длительность пребывания в ОРИТ, риск развития НПР, летальность.
Статистический анализ данных проводили с использованием пакета программ статистического анализа STATISTICA 10.0 (StatSoft Inc., США). Данные представлены в виде средних значений М и стандартного отклонения SD. При выборе метода анализа брали во внимание нормальность распределения выборок, которую оценивали с помощью W-теста Шапиро–Уилка, и однородность дисперсий, которую оценивали с помощью T-теста Фишера (при сравнении двух выборок). Различия считали статистически значимыми при р < 0,05. Помимо корреляционного анализа, для сравнения двух независимых переменных непрерывного типа, не подчиняющихся закону нормального распределения, использовали U-тест Манна–Уитни и критерий Колмогорова–Смирнова. Сравнение двух качественных независимых переменных производили с помощью двухстороннего F-теста Фишера либо теста χ2 с поправкой Йетса.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
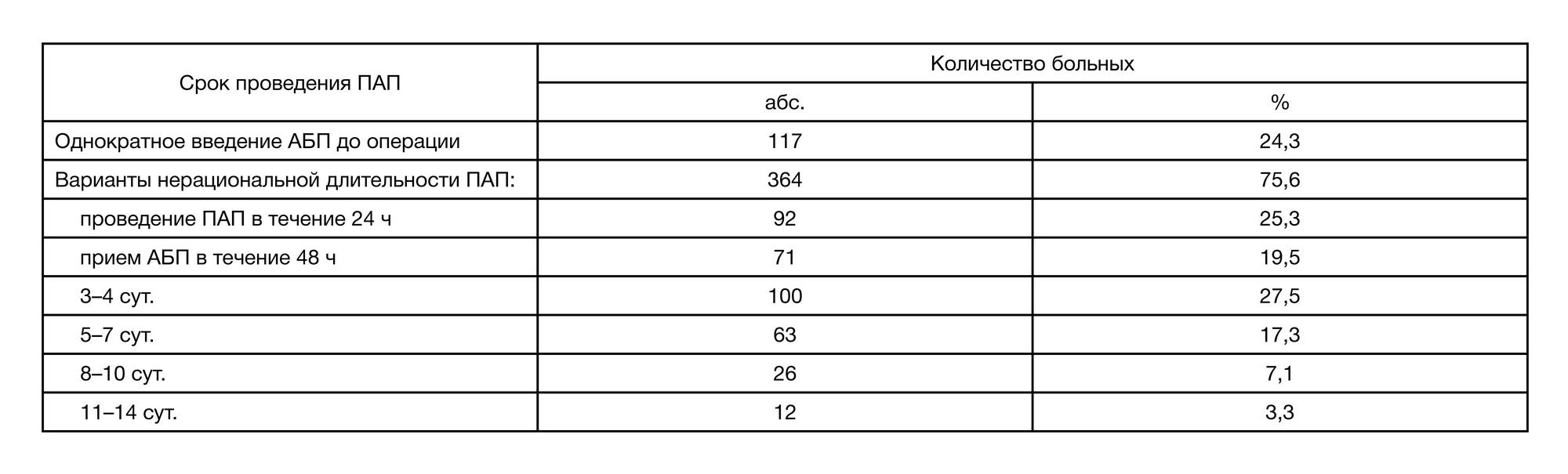
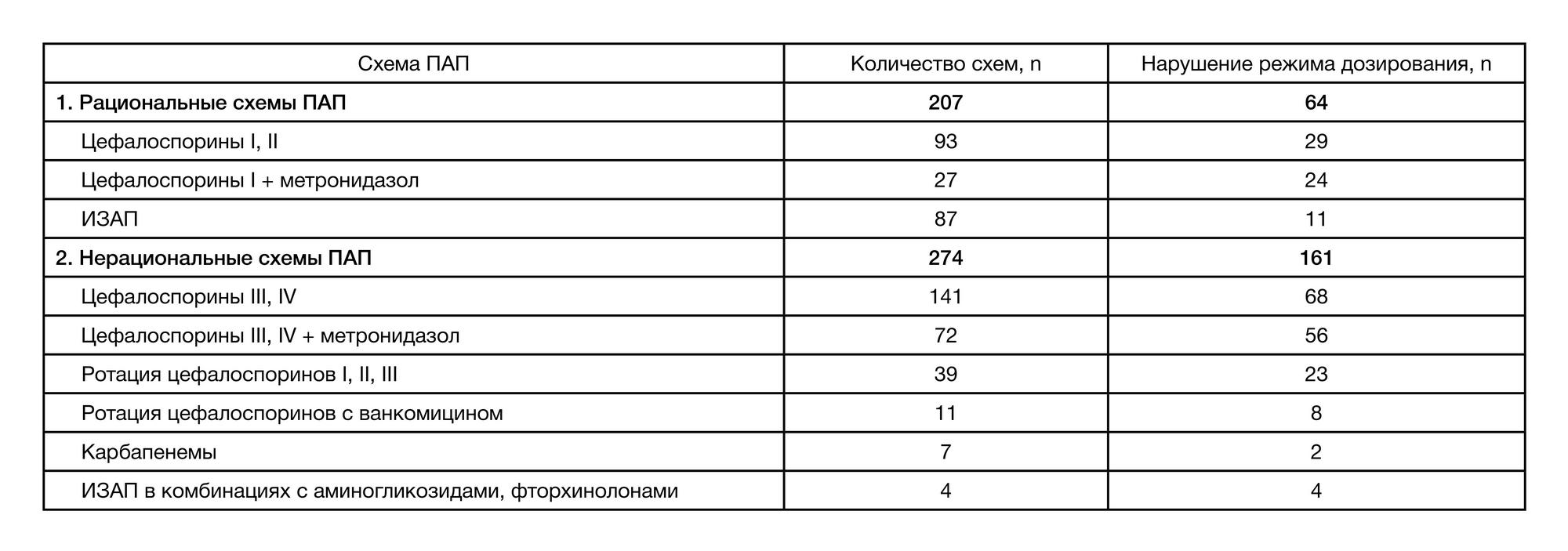
Проведенный ретроспективный анализ историй болезни (n = 481) показал, что назначения АБП соответствовали рекомендациям в 207 (43,04%) случаях. В 274 (56,96%) случаях отмечен нерациональный выбор АБП для ПАП без учета типа операционных ран и особенностей оперативного вмешательства. Среди схем для проведения ПАП можно выделить высокую частоту назначения цефалоспоринов (ЦФ) III поколения, ротацию ЦФ I, II, III, IV поколений в течение периоперационного и послеоперационного периода, а также назначение карбапенемов и ингибиторзащищенных аминопенициллинов (ИЗАП) в комбинациях с аминогликозидами (амикацин), метронидазолом и фторхинолонами (ципрофлоксацин) пациентам с чистыми и условно-чистыми ранами. В исследуемой когорте общая частота нарушения сроков проведения ПАП отмечена в 364 (75,7%) случаях. Общее число случаев нарушения режимов дозирования составило 225 (46,8%). Назначение рациональных схем ПАП (207; 43,04%) сопровождалось нарушениями режимов дозирования в 64 (30,9 %) случаях (табл. 2). При этом нерациональный выбор АБП (274; 56,96%) в 364 (75,7%) случаях сопровождался нарушением дли- тельности ПАП (продление более 24–48 ч) с тенденцией к назначению субтерапевтических доз в 161 (58,8%) случае (табл. 2, табл. 3).
Анализ безопасности антибактериальных препаратов для проведения периоперационной профилактики
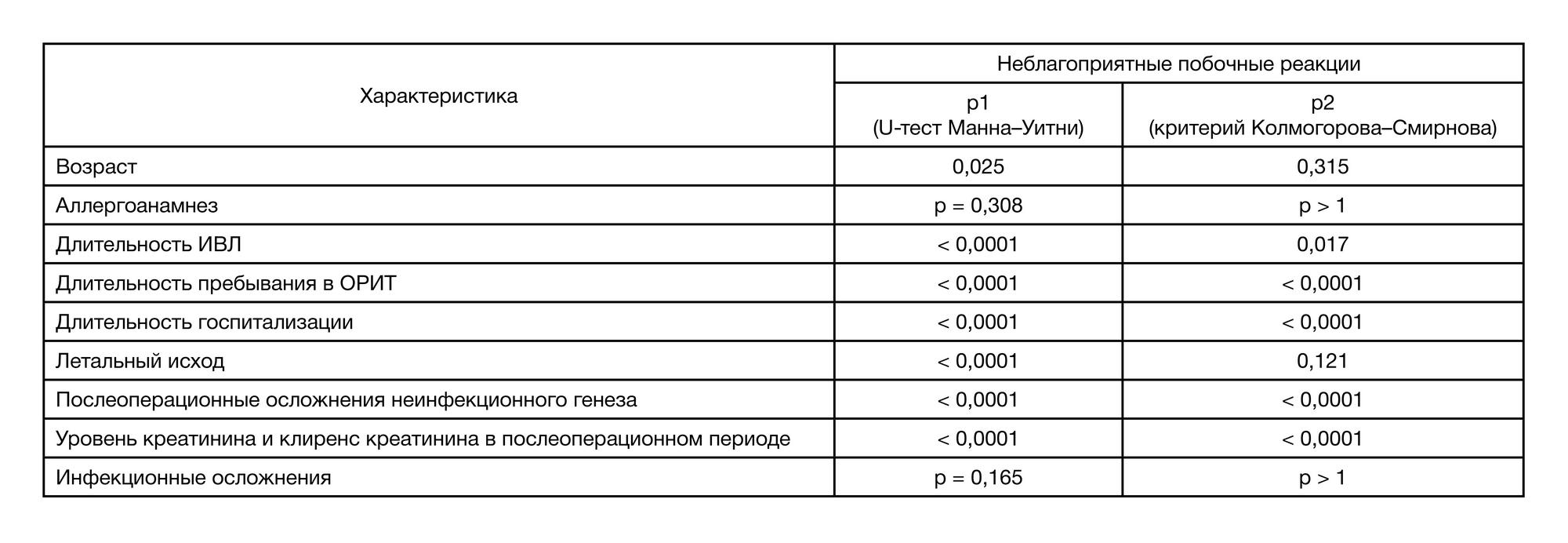
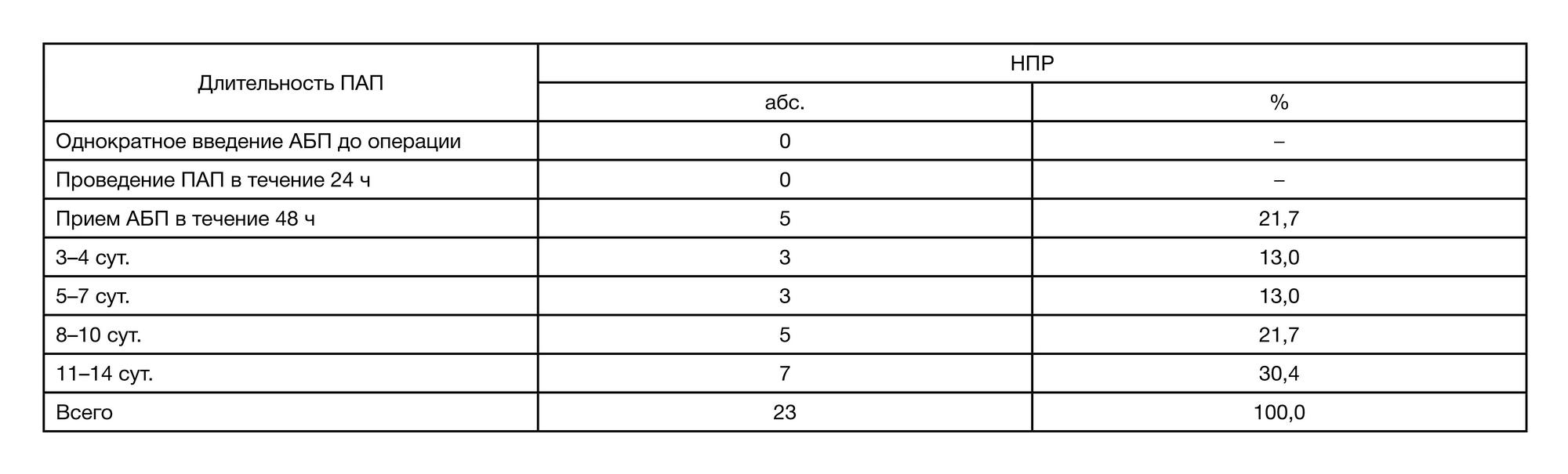
Ретроспективный анализ медицинской документации показал, что общее количество НПР составило 23 (3,99%) случая, все в группе пациентов, которым длительно проводили ПАП. Не были зафиксированы НПР в группе пациентов, получавших ПАП до операции, и в группе с длительностью ПАП до 48 ч. Таким образом, риск развития НПР возрастает по мере увеличения длительности ПАП (табл. 4). Были отмечены следующие НПР: – антибиотик-ассоциированный колит — 9 (39,1%); – психомоторное возбуждение — 6 (26,1%); – псевдоаллергические реакции — 3 (13,0%); – повышение трансаминаз — 3 (13,0%); – антибиотик-ассоциированная нефропатия (ванкомицин) — 2 (8,6%); – удлинение интервала Q–T — 2 (8,6%). Последующий корреляционный анализ выявил по- ложительные связи между развитием НПР и возрастом (r = 0,109; p = 0,009), длительностью госпитализации (r = 0,291; p < 0,0001), длительностью пребывания в ОРИТ (r = 0,374; p < 0,0001), летальным исходом (r = 0,269; р < 0,0001), уровнем послеоперационных осложнений неинфекционного генеза (r = 0,340; p < 0,0001), уровнем креатинина и клиренсом креатинина в послеоперационном периоде (r = 0,256; p < 0,0001). Отсутствовали корреляционные связи между НПР и наличием аллергоанамнеза (r = 0,039; p = 0,348), рациональностью выбора схем ПАП (r = 0,340; p = 0,387), адекватностью режимов дозирования АБП (r = 0,028; p = 0,504), длительностью ПАП (r = 0,017; p = 0,687) и инфекционными осложнениями (r = 0,032; p = 0,443).
U-тест Манна–Уитни и критерий Колмогорова–Смирнова подтвердили наличие достоверной связи НПР с возрастом, длительностью госпитализации, длительностью пребывания в ОРИТ, длительностью проведения ИВЛ, послеоперационными осложнениями. Однако для летального исхода критерий Колмогорова–Смирнова не достигает достоверных значений, р = 0,121 (табл. 5). Стоит также отметить, что снижение клиренса креатинина в послеоперационном периоде было достоверным предиктором развития НПР на фоне применения АБП.
Частота инфекционных осложнений в послеоперационном периоде
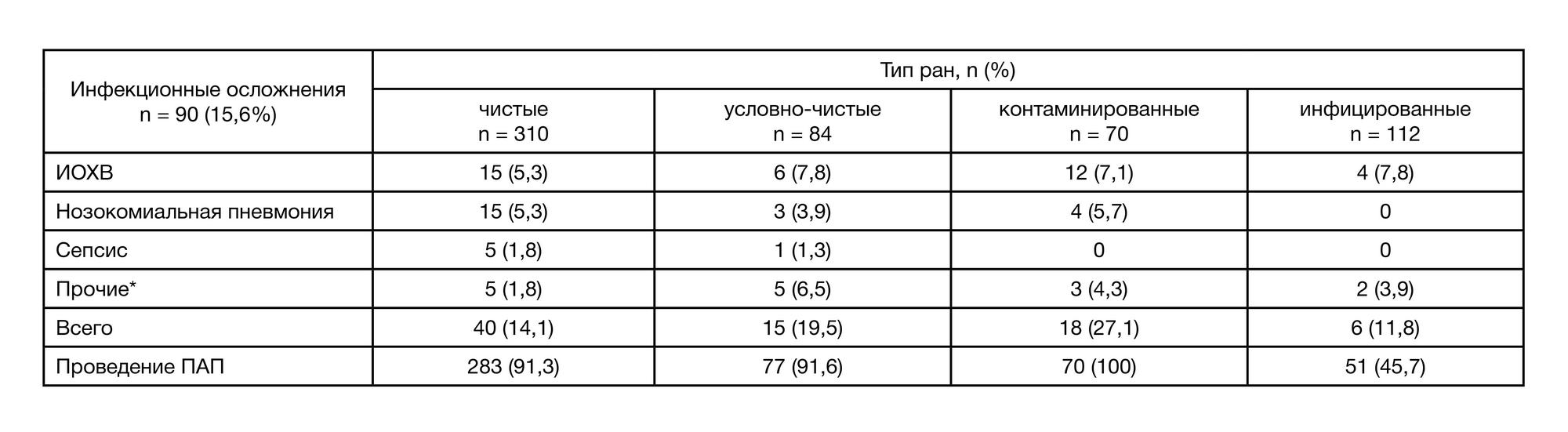
Инфекционные осложнения в послеоперационном периоде были отмечены в 90 (15,6%) случаях, среди которых преобладали ИОХВ (45; 50%) и инфекции нижних дыхательных путей (31; 34,4%; в том числе нозокомиальная пневмония у 24 (77,4%) и нозокомиальный трахеобронхит у 7 (22,6%) пациентов); сепсис (7; 7,8%); интраабдоминальные инфекции (6; 6,7%); инфекция мочевыводящих путей (1; 1,1%); инфекционный эндокардит (1; 1,1%). Частота инфекционных осложнений у пациентов с различными типами операционных ран представлена в табл. 6.
ПАП проводили большинству пациентов с чистыми (91,3%) и условно-чистыми (91,6%) ранами, на ее фоне частота инфекционных осложнений составила 14,1 и 19,5% соответственно (табл. 6). Всем пациентам с контаминированными ранами проводили ПАП, частота инфекционных осложнений составила 27,1% (n = 19). Особенностью группы больных с инфицированными ранами было отсутствие достоверных данных о назначении пациентам (61; 54,5%) АБП для периоперационной профилактики (за 30–60 мин до операции), несмотря на назначение АБП в послеоперационном периоде. В данной группе частота инфекционных осложнений была преимущественно выше у пациентов, которым не проводилась ПАП, 11 (18,03%), против 6 (11,8%) случаев инфекционных осложнений в группе, где ПАП проводили согласно стандартам. Повторные оперативные вмешательства потребовались в 86 (14,9%) случаях, из которых 32 (37,2%) случая были ассоциированы с инфекционными осложнениями, остальные 54 (62,8%) — не были.
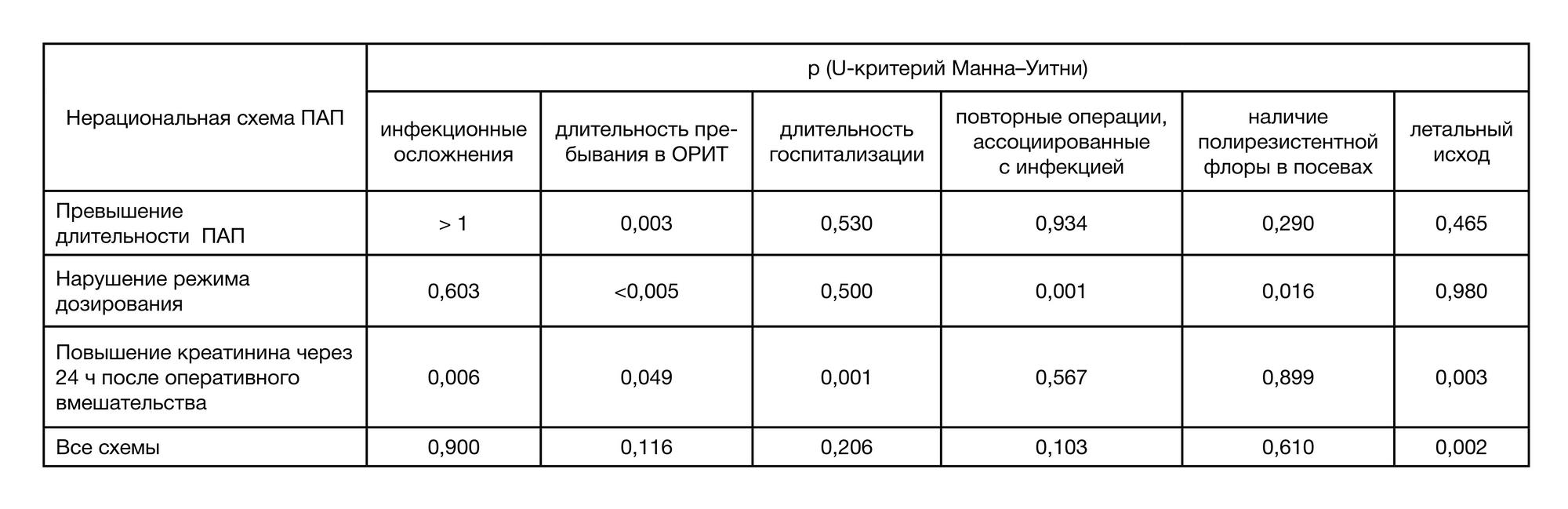
В ходе исследования провели дополнительный статистический анализ, позволяющий оценить наличие взаимосвязей различных факторов, таких как нерациональные схемы ПАП с клинико-демографическими особенностями пациентов (возраст, пол, ИМТ, основное заболевание, функциональное состояние почек, характер оперативного вмешательства, тип ран, объем кровопотери) и частотой инфекционных осложнений, с потребностью в повторных оперативных вмешательствах, длительностью госпитализации, длительностью пребывания в ОРИТ, ростом поли- резистентной флоры, уровнем летальности (табл. 7).
Высокая степень статистической значимости выявлена в отношении взаимосвязи нерациональных схем ПАП с уровнем летальности (р = 0,002), нерациональной длительности ПАП и нарушений режимов дозирования — с длительностью пребывания в ОРИТ (р = 0,003 и р < 0,005 соответственно). Нарушение режима дозирования также повышает потребность проведения повторных вмешательств, ассоциированных с инфекцией (р = 0,001).
Важным является и тот факт, что повышенный уровень креатинина через 24 ч после оперативного вмешательства, как маркер функционального состояния почек, имеет достоверные взаимосвязи с частотой инфекционных осложнений (р = 0,006), длительностью пребывания в ОРИТ (р = 0,049), длительностью госпитализации (р = 0,001) и уровнем летальности (р = 0,003).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рациональное проведение ПАП — один из основных инструментов регулирования внутрибольничной инфекции у пациентов хирургического профиля. Проведение ПАП преследует цель снизить уровень послеоперационных осложнений, длительность пребывания в ОРИТ, в стационаре, показатели летальности от гнойно-септических осложнений. В изучении приверженности рекомендациям по проведению рациональной ПАП необходимо активное участие специалистов различного профиля: хирургов, анестезиологов, клинических фармакологов, эпидемиологов и администрации.
Результаты нашего исследования свидетельствуют, что проводимая ПАП соответствует международным и национальным рекомендациям в 52,4%. Достаточно высокий уровень несоответствия рекомендациям режимов ПАП (47,6%) характеризуется нерациональным выбором антибактериального препарата, необоснованной длительностью (85,4%) и нарушением режимов дозирования (66,4%).
Необходимо отметить, что наши данные во многом согласуются с данными исследований Khan и соавт. [11], Vessal и соавт. [12] и El Hassan и соавт. [13] о недостаточной приверженности рекомендациям по проведению ПАП у пациентов хирургического профиля, при этом разброс приверженности рекомендациям варьирует от 1,7 до 82%. В большинстве этих исследований авторы делали акцент на изучение приверженности рекомендациям по времени назначения ПАП до операции.
По данным обзора Gouvêa и соавт., показатель приверженности схемам ПАП в изученных исследованиях составил 70,3–95%, рациональное назначение ПАП отмечено в 22–95%, нерациональное использование — в 2,3–100%, нарушение сроков введения АБП до операции — в 73– 100%, общее соблюдение сроков ПАП — в 5,8–91,4% [14].
В ходе ретроспективного исследования Prospero и соавт. изучили приверженность рекомендациям за 6-летний период, которая составила 58%, при этом на частоту инфекционных осложнений в послеоперационном периоде наибольшее влияние оказывали длительность операции (OR 1,68; 95% CI: 1,56–1,82) и срочное оперативное вмешательство (OR 2,16; 95% CI: 1,96–2,37). Авторы также отметили, что несмотря на достаточно низкую приверженность рекомендациям по ПАП, в группе, где соблюдали протоколы проведения ПАП, наблюдалось снижение частоты инфекционных осложнений [15].
С целью преодоления низкой приверженности рекомендациям эксперты ВОЗ советуют использовать чек-листы для периоперационного ведения больных, в том числе для соблюдения режима проведения ПАП, что должно способствовать улучшению междисциплинарной комплаентности при проведении ПАП [16].
Кроме изучения комплаентности рекомендациям ПАП, особое внимание ряд исследователей уделял исследованию структуры назначения АБП для проведения ПАП. По нашим данным, отмечен высокий уровень назначения ЦФ III поколения, в том числе с антисинегнойной активностью. Результаты международных исследований Lautenbach и соавт. [17], Rodríguez-Baño и соавт. [18] демонстрируют высокий уровень корреляции между применением ЦФ III поколения и распространением штаммов продуцентов β-лактамаз расширенного спектра (БЛРС). Результаты нашего микробиологического мониторинга (n = 84) косвенно свидетельствуют о высоком уровне выделения штаммов БЛРС+ (22; 26,2%). Появление штаммов, обладающих устойчивостью к карбапенемам Carb+ (23; 27,4%), также является тревожным фактом, поскольку при развитии инфекционных осложнений, ассоциированных с такими госпитальными штаммами, спектр выбора АБП резко ограничен.
Полученные нами данные о безопасности назначения АБП (случаи развития НПР —23; 3,99%) свидетельствуют о достаточно высокой частоте антибиотик-ассоциированного колита на фоне применения ЦФ (9; 1,6%) и эпизодов психомоторного возбуждения у больных пожилого возраста на фоне назначения ципрофлоксацина в комбинациях с метронидазолом (6; 1,04%).
По данным эпидемиологических исследований, антибиотик-ассоциированная диарея развивалась у 8% госпитализированных больных, из которых в 1–3% случаев было отмечено фульминантное течение. Авторы исследования пришли к выводам, что кроме АБП факторами риска могут быть антихолинергические препараты и препараты, замедляющие перистальтику кишечника [19].
По данным обзора Grill и соавт., распространенность неврологических нарушений на фоне назначения пациентам хирургического профиля фторхинолонов в комбинациях достаточно высока. При этом спектр нарушений включает не только эпизоды психомоторного возбуждения, но и эпизоды судорог, миоклонус, делирий, дизартрию, атаксию. Наиболее часто тяжелые неврологические реакции были отмечены в группе пожилых пациентов и у пациентов с отягощенным неврологическим анамнезом. Авторы отмечают, что неврологические побочные реакции возникают с одинаковой частотой на фоне применения любых фторхинолонов [20].
Увеличение риска развития НПР на фоне длительной избыточной ПАП является весомым аргументом в пользу следования существующим рекомендациям. Данные корреляционного анализа нашего исследования свидетельствуют о связи НПР с такими показателями, как длительность госпитализации (r = 0,291, p < 0,0001), длительность пребывания в ОРИТ (r = 0,374; p < 0,0001), уровень летальности (r = 0,269; p < 0,0001), длительность ИВЛ (r = 0,249; p < 0,0001).
Особое внимание обращает на себя факт взаимосвязи уровня креатинина и клиренса креатинина (р < 0,0001), как маркера нарушения функции почек, с частотой развития НПР на фоне назначения АБП. В исследованиях [21, 22] было показано, что снижение функции почек ведет к изменению параметров фармакокинетики АБП и в ряде случаев увеличивает риск развития НПР, в том числе жизнеугрожающих. Данные результаты требуют проведения дополнительных проспективных исследований.
ВЫВОДЫ
В реальной клинической практике сохраняется низкий уровень приверженности рекомендациям по проведению периоперационной профилактики.
Показана взаимосвязь использования нерациональных комбинаций с уровнем летальности, нерациональной длительности ПАП с длительностью пребывания в ОРИТ, нарушений режимов дозирования АБП с частотой повторных оперативных вмешательств, ассоциированных с инфекцией, и длительностью пребывания в ОРИТ.
НПР достоверно являются факторами риска увеличения длительности ИВЛ, длительности пребывания в ОРИТ и длительности госпитализации.
С учетом выявленного достоверного влияния уровня креатинина на риск развития инфекционных осложнений и уровень летальности можно предполагать высокую прогностическую значимость функции почек, что требует проведения дополнительных проспективных клинических исследований в данной когорте пациентов.
- Асланов Б. И., Зуева Л. П., Колосовская Е. Н., Любимова А. В., Хорошилов В. Ю., Долгий А. А. и др. Принципы организации периоперационной антибиотикопрофилактики в учреждениях здравоохранения. Федеральные клинические рекомендации. М.; 2014. 42 с.
- Gu Y, Kaku M. How can we fight against antimicrobial-resistant bacteria in the World Health Organization Western Pacific Region? Western Pac Surveill Response J. 2012 Jul 30; 3 (3): 40–2.
- Spellberg B, Gilbert DN. The future of antibiotics and resistance: a tribute to a career of leadership by John Bartlett. Clin Infect Dis. 2014 Sep 15; 59 Suppl 2: S71–5.
- Michael CA, Dominey-Howes D, Labbate M. The antimicrobial resistance crisis: causes, consequences, and management. Front Public Health. 2014 Sep 16; 2: 145.
- Bratzler DW, Dellinger EP, Olsen KM, Perl TM, Auwaerter PG, Bolon MK, et al. Clinical practice guidelines for antimicrobial prophylaxis in surgery. Am J Health Syst Pharm. 2013 Feb 1; 70 (3): 195–283.
- Harbarth S, Samore MH, Lichtenberg D, Carmeli Y. Prolonged antibiotic prophylaxis after cardiovascular surgery and its effect on surgical site infections and antimicrobial resistance. Circulation. 2000 Jun 27; 101 (25): 2916–21.
- Kachroo S, Dao T, Zabaneh F, Reiter M, Larocco MT, Gentry LO, et al. Tolerance of vancomycin for surgical prophylaxis in patients undergoing cardiac surgery and incidence of vancomycin- resistant enterococcus colonization. Ann Pharmacother. 2006 Mar; 40 (3): 381–5.
- Яковлев С. В., Журавлева М. В, Проценко Д. Н., Белобородов В. Б., Брико Н. И., Брусина Е. Б. и др. Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационар- ной медицинской помощи. Методические рекомендации для лечебно-профилактических учреждений Москвы. Consilium Medicum. Хирургия. (Прил.) 2017; 7.1: 15–51.
- Распоряжение Правительства РФ от 25 сентября 2017 г. № 2045-р «О Стратегии предупреждения распространения антимикробной резистентности в РФ на период до 2030 г.».
- ASHP therapeutic guidelines on antimicrobial prophylaxis in surgery. American Society of Health-System Pharmacists. Am J Health Syst Pharm. 1999 Sep 15; 56 (18): 1839–88.
- Khan AKA, Mirsh PV, Rashed MR, Banu G. A study on the usage pattern of antimicrobial agents for the prevention of surgical site infections (SSIs) in a tertiary care teaching hospital. J Clin Diagn Res. 2013 Apr; 7 (4): 671–4.
- Vessal G, Namazi S, Davarpanah MA, Foroughinia F. Evaluation of prophylactic antibiotic administration at the surgical ward of a major referral hospital, Islamic Republic of Iran. East Mediterr Health J. 2011 Aug; 17 (8): 663–8.
- El Hassan M, Elnour AA, Farah FH, Shehab A, Al Kalbani NM, Asim S, et al. Clinical pharmacists’ review of surgical antimicrobial prophylaxis in a tertiary hospital in Abu Dhabi. Int J Clin Pharm. 2015 Feb; 37 (1): 18–22.
- Gouvêa M, Novaes Cde O, Pereira DM, Iglesias AC. Adherence to guidelines for surgical antibiotic prophylaxis: a review. Braz J Infect Dis. 2015 Sep–Oct; 19 (5): 517–24.
- Prospero E, Barbadoro P, Marigliano A, Martini E, D'Errico M. Perioperative antibiotic prophylaxis: improved compliance and impact on infection rates. Epidemiol Infect. 2011 Sep; 139 (9): 1326–31.
- Практическое руководство по использованию контрольного перечня ВОЗ по хирургической безопасности, 2009 г. Безопасная хирургия спасает жизни [файл из интернета]. Женева, Швейцария: ВОЗ; 2009 [дата обращения: 15 января 2018 г.]: 20 с. Доступно по: http://apps.who.int/iris/bitstream/handle/10665/44186/9789244598597_rus.pdf/;jsessionid=4FAB6 A191F92C8A475119413079895C3?sequence=7
- Lautenbach E, Patel JB, Bilker WB, Edelstein PH, Fishman NO. Extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae: risk factors for infection and impact of resistance on outcomes. Clin Infect Dis. 2001 Apr 15; 32 (8): 1162–71.
- Rodríguez-Baño J, Picón E, Gijón P, Hernández JR, Cisneros JM, Peña C, et al. Risk factors and prognosis of nosocomial bloodstream infections caused by extended-spectrum-beta- lactamase-producing Escherichia coli. J Clin Microbiol. 2010 May; 48 (5): 1726–31.
- Greenstein AJ, Byrn JC, Zhang LP, Swedish KA, Jahn AE, Divino CM. Risk factors for the development of fulminant Clostridium difficile colitis. Surgery. 2008 May; 143 (5): 623–9.
- Grill MF, Maganti RK. Neurotoxic effects associated with antibiotic use: management considerations. Br J Clin Pharmacol. 2011 Sep; 72 (3): 381–93.
- Harris DG, McCrone MP, Koo G, Weltz AS, Chiu WC, Scalea TM, et al. Epidemiology and outcomes of acute kidney injury in critically ill surgical patients. J Crit Care. 2015 Feb; 30 (1): 102–6.
- Blot S, Lipman J, Roberts DM, Roberts JA. The influence of acute kidney injury on antimicrobial dosing in critically ill patients: are dose reductions always necessary? Diagn Microbiol Infect Dis. 2014 May; 79 (1): 77–84.