ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Микробиота кишечника здоровых новорожденных детей: новые технологии диагностики — новый взгляд на процесс становления
1 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени В. И. Кулакова, Москва
2 Центр стратегического планирования и управления медико-биологическими рисками здоровью, Москва, Россия
В настоящее время не существует критериев адекватной оценки качественного и количественного состава микробиоты кишечника новорожденных детей, что не дает возможности выявить на ранних сроках патологический процесс и скорректировать его. Целью исследования было изучить становление микробиоты кишечника у здоровых новорожденных в городе Москве, рожденных самопроизвольно и путем операции кесарева сечения, с помощью методов культуромики, протеомики и молекулярно-генетических технологий. Обследовано 66 детей: 33 ребенка, рожденных самопроизвольно, и 33 — путем операции кесарева сечения. Образцы просветной микрофлоры собирали на первые, седьмые и 30-е сутки жизни. Выделено 136 видов микроорганизмов, относящихся к 40 родам. Показано, что кесарево сечение тормозит процесс нормального становления микрофлоры кишечника, и в течение изучаемого периода (первого месяца жизни) микробиоценоз кишечника у таких детей не достигает показателей у детей, рожденных самопроизвольно. Статистически достоверно в группе самопроизвольных родов преобладали бифидобактерии (частота их встречаемости в титре 109–1012 КОЕ/г составила 84% против 33% при титре 105–1012 КОЕ/г в группе кесарева сечения). В то же время у детей, рожденных самопроизвольно, по сравнению с детьми, рожденными путем кесарева сечения, отмечена статистически достоверно более низкая частота обнаружения клостридий (33,3 и 65,4% соответственно) и лактозоотрицательных штаммов Escherichia coli (2,4 и 19,4% соответственно).
Ключевые слова: новорожденные, микробиота, микробиота кишечника
Вклад авторов в работу: Т. В. Припутневич — планирование исследования, организация микробиологических исследований, интерпретация данных; Е. Л. Исаева и В. В. Муравьева — проведение микробиологических исследований, подготовка черновика рукописи; А. Б. Гордеев — анализ и интерпретация данных; В. В. Зубков — планирование исследования, организация сбора проб фекалий; Л. А. Тимофеева и М. К. Месян — сбор проб фекалий; Е. Шубина — проведение секвенирования; В. В. Макаров и С. М. Юдин — планирование исследования.
Для корреспонденции: Алексей Борисович Гордеев
ул. Академика Опарина, д. 4, г. Москва, 117997; r.sertorp.agev@weedrog
В современных условиях характер микробной колонизации кишечника, в том числе у новорожденных детей, претерпел существенные изменения в связи с увеличением контингента женщин с осложненным течением беременности, возрастанием стрессовых воздействий, экологическим неблагополучием и бесконтрольным применением антибиотиков.
Углубленное изучение кишечной микробиоты с использованием возможностей культуромики, высокотехнологичных методов идентификации выделенных микроорганизмов (MALDI-TOF MS, секвенирования последовательностей гена 16S рРНК), а также современных технологий метагеномного анализа позволяет значительно расширить представление о ее видовом многообразии.
Принятые в настоящее время нормативы по качественному и количественному составу микробиоты кишечника [1–3] на этом фоне требуют корректировки. На сегодняшний день отсутствуют четко разработанные критерии оценки состояния микробиоты кишечника новорожденных, которые позволили бы своевременно корректировать выявленные нарушения и на ранних этапах влиять на патологический процесс, например развитие некротизирующего энтероколита у недоношенных детей. Существует крайне мало работ, в которых представлены статистически обработанные данные по качественному и количественному составам микробиоты кишечника новорожденных детей [4, 5].
Целью исследования было с помощью методов культуромики, протеомики и молекулярно-генетических технологий оценить становление микробиоты кишечника у здоровых новорожденных в городе Москве, рожденных самопроизвольно и путем операции кесарева сечения.
ПАЦИЕНТЫ И МЕТОДЫ
Проспективное исследование выполняли на когорте здоровых доношенных новорожденных. Рандомизацию проводили блочным методом, в результате которого были сформированы две группы детей:
1) группа I — 33 ребенка, родившихся самопроизвольно;
2) группа II — 33 ребенка, родившихся путем операции кесарева сечения.
Детей отбирали согласно следующим критериям включения в исследование: гестационный возраст — 38–40 недель; оценка по шкале Апгар на первой и пятой минутах жизни — 8–9 баллов; масса тела — более 2800 г. Всем новорожденным выполняли клинические анализы крови и мочи для исключения инфекционной патологии или других факторов, способных повлиять на формирование микробиоты кишечника. Все дети находились на грудном вскармливании, и в единичных случаях детей докармливали искусственными смесями. У всех матерей не было отмечено длительного безводного промежутка; антибиотики во время беременности принимали три женщины; истмико-цервикальная недостаточность имела место у четырех женщин (6%). В случае оперативного родоразрешения женщины получали амоксиклав в качестве антибиотикопрофилактики до и во время операции.
У новорожденных проводили трехкратный отбор проб фекалий: в первые сутки, конце первой недели и конце первого месяца жизни. Образцы мекония, полученного во время первой дефекации, или кала, собранные со стерильной пеленки в стерильный пластиковый контейнер, в течение 2 ч доставляли в лабораторию и незамедлительно приступали к посеву.
Изучение состава микробиоты кишечника новорожденных проводили c использованием расширенного спектра селективных и неселективных питательных сред и инкубированием в аэробных, микроаэрофильных и анаэробных условиях.
Посев мекония и кала проводили согласно принятым методикам [3, 6] на следующие питательные среды. Для выделения факультативно-анаэробных и аэробных микроорганизмов использовали колумбийский кровяной агар, хромогенную среду Brilliance, сальмонелла-шигелла-агар, декстрозный агар Сабуро (Oxoid; Великобритания), маннит-солевой агар (Himedia; Индия), среду для выявления и дифференциации Streptococcus agalactiae (CHROMagar; Франция), энтерококковый агар, агар Эндо (ФГУН «ГИЦПМ и Б»; Россия). Лактобациллы культивировали на среде лактобакагар (ФГУН «ГИЦПМ и Б»; Россия). Строгие анаэробы выделяли на агаре для бифидобактерий (Himedia; Индия), прередуцированном агаре Шедлера с необходимыми добавками, основном агаре для анаэробов, перфрингенс агаре, железосульфитном агаре, селективном агаре для Clostridium difficile (Oxoid; Великобритания). Для культивирования микроаэрофилов использовали СО2-инкубатор (Jouan; Франция) с концентрацией СО2 5%. Строгие анаэробы культивировали в анаэробном боксе (Jouan; Франция) в атмосфере трехкомпонентной газовой смеси (N2 — 80%; CO2 — 10%; Н2 — 10%). Для контроля стерильности использовали тиогликолевый бульон (Oxoid; Великобритания).
Идентификацию микроорганизмов осуществляли с помощью времяпролетного MALDI-TOF масс-спектрометра AutoFlex III c программным обеспечением Maldi BioTyper (Bruker Daltoniks; Германия) версии 3.0. При получении значений SCORE > 2,0 культуру считали с высокой вероятностью идентифицированной до вида. При значениях SCORE в диапазоне 1,7–2,0 культуру считали идентифицированной до рода.
Для всех трудноидентифицируемых штаммов (при значении SCORE < 2,0) проводили секвенирование последовательностей гена 16S рРНК. ДНК культур выделяли с использованием набора реагентов для выделения ДНК «Проба-ЦиТо» («ДНК-технология»; Россия). Для секвенирования использовали два фрагмента ДНК: ампликон длиной ~440 п. н., соответствующий позициям 339–785 гена 16S рРНК, и ампликон длиной ~1340 п. н., соответствующий позициям 42–1380 гена 16S рРНК. Амплификацию проводили с использованием детектирующего амплификатора ДТпрайм («ДНК- технология»; Россия). Секвенирование осуществляли на приборе 3130 Genetic Analyzer (Applied Biosystems; США) с использованием набора BigDye™ Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems; США) согласно протоколу производителя. Для видовой идентификации использовали свободно доступный в Интернете программный пакет BLAST (National Center for Biotechnology Information; США).
При статистической обработке данных для определения различий в частоте встречаемости микроорганизмов в зависимости от способа родоразрешения использовали точный тест Фишера. В качестве описательной статистики для характеристики степени микробной обсемененности использовали медиану и интерквартильное расстояние (ИКР).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
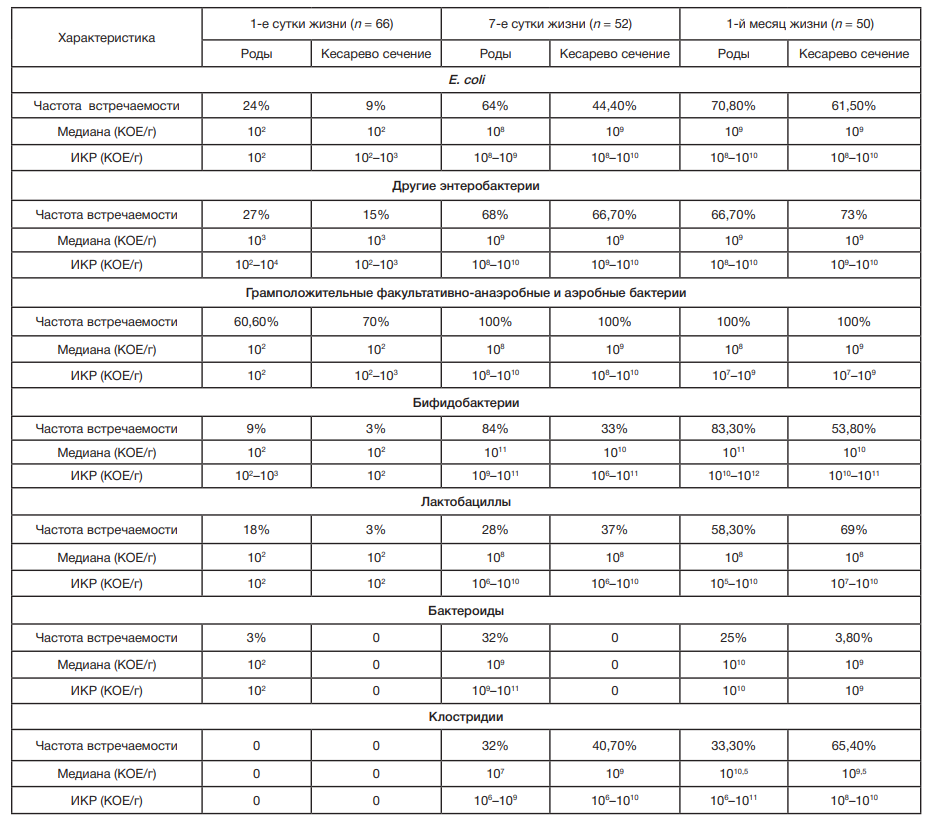
В первой временной точке обследовано 66 детей, по 33 ребенка из каждой группы. У каждого пятого ребенка меконий оказался стерильным, причем у детей II группы в 2 раза чаще по сравнению с I группой (9 и 4 соответственно; р > 0,05). У детей с положительными результатами посевов мекония выделена разнообразная микрофлора (63 вида, средний показатель видового разнообразия составил 3,8 вида на одного ребенка). Наиболее часто (в 60% случаев в титре 102–103 КОЕ/г после самопроизвольных родов и в 70% случаев в титре 102–104 КОЕ/г — после операции) выделяли грамположительные факультативно-анаэробные микроорганизмы, представленные 10 родами: Staphylococcus, Streptococcus, Enterococcus, Micrococcus, Gemella, Globicatella, Granulicatella, Rothia; Corynebacterium, Bacillus. Обращает на себя внимание, что у 12,2% детей II группы и у 6,1% детей I группы обнаружен Staphylococcus aureus (S. aureus). Escherichia coli, в норме составляющая значительную часть нормофлоры кишечника, при самопроизвольных родах выделена почти в 3 раза чаще (24,2 и 9,1%; p > 0,05). Прочие энтеробактерии также чаще выделяли у детей I группы (27 и 15% соответственно; p > 0,05). Pseudomonas aeruginosa обнаружена только у одного ребенка II группы.
Наиболее важную роль в становлении микробиоты кишечника новорожденного играют лактобациллы и бифидобактерии. Эти микроорганизмы обнаружены уже в первые сутки жизни. В группе I колонизация кишечника лактобациллами оказалась значительно выше (18 и 3% соответственно; p > 0,05), и это были Lactobacillus crispatus и Lactobacillus jensenii, относящиеся к числу доминирующих видов в вагинальной микробиоте здоровых женщин. Бифидобактерии также чаще выделяли у детей I группы (9 и 3% соответственно; p > 0,05). Ими оказались Bifidobacterium bifidum, B. longum, B. adolescentis. Бактероиды в первые сутки жизни обнаружили лишь у одного ребенка I группы. Прочие анаэробы (вейлонеллы, превотеллы и кампилобактеры) выделяли практически только во II группе.
Ввиду отказа некоторых родителей от участия в исследовании или возникновения инфекционного заболевания часть детей выбыла из исследования в течение первой недели жизни, и во второй точке было обследовано 52 ребенка: 25 детей из I группы и 27 детей из II группы.
Средний показатель видового разнообразия возрос по сравнению с первой точкой почти в 3 раза и составил 9,4 вида на одного ребенка. Как и в первые сутки жизни, в обеих группах наиболее часто встречались грамположительные факультативно-анаэробные микроорганизмы (9 родов). Их титр заметно вырос: после естественных родов — до 107–1011, после кесарева сечения — до 107–1012 КОЕ/г, а частота встречаемости составила 100% в обеих группах. Увеличилась частота выделения S. aureus: у 44% детей I группы и у 55,6% детей II группы. Расширилась представленность энтерококков с двух до шести видов: Enterococcus faecalis, E. durans, E. faecium, E. gilvus, E. avium, E. gallinarum. Доминирующую позицию, как и в первые сутки жизни, занимал E. faecalis, колонизировавший кишечник большей части новорожденных в обеих группах (80% — в I группе и 88,9% — во II группе).
Видовой спектр грамотрицательной факультативно- анаэробной микрофлоры расширился с 6 до 15 видов, относящихся к семейству Enterobactеriaceae. E. coli при самопроизвольных родах по-прежнему выделяли чаще (64% — в I группе и 44,4% — во II; p > 0,05). Прочие энтеробактерии высевали примерно с одинаковой частотой в обеих группах.
Видовой состав лактобацилл обогатился новыми видами: L. paracasei, L. curvatus, L. gasseri, L. fermentum, L. rhamnosus. Необходимо отметить, что виды лактобацилл, доминирующие в вагинальной микробиоте здоровых женщин (L. crispatus, L. jensenii и L. gasseri), обнаружены только в I группе.
Статистически достоверные различия наблюдали в представленности бифидобактерий. Если в группе I частота их встречаемости составила 84%, а титр находился в диапазоне 109–1012 КОЕ/г, то во II группе бифидобактерии выделены только у 33% в титрах 105–1012 КОЕ/г (p < 0,05). Видовой спектр бифидобактерий расширился с 3 до 7 видов: B. adolescentis, B. breve, B. dentium, B. catenulatum, B. bifidum, B. longum, B. animalis. Некоторые виды обнаружены только в одной из групп: B. adolescentis и B. catenulatum (только в I группе) и B. dentium и B. animalis (только во II группе).
К седьмым суткам жизни микробиота в значительной степени обогатилась за счет прочих облигатных анаэробов (11 родов): Bacteroides, Parabacteroides, Veillonella, Clostridium, Fusobacterium, Ruminococcus, Eubacterium, Eggerthella, Actinomyces, Collinsellа, Propionibacterium. При этом бактероиды, представленные Bacteroides fragilis, B. ovatus, B. vulgatus, B. uniformis, Parabacteroides distasonis, выделены только у детей, рожденных самопроизвольно. Существенной разницы в частоте обнаружения клостридий (Clostridium perfringens, C. butyricum, C. innocuum, C. tertium) не выявлено. У одного ребенка II группы выделен штамм C. difficile. В обеих группах возросла колонизация кишечника вейлонелами.
Таким образом, к седьмым суткам жизни существенно увеличилось видовое разнообразие, касающееся различных групп микроорганизмов, как факультативно-анаэробного, так и облигатно-анаэробного происхождения. Бифидобактерии, лактобациллы и бактероиды преобладали в группе I.
В третьей точке обследовано 50 детей: 24 ребенка из группы I и 26 детей из группы II. Cредний показатель видового разнообразия составил 10,1 вида на одного ребенка. Как и в более ранние периоды, наиболее представленной была группа грамположительных факультативно-анаэробных микроорганизмов (7 родов). Частота выделения S. aureus мало изменилась в сравнении с седьмыми сутками в I группе (58,3%) и значительно выросла во II группе (76,9%). Видовой состав энтерококков пополнился еще двумя видами: E. casseliflavus и E. raffinosus.
В составе грамотрицательной факультативно-анаэробной микрофлоры выявлено 11 видов из семейства Enterobacteriaceae и один вид неферментирующих бактерий — Stenotrophomonas maltophilia. E. coli при самопроизвольных родах по-прежнему выделялась чаще (75% в I группе и 61,5% — во II; р > 0,05). Прочие энтеробактерии несколько чаще высевали у детей II группы (66,7 и 73% соответственно; p > 0,05).
Видовой состав лактобацилл расширился до 15 видов за счет L. reuteri, L. casei, L. vaginalis, L. brevis, L. helveticus, L. acidophilus, причем в I группе выделяли почти вдвое большее количество видов. Видовой спектр бифидобактерий увеличился на один вид B. ruminantium. Наиболее часто выделяли B. longum (58,3% в I группе и 26,9% — во II) и B. bifidum (33,3 и 34,6% соответственно).
Облигатные анаэробы пополнились родами Sutterella и Peptoniphilus. Бактероиды (6 видов), представленные B. fragilis, B. thetaiotaomicron, B. vulgatus, B. uniformis, B. cellulosilyticus, Parabacteroides distasonis, за исключением одного случая после кесарева сечения, выделены только у детей, рожденных путем самопроизвольных родов.
Наметилась статистически достоверная разница в частоте обнаружения клостридий (C. perfringens, C. butyricum, C. tertium, C. ramosum, C. paraputrificum, C. difficile): у 33,3% детей в I группе и 65,4% — во II (р < 0,05). Во II группе выделено в 2 раза больше видов клостридий.
У одного ребенка II группы выделен C. difficile.
Дрожжевые грибы рода Candida обнаружены в обеих группах только на 30-е сутки жизни менее чем у 10% детей.
Таким образом, на 30-е сутки жизни микробиота кишечника вне зависимости от способа родоразрешения представлена поликомпонентными ассоциациями микроорганизмов, относящихся к факультативным и облигатным анаэробам. В то же время наметились определенные различия, касающиеся облигатной и транзиторной составляющей микробиоты. Так, при самопроизвольном родоразрешении видовой состав лактобацилл был более разнообразным (почти вдвое большее количество видов), чаще выявляли виды, колонизирующие влагалище здоровых женщин. Бактероиды были преимущественно выделены у детей, рожденных самопроизвольно, а клостридии при большем видовом разнообразии, напротив, у детей, рожденных путем операции кесарева сечения. Условно-патогенные факультативные анаэробы (S. aureus и энтеробактерии, за исключением E. coli) чаще колонизировали детей, рожденных оперативным путем.
Гемолитические штаммы Enterococcus sp. и E. coli в обеих группах детей встречались с одинаковой частотой: Enterococcus sp. соответственно по 8,3% в каждой группе и E. coli — 9,5 и 9,7% соответственно. Лактозоотрицательные штаммы E. coli статистически достоверно чаще (в 8 раз) выделяли у детей II группы (19,4 и 2,4% соответственно; р < 0,05).
Суммарно в процессе исследования было выделено и идентифицировано 136 видов микроорганизмов, относящихся к 40 родам: Staphylococcus, Streptococcus, Corynebacterium, Micrococcus, Enterococcus, Rothia, Bacillus, Neisseria, Haemophilus, Gemella, Globicatella, Granulicatella, Escherichia, Klebsiella, Raoultella, Kluyvera, Enterobacter, Citrobacter, Proteus, Morganella, Pantoea, Pseudomonas, Stenotrophomonas, Candida, Lactobacillus, Bifidobacterium, Bacteroides, Propionibacterium, Veillonella, Clostridium, Ruminococcus, Eggertella, Fusobacterium, Eubacterium, Actinomyces, Collinsella, Prevotella, Campylobacter, Peptoniphilus, Sutterella.
Для уточнения видовой принадлежности 36 изолятов бактерий (SCORE < 2,0) потребовалось секвенирование гена 16S рРНК. Для большинства изолятов результаты секвенирования гена 16S рРНК совпали с результатами MALDI-TOF масс-спектрометрии. Лишь для 5 изолятов достоверную идентификацию удалось получить только методом секвенирования гена 16S рРНК. В ряде случаев точную видовую принадлежность близкородственных микроорганизмов установить не удалось при использовании обоих методов. К таким видам относились: Bifidobacterium kashiwanohense/Bifidobacterium pseudocatenulatum/ Bifidobacterium catenulatum, Lactobacillus casei/Lactobacillus paracasei, Actinomyces naeslundii/Actinomyces viscosus, Actinomyces radingae/Actinomyces ihumii. Расхождение идентификации касалось 11 изолятов: для 7 изолятов методом MALDI-TOF масс-спектрометрии не удалось правильно определить родовую принадлежность микроорганизмов и для 4 изолятов — видовую.
Обобщенные данные по частоте встречаемости и степени микробной обсемененности кишечника новорожденных в зависимости от способа родоразрешения, позволяющие в первом приближении охарактеризовать показатели микрофлоры здоровых детей, представлены в таблица.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
До недавнего времени считалось, что желудочно- кишечный тракт новорожденного стерилен в течение 10–20 ч (асептическая фаза) [7], а первичная микробная колонизация при самопроизвольных родах осуществляется за счет микрофлоры влагалища матери, основу которой составляют лактобациллы [8–11]. Между тем появилась и другая точка зрения, основанная на результатах экспериментальных работ [12]. Из недавно опубликованных данных следует, что нормальная микрофлора кишечника у плода закладывается во второй половине беременности от матери при помощи феномена бактериальной транслокации, и утверждение о том, что плод находится в стерильных условиях, оспаривается рядом ученых [13–15]. В нашем исследовании меконий, полученный во время первого акта дефекации в первые часы жизни, был нестерилен у 53 из 66 новорожденных (80%), что не исключает внутриутробной колонизации.
По данным литературы, в первые часы и сутки жизни происходят активная колонизация и рост кишечной палочки, энтерококков (стадия «нарастающей колонизации»), что не зависит от степени зрелости, перинатальных условий развития плода и вида вскармливания [16–19]. Титр энтеробактерий в этот период достигает 109 КОЕ/г фекалий [20], тогда как анаэробы — бифидобактерии, лактобациллы, бактероиды — обычно отсутствуют [21]. Наши данные свидетельствуют, что в первые часы жизни кишечник колонизировали в основном грамположительные кокки (Staphylococcus spp, Streptococcus spp), причем в большей степени после операции кесарева сечения, чем после родов (частота встречаемости 70 и 60,6%, титры — до 104 и 103 КОЕ/г соответственно). Энтеробактерии и облигатно-анаэробные микроорганизмы в этот период времени выявляли редко и в низком титре. Вместе с тем, уже в первые часы жизни в составе микробиоты у детей, рожденных естественным путем, чаще, чем при кесаревом сечении, обнаружены бифидобактерии (9 и 3% соответственно) и лактобациллы (18 и 3% соответственно). Только у 3% детей, рожденных самопроизвольно, обнаружены бактероиды. Возможной причиной расхождения наших данных с результатами других авторов является то, что мы старались получить биоматериал непосредственно во время первого акта дефекации новорожденного.
В дальнейшем у здоровых младенцев идет активный рост анаэробной и факультативно-анаэробной составляющей микрофлоры в количествах 105–107 КОЕ/г [15]. К шестым суткам устанавливается равновесие аэробной и анаэробной частей микрофлоры, далее происходит нарастание лакто- и бифидофлоры, и к 2 месяцам жизни она достигает значений 109–1010 КОЕ/г.
По данным других авторов, с 3–5 дня наступает стадия «трансформации микрофлоры», в результате которой происходит вытеснение бифидофлорой других микроорганизмов. В этот период бифидобактерии становятся основной (резидентной) микрофлорой кишечника [22–24]. Доминирующее положение бифидофлора начинает занимать к 5–20-му дню жизни [25]. Наши данные к 7-м суткам жизни имеют определенные отличия: общее количество микроорганизмов возрастает, достигая 1010–12 КОЕ/г.
Это свидетельствует о том, что равновесие факультативно- аэробной и облигатно-анаэробной составляющих микробиоты также наступает к первой неделе, но при более высокой степени микробной колонизации кишечника различными микроорганизмами. Обращает на себя внимание то, что при кесаревом сечении наблюдалось отставание колонизации кишечника бифидобактериями и преобладание прочих строгих анаэробов (в основном вейлонелл, клостридий).
К концу первого месяца жизни анаэробная часть микробиоты заняла лидирующее положение с доминированием бифидофлоры в обеих группах. Тем не менее после кесарева сечения бифидофлора была выявлена лишь у половины детей, тогда как после самопроизвольных родов этот показатель достиг 83%.
Характерные для детей первого года жизни B. longum subsp. infantis, B. animalis subsp. lactis, B. breve, B. bifidum обладают противовоспалительным действием и способствуют формированию Th1-иммунного ответа. Преобладающие штаммы бифидобактерий у взрослых — B. longum subsp. longum, B. adolescentis, B. pseudocatenulatum — способствуют Th2-иммунному ответу и превалируют в микробиоте кишечника при ожирении [24]. Кроме того, B. longum subsp. infantis отличается наличием в геноме кластера, кодирующего синтез ферментов (сиалидазы, фукозидазы, N-ацетил- β-гексозаминидазы и β-галактозидазы), расщепляющих олигосахариды до моносахаридов [25]. Бифидофлора кишечника в течение всей жизни остается превалирующей и является апатогенной, в то время как иные представители облигатной микрофлоры при определенных условиях могут стать причиной заболевания [13]. Полученные нами результаты показали, что после операции кесарева сечения у новорожденных доминируют не самые полезные виды бифидобактерий, в частности, не способные расщеплять лактозу (B. animalis, B. dentium, B. ruminantium).
ВЫВОДЫ
Полученные нами результаты подтверждают, что оперативное родоразрешение в определенной степени сдерживает процесс нормального становления микробиоты кишечника. В дальнейшем мы планируем продолжить накапливать информацию о состоянии микробиоты у данной категории детей и расширить исследование, включив в него недоношенных детей, с целью определения критериев нормы кишечной микробиоты здоровых доношенных новорожденных. Проведенное исследование позволило создать, а в перспективе пополнять коллекцию лактобацилл и бифидобактерий, выделенных у здоровых доношенных новорожденных для выявления бактерий — претендентов в пробиотические штаммы. Своевременная адекватная оценка состава микробиоты новорожденных по показателям ключевых биомаркеров позволит проводить направленную профилактику ближайших и отдаленных последствий перинатальной патологии у доношенных и недоношенных новорожденных путем ее коррекции с использованием адекватной композиции пробиотиков.
- ОСТ 91500.11.0004-2003. Протокол ведения больных. Дисбактериоз кишечника. Утв. Приказом МЗ РФ № 231 от 09.06.2003. Москва, 2003; 173 с.
- Методические рекомендации «Бактериологическая диагностика дисбактериоза кишечника». Минздрав РСФСР. 1977.
- Методические рекомендации «Микробиологическая диагностика дисбактериоза кишечника». Москва, 2007.
- Gronlund MM. Arvilommi H, Kero P, Lehtonen OP, Isolauri E. Importance of intestinal colonization in the maturation of humoral immunity in early infancy: a prospective follow up study of healthy infants aged 0–6 months. Arch Dis Child Fetal Neonatal. 2000; 83 (3): 186–92.
- Леванова Л.А. Микроэкология кишечника жителей Западной Сибири, коррекция дисбиотических состояний [диссертация]. М., 2003.
- Щербаков П. Л., Нижевич А. А., Логиновская В. В., Щербакова М. Ю., Кудрявцева Л. В., Митрохин С. Д. и др. Микроэкология кишечника у детей и ее нарушения. Фарматека. 2007; (14): 28–34.
- Акоев Ю. С. Функциональные особенности недоношенных детей в раннем онтогенезе [диссертация]. М., 1999.
- Копанев Ю. А., Соколов А. Л. Дисбактериоз кишечника: микробиологические, иммунологические и клинические аспекты микроэкологических нарушений у детей. М., 2002.
- Степурина О. В. Первичное инфицирование ребенка. Инфекционные заболевания детей и экология человека. Ставрополь, 1999; 92–7.
- Фролова Н. А. Особенности формирования микробиоценоза у детей раннего возраста в зависимости от микробного пейзажа кишечника матери [диссертация]. Смоленск, 2001.
- Никитенко В. И., Ткаченко Е. И., Стадников А. А. Транслокация бактерий из желудочно-кишечного тракта — естественный защитный механизм. Эксперимент. и клин. гастроэнтерол. 2004; (1): 48.
- Funkhouser LJ, Bordenstein SR. Mom knows best: the universality of maternal microbial transmission. PLoS Biol. 2013; (11): e1001631.
- Muglia LJ, Katz M. The enigma of spontaneous preterm birth. N Engl J Med. 2010; 362: 529–35.
- Onderdonk AB, Hecht JL, McElrath TF, Delaney ML, Allred EN, Leviton A. Colonization of second-trimester placenta parenchyma. Am J Obstet Gynecol. 2008; 199: 51–2.
- Соловьева И. В., Белова И. В., Точилина А. Г., Ефимов Е. И., Пожидаева А.С. Формирование микрофлоры толстой кишки у детей. Микробиологический и эпидемиологический вестник Нижегородского университета им. Н. И. Лобачевского. 2012; (2–3): 93–9.
- Fanaro S, Chierici R, Guerrini P, Vigi V. Intestinal microflora in early infancy: composition and development. Acta pediat. 2003; 91 (441): 48–55.
- Orrhagt K, Nord CE. Factors controlling the bacterial colonization of the intestine in breastfed infants. Acta Pediatr. 1999; 88 (430): 47–57.
- Edwards CA, Parret AM. Intestinal flora during the first months of life: new perspectives. Br J Nutr. 2002; 88 (11): 11–8.
- Goldman AS. Modulation of the gastrointestinal tract of infants by human milk. Interfaces and interactions. An evolutionary perspective. J Nutr. 2000; 130 (2): 426–31.
- Нетребенко О. К. Питание грудного ребенка и кишечная микрофлора. Педиатрия. 2005; (3): 53–7.
- Ткаченко Е. И., Суворова А. Н., редакторы. Дисбиоз кишечника. Руководство по диагностике и лечению. СПб. ИнформМед, 2009; 276 с.
- Шабалов Н. П. Неонатология. М.: Медпресс-информ, 2004; с.128–29.
- Нетребенко О. К. Питание и развитие иммунитета у детей на разных видах вскармливания. Педиатрия. Журнал им. Г. Н. Сперанского. 2005; (6): 50–6.
- Печкуров Д. В., Турти Т. В., Беляева И. А., Тяжева А. А. Микробиота кишечника у детей: от профилактики нарушений становления к предупреждению неинфекционных заболеваний. Педиатрическая фармакология. 2016; 13 (4): 377–83.
- Суворов А. Н. Микробиота детей. Природа. 2011; (8): 14–21.