ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Изменение температурной болевой чувствительности у крыс после введения N-концевых аналогов адренокортикотропного гормона
1 Курский государственный медицинский университет, Курск, Россия
2 Институт молекулярной генетики, Москва, Россия
Меланокортины (МК) — один из активно исследуемых классов пептидных регуляторов c широким спектром биологических эффектов. В структуре всех природных МК присутствует общий фрагмент — His-Phe-Arg-Trp (HFRW), соответствующий последовательности с 6-го по 9-й аминокислотный остаток молекулы адренокортикотропного гормона (АКТГ6-9) и являющийся ее активным центром. Показано, что присоединение к С-концу аминокислотной последовательности Pro-Gly-Pro (PGP) приводит к пролонгации действия пептидов. Целью работы было изучить влияние эффектов АКТГ6-9-PGP (HFRWPGP) на спинальные и супраспинальные механизмы формирования болевой чувствительности у крыс, а также сравнить их с эффектами его структурного аналога — АКТГ4-7-PGP (MEHFPGP). Эффекты АКТГ6-9-PGP были исследованы при его внутрибрюшинном введении в дозах 0,5, 1,5, 5, 15, 50, 150 и 450 мкг/кг за 15 мин до начала опыта по изучению температурной болевой чувствительности у крыс с использованием тестов «горячая пластина» и «отдергивание хвоста». Эффекты АКТГ4-7-PGP были исследованы в аналогичных условиях в дозах 50; 150 и 450 мкг/кг. Показано, что АКТГ6-9-PGP в дозах 5 и 150 мкг/кг вызывал выраженное снижение температурной болевой чувствительности через 15 и 45 мин после его внутрибрюшинного введения (p = 0,04), реализованного на супраспинальном уровне. В тесте «отдергивание хвоста» АКТГ6-9-PGP в дозе 150 мкг/кг повышал температурную болевую чувствительность с участием сегментарных спинальных механизмов (p = 0,04). АКТГ4-7-PGP не оказывал влияния на исследованные механизмы болевой чувствительности. Таким образом, установлено, что АКТГ6-9-PGP, в отличие от АКТГ4-7-PGP, способен обладать как анальгетическими, так алгическими эффектами.
Ключевые слова: боль, регуляторный пептид, АКТГ, горячая пластина, отдергивание хвоста
Вклад авторов в работу: С. А. Додонова, А. Е. Белых — сбор, обработка материала и статистический анализ данных; И. И. Бобынцев, Л. А. Андреева, Н. Ф. Мясоедов — концепция и дизайн исследования; С. А. Додонова, А. Е. Белых, И. И. Бобынцев — написание текста.
Для корреспонденции: Светлана Александровна Додонова
ул. К. Маркса, д. 3, г. Курск, 305004;
ur.liam@atevsavonodod
Известно, что регуляторные пептиды семейства меланокортинов и их фрагменты обладают широким спектром биологических эффектов, что послужило основанием для создания ряда синтетических аналогов с целью структурно-функционального анализа молекул и разработки фармакологических препаратов [1, 2]. Известно, что N-концевые участки адренокортикотропного гормона (АКТГ) оказывают нейротропное действие, в том числе на болевую чувствительность [3]. При этом последовательность His-Phe-Arg-Trp, соответствующая участку АКТГ6-9, необходима для активации всех видов меланокортиновых рецепторов [4]. Показано, что после присоединения трипептида Pro-Gly-Pro (PGP) к С-концу АКТГ6-9 для повышения устойчивости к действию карбоксипептидаз ряд его нейротропых эффектов сохранялся [5]. Однако влияние пептида АКТГ6-9-PGP на болевую чувствительность до настоящего времени не было изучено. В то же время структурно близкий синтетический фрагмент АКТГ4-7-PGP, являющийся активной субстанцией фармакологического препарата «семакс», обладает подобными эффектами [3]. Поэтому с целью структурно- функционального анализа N-концевых фрагментов АКТГ представлялось необходимым исследовать данный вид нейротропной активности у молекулы АКТГ6-9-PGP.
Целью данной работы было изучить влияние пептида АКТГ6-9-PGP на спинальные и супраспинальные механизмы формирования болевой чувствительности у крыс и сравнить с эффектами АКТГ4-7-PGP.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты выполняли на крысах-самцах Вистар массой 150–190 г (всего 121 животное). Крыс содержали в клетках по 10 особей в стандартных условиях вивария при 12-часовом световом режиме (12 ч — свет, 12 ч — темнота) и контролируемой температуре (22 ± 2 °С); животные получали стандартный гранулированный корм и воду в свободном доступе. Исследования проводили в промежуток времени с 9 до 15 ч.
Крысы были разделены на 11 групп (10 опытных и 1 контрольная) по 11 особей в каждой. Каждая опытная группа животных получала АКТГ6-9-PGP или АКТГ4-7-PGP (семакс) в одной из исследуемых доз. В работе применяли пептиды, синтезированные в Институте молекулярной генетики РАН. АКТГ6-9-PGP растворяли в физиологическом растворе 0,9% натрия хлорида и вводили животным первых семи опытных групп внутрибрюшинно в дозах 0,5, 1,5, 5, 15, 50, 150 и 450 мкг/кг однократно за 15 мин до начала эксперимента (одна доза на одну опытную группу).
АКТГ4-7-PGP также растворяли в физиологическом растворе и вводили животным из трех оставшихся опытных групп однократно внутрибрюшинно за 15 мин до начала опыта в дозах 50, 150 и 450 мкг/кг по аналогичной схеме. Группе контрольных животных вводили эквивалентные объемы физиологического раствора из расчета 1 мл на 1 кг массы.
Изучение болевой чувствительности при термическом воздействии проводили с использованием тестов «горячая пластина» и «отдергивание хвоста» [6] на специальном оборудовании (PanLab Harvard Apparatus; Испания): приборе «Hot plate» (модель LE7406), приборе «Tail-flick» (модель LE7106). В тесте «горячая пластина» при температуре 53 °С проводили четыре испытания с интервалом 15 мин: однократное измерение исходного болевого порога до введения пептидов и три измерения болевого порога после введения пептидов. Регистрировали время с момента помещения животного на горячую пластину до появления поведенческого ответа на ноцицептивный стимул (облизывание задних лап, выпрыгивание). В тесте «отдергивание хвоста» болевое раздражение наносили на середину хвоста локально тепловым излучением интенсивностью 50 ед. по шкале прибора и регистрировали латентный период реакции избавления от болевого раздражителя (отдергивание хвоста). Проводили пять измерений: дважды до введения пептида (с вычислением среднего значения исходного болевого порога) и три измерения болевого порога после введения пептида. Все измерения проводили с интервалом в 15 мин. При обработке полученных результатов рассчитывали величину максимально возможного эффекта (МВЭ) по формуле [6]:
формула
где ЛПоп — латентный период реакции после введения вещества, ЛПконтр — латентный период реакции до введения вещества, МАХвремя — максимальное время нанесения раздражителя (45 с — для теста «горячая пластина» и 9 с — для теста «отдергивание хвоста»).
Статистическую обработку проводили с использованием программного обеспечения «MS Excel 2016» (Microsoft; США), программы «Statictica 13.3» (StatSoft; США) и программной среды вычислений R (The R Foundation for Statistical Computing; Австрия). Характер распределения признаков в статистической выборке определяли с помощью критерия Шапиро–Уилка, оценку равенства дисперсий — с помощью критерия Левене (пакет lawstat). Полученные результаты выражали в виде медианы (Me), нижнего (25) и верхнего (75) перцентилей (Q1 и Q3). Значимость данных оценивали с применением непараметрического однофакторного дисперсионного анализа с помощью критерия Краскела–Уоллиса, для выявления межгрупповых различий в качестве post-hoc- анализа использовали критерий Манна–Уитни (U-тест) с поправкой Бенджамини–Хохберга. Критический уровень значимости (р-value) при проверке статистических гипотез принимали равным 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
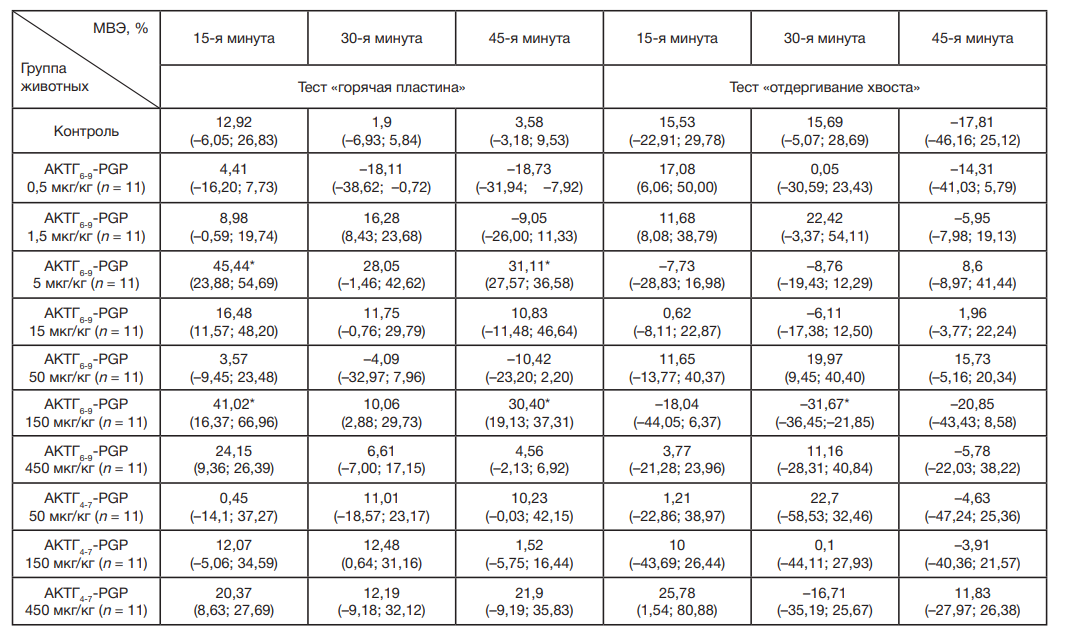
Введение пептида АКТГ6-9-PGP дозозависимо влияло на изменение величины максимально возможного эффекта в тесте «горячая пластина» (см. таблица). Так, после введения пептида в дозе 5 мкг/кг на 15-й и 45-й минутах наблюдали наиболее выраженный анальгетический эффект с достоверным увеличением болевого порога в 2,5 и 7 раз соответственно (p = 0,04 и p = 0,02). При уменьшении вводимой дозы до 1,5 мкг/кг пептид не оказывал существенного влияния на болевую чувствительность. Однако дальнейшее снижение дозы до 0,5 мкг/кг привело к смене направленности эффекта: через 30 мин после введения АКТГ6-9-PGP наблюдали тенденцию к алгическому эффекту — снижению величины МВЭ на 193% (p = 0,15), которое сохраняется до 45-й мин эксперимента (p = 0,07).
Увеличение вводимой дозы АКТГ6-9-PGP до 15 мкг/кг не сопровождалось достоверным эффектом. При использовании пептида в дозе 50 мкг/кг отмечена тенденция к алгическому эффекту через 45 минуты (p = 0,1). Последующее повышение дозы до 150 мкг/кг вновь сопровождалось достоверным увеличением болевого порога на 15-й (p = 0,04) и 45-й (p = 0,04) минутах после введения пептида. В дозе 450 мкг/кг АТКГ-6-9-PGP не оказывал достоверного влияния на исследованные показатели.
Введение АКТГ4-7-PGP на протяжении всего теста «горячая пластина» не приводило к достоверным различиям между животными опытных групп во всех используемых дозах по сравнению с контрольной.
При исследовании влияния АКТГ6-9-PGP на величину болевого порога у крыс в тесте «отдергивание хвоста» в группах животных, получавших пептид в дозах 0,5, 1,5, 15, 50 и 450 мкг/кг, достоверных изменений порогов болевой чувствительности выявлено не было (см. таблица).
Важно отметить, что при отсутствии достоверных эффектов пептида в тесте «горячая пластина» в дозах 5 и 150 мкг/кг через 30 мин после введения в тесте «отдергивание хвоста» АКТГ6-9-PGP оказывал влияние на температурную болевую чувствительность в аналогичном интервале времени: в дозе 150 мкг/кг наблюдали достоверное снижение болевого порога (p = 0,04), а в дозе 5 мкг/кг — тенденцию к алгическому эффекту (p = 0,1).
При исследовании влияния АКТГ4-7-PGP на болевую чувствительность в тесте «отдергивание хвоста» достоверных изменений зафиксировано не было.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Биологические эффекты меланокортинов реализуются через различные типы меланокортиновых рецепторов (MCR). В частности, MСR1 экспрессируется в нейронах околоводопроводного серого вещества, МСR3 — в коре и таламусе, МСR4 — в стволе головного мозга. Активация указанных структур играет важную роль в формировании боли, ограничивая ее развитие [7, 8]. Учитывая, что болевые реакции в тесте «горячая пластина» формируются с участием супраспинальных структур [6], взаимодействие АКТГ6-9-PGP с тем или иным типом рецепторов в головном мозге может оказывать влияние на исследованный вид болевой чувствительности.
Кроме того, МСR4 обнаруживаются в структурах спинного мозга [3, 8] и изменение их активности после введения АКТГ6-9-PGP может оказывать влияние на функционирование сегментарных механизмов боли, наблюдавшееся в тесте «отдергивание хвоста». При этом вопрос о действии аналогов АКТГ через меланокортиновые рецепторы остается открытым и можно предполагать наличие как минимум еще одного неописанного подтипа рецепторов [9, 10].
Отмеченные различия в выраженности и направленности эффектов пептида при использовании различных доз могут быть обусловлены как взаимодействием пептида с теми или иными типами MCR по пути его распространения по структурам мозга, так и с возможными особенностями внутриклеточных механизмов реализации его действия. В частности, трансмембранная и последующая внутриклеточная передача сигнала с одного и того же MCR в зависимости от концентрации лиганда может быть осуществлена различными путями: за счет активации цАМФ, инозитолфосфатной системой [1, 11], а также Са2+ и протеинкиназами [1]. Данные особенности установлены для всех типов меланокортиновых рецепторов [1]. Активация того или иного механизма передачи сигнала влияет на направленность, силу и продолжительность эффекта, вызванного соответствующим стимулом [1, 2]. Указанные выше факты согласуются с установленными в нашей работе дозозависимыми и разнонаправленными изменениями болевой чувствительности после введения АКТГ6-9-PGP, что характерно для регуляторных пептидов как особого класса биологически активных веществ [11 12].
Установленная в ряде случаев разнонаправленность эффектов АКТГ6-9-PGP также согласуется с данными литературы о противоречивости влияния фрагментов и аналогов АКТГ на формирование боли [3, 13]. При этом можно предположить, что механизмы влияния на боль АКТГ6-9-PGP могут иметь сходство с таковыми для его структурно близкого аналога — АКТГ4-7-PGP (семакса), который при периферическом введении снижает болевую чувствительность, реализуя свои эффекты в том числе через опиоидные и серотониновые рецепторы [3].
В связи с тем, что последовательность АКТГ6-9 необходима для активации всех видов меланокортиновых рецепторов [4], отмеченное в работе влияние АКТГ6-9-PGP на болевую чувствительность в сравнении с АКТГ4-7-PGP может быть следствием возможности его взаимодействия со всеми типами MCR в структурах ЦНС, участвующих в ноцицептивных и антиноцицептивных механизмах. При этом обращают на себя внимание полученные в нашей работе данные об отсутствии противоболевых эффектов у АКТГ4-7-PGP, описанных ранее другими авторами [3]. Учитывая, что межлинейные и межпородные особенности могут оказывать значительное влияние на характер болевой реакции [14, 15], одной из причин указанных выше различий в полученных эффектах может служить использование в предыдущих исследованиях беспородных животных, тогда как настоящее исследование выполнено на крысах Вистар.
ВЫВОДЫ
В тесте «горячая пластина» введение АКТГ6-9-PGP в дозах 5 и 150 мкг/кг вызывало выраженное снижение температурной болевой чувствительности с участием супраспинальных механизмов через 15 и 45 мин после внутрибрюшного введения. В остальных использованных дозах эффекты отсутствовали. В тесте «отдергивание хвоста» в дозе 150 мкг/кг пептид повышал температурную болевую чувствительность с участием сегментарных спинальных механизмов. Влияния АКТГ4-7-PGP на исследованные механизмы болевой чувствительности установлено не было. Результаты проведенных исследований расширяют данные о физиологических эффектах N-концевых аналогов АКТГ и могут служить теоретическим обоснованием для создания на их основе фармакологических препаратов с нейротропным спектром действия.
- Catania A, Lonati C, Sordi A, Carlin A, Leonardi P, Gatti S. The melanocortin system in control of inflammation. Scientific World Journal. 2010; (10): 1840–53.
- Catania A. Neuroprotective actions of melanocortins: a therapeutic opportunity. Trends Neurosci. 2008. 31 (7): 353–60.
- Koroleva SV, Myasoedov NF. Semax as a Universal Drug for Therapy and Research. Biology Bulletin. 2018; 45 (6): 589–600.
- Clark AJ, Forfar R, Hussain M, Jerman J, McIver E, Taylor D, et al. ACTH Antagonists. Front Endocrinol (Lausanne). 2016; (7): 101.
- Андреева Л. А, Гривенников И. А., Гаврилова С. А., Долотов О. В., Каменский А. А., Кошелев В. Б., Левицкая Н. Г., Мясоедов Н. Ф., авторы. Учреждение Российской академии наук Институт молекулярной генетики РАН, патентообладатель. Пептид, обладающий нейротропными свойствами. Патент РФ № 2443711. 27.02.2012.
- Миронов А. Н., редактор. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: Гриф и К, 2012; 944 с.
- Ковалицкая А. Ю., Фунтикова А. Н., Садовников В. Б., Наволоцкая Е. В. Действие АКТГ-подобных пептидов на миграцию и расплавление перитонеальных макрофагов мыши in vitro. Российский иммунологический журнал. 2011; 5 (1): 3–10.
- Hill JW, Faulkner LD. The Role of the Melanocortin System in Metabolic Disease: New Developments and Advances. Neuroendocrinology. 2017; 104 (4): 330–46.
- Wikberg JE, Muceniece R, Mandrika I, Prusis P, Lindblom J, Post C, et al. New aspects on the melanocortins and their receptors. Pharmacol Res. 2000; 42 (5): 393–420.
- Fridmanis D, Roga A, Klovins J. ACTH Receptor (MC2R) Specificity: What Do We Know About Underlying Molecular Mechanisms? Front Endocrinol (Lausanne). 2017; (8): 13.
- Акмаев И. Г., Гриневич В. В. От нейроэндокринологии к нейроиммуноэндокринологии. Бюллетень экспериментальной биологии и медицины. 2001; 131 (1): 22–32.
- Ашмарин И. П., Каразеева Е. П., Лелекова Т. В. Эффективность ультрамалых доз эндогенных биорегуляторов и иммуноактивных соединений. Журнал микробиолологии. 2005; (3): 109–16.
- Левицкая Н. Г., Каменский А. А. Меланокортиновая система. Успехи физиол. наук. 2009; 40 (1): 44–65.
- Hestehave S, Abelson KSP, Pedersen TB, Munro G. The analgesic efficacy of morphine varies with rat strain and experimental pain model: implications for target validation efforts in pain drug discovery. Eur J Pain. 2019; 23 (3): 539–54. PubMed PMID: 30318662.
- Hestehave S, Abelson KSP, Pedersen TB, Munro G. Stress sensitivity and cutaneous sensory thresholds before and after neuropathic injury in various inbred and outbred rat strains. Behavioural Brain Research. 2019; (375): 112149.