ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Мутант фототоксичного белка KillerRed, не формирующий DsRed-подобного хромофора
Институт биоорганической химии имени М. М. Шемякина и Ю. А. Овчинникова, Москва, Россия
Генетически кодируемые фотосенсибилизаторы на основе флуоресцентных белков способны производить активные формы кислорода при облучении светом, и потому их широко используют в качестве оптогенетических инструментов. Разработанные на сегодняшний день фотосенсибилизаторы с зеленой флуоресценцией обладают неоптимальными свойствами. Целью настоящей работы был поиск новых вариантов флуоресцентных белков с эффективным созреванием хромофора и высокой фототоксичностью. С помощью случайного мутагенеза фототоксичного флуоресцентного белка KillerRed и направленной эволюции в E. coli получен белок с хромофором на основе тирозина, флуоресцирующий в зеленой области спектра. Новый белок, несущий мутации I64L, D114G и T115S, не формирует DsRed-подобного хромофора и может быть использован как базовый генотип для разработки новых спектрально отличных от KillerRed генетически кодируемых фотосенсибилизаторов.
Ключевые слова: фотосенсибилизатор, флуоресцентный белок, KillerRed, мутагенез, гипсохромный сдвиг, оптогенетика
Финансирование: работа не была бы опубликована без поддержки грантом РФФИ 18-04-01173 и грантом Президента РФ 075-15-2019-411. Исследования частично выполнены на оборудовании ЦКП ИБХ РАН.
Благодарности: авторы признательны Центру высокоточного редактирования и генетических технологий для биомедицины (Москва) за помощь в методах исследования.
Вклад авторов в работу: К. С. Саркисян, Д. А. Горбачев — планирование проекта, проведение экспериментов, анализ данных, подготовка рукописи статьи. Вклад авторов в работу равнозначен на всех этапах.
Для корреспонденции: Карен Сергеевич Саркисян
ул. Миклухо-Маклая, 16/10, оф. 34/632, г. Москва, 117997; moc.liamg@naysikras.s.nerak
Флуоресцентные белки широко используют как генетически кодируемые метки в технологиях оптического мечения живых систем [1]. Поскольку хромофор в таких белках находится внутри глобулы и защищен от окружающего растворителя, большинство существующих флуоресцентных белков являются пассивными репортерными молекулами — облучение их светом незначительно влияет на физиологию клетки.
В то же время на основе белка anm2CP было разработано уникальное семейство генетически кодируемых фотосенсибилизаторов — фототоксичных флуоресцентных белков, производящих при облучении активные формы кислорода, способные убить клетку [2].
В фототоксичных флуоресцентных белках обнаруживается заполненный молекулами воды канал, соединяющий находящийся в центре глобулы белка хромофор с молекулами растворителя и являющийся структурным механизмом, обеспечивающим эффективную генерацию активных форм кислорода этими белками [3, 4].
Созданный первым, генетически кодируемый фотосенсибилизатор — белок KillerRed — при освещении зеленым или оранжевым светом производит активные формы кислорода и демонстрирует на три порядка более высокий уровень фототоксичности, чем другие флуоресцентные белки [2]. В зависимости от клеточной локализации и дозы светового облучения активные формы кислорода, генерируемые KillerRed, могут приводить к различным физиологическим последствиям, от инактивации белка слияния [2] до остановки клеточного деления [5, 6] и гибели клеток через некроз или апоптоз [2, 7].
Благодаря этим свойствам KillerRed используют в качестве оптогенетического инструмента в клеточной биологии для инактивации белков светом, изучения внутриклеточного окислительного стресса, а также для уничтожения интересующих экспериментатора клеточных популяций. KillerRed был также использован в качестве фотосенсибилизатора для лечения опухолей в модельных системах [7–9].
На основе KillerRed были созданы другие генетически кодируемые фотосенсибилизаторы, генерирующие активные формы кислорода: SuperNova, спектрально близкий к KillerRed мономерный вариант белка [10], и спектрально отличные от них оранжевый флуоресцентный белок KillerOrange [11] и зеленый флуоресцентный белок SuperNova Green [12]. Кроме того, на основе неродственных флуоресцентным белкам флавопротеинов были разработаны фотосенсибилизаторы miniSOG и Pp2FbFP и другие, генерирующие синглетный кислород при облучении синим светом [13, 14].
К сожалению, ни один из созданных на сегодняшний день фотосенсибилизаторов с флуоресценцией в зеленой области спектра нельзя назвать универсальным для широкого круга задач из-за неполного или медленного созревания хромофора, различных типов генерируемых активных форм кислорода, или зависимости работы белка от доступности внешнего хромофора [15]. Целью настоящей работы было найти мутантный вариант KillerRed, который не формировал бы DsRed-подобный «красный» хромофор и мог служить основой для разработки нового поколения фотосенсибилизаторов с флуоресценцией в зеленой области спектра.
МАТЕРИАЛЫ И МЕТОДЫ
Амплификация ДНК и анализ продуктов амплификации
Амплификацию ДНК проводили с использованием набора Encyclo PCR Kit (Евроген; Россия) на приборе PTC-200 Thermal Cycler (MJ Research; США). Анализ продуктов амплификации проводили в 1–2%-м агарозном геле. В качестве красителя использовали бромистый этидий в концентрации 0,5 мкг/мл.
Создание библиотек случайных мутантов для направленной эволюции
При создании библиотеки мутантов белка KillerRed использовали протокол мутагенеза, основанный на методе ПЦР с ошибками. В реакционную смесь добавляли соли марганца и определенное соотношение нуклеотидтрифосфатов, что в среднем приводило к 8 нуклеотидным ошибкам на 1000 амплифицированных нуклеотидов за 25 циклов ПЦР.
Перед проведением электротрансформации с целью удаления солей реакцию лигирования очищали с использованием набора для очистки ДНК Сleanup Mini (Евроген; Россия). Продукты лигирования смывали с колонки с помощью 10 мкл mQ. Электрокомпетентные клетки в количестве 40 мкл размораживали при
0 °C и в размороженные клетки вносили 5 мкл реакции лигирования. Клетки переносили в предварительно охлажденную кювету для электропорации (BioRad; США) и производили электропорацию в приборе MicroPulser (BioRad; США). Сразу после этого в кювету добавляли 3 мл среды SOB, полученную бактериальную суспензию переносили в пластиковые пробирки объемом 1,5 мл и инкубировали 1 ч в термостате при температуре 37 °C. Бактериальную суспензию высевали на агар, приготовленный на основе среды LB, и инкубировали при температуре 37 °C в течение 18 ч. Средняя плотность колоний E. coli составляла 5000 на чашку Петри, общее разнообразие мутантов в библиотеке составило около 100 000 клонов. Количество флуоресцентных колоний — 22%.
Экспрессия и очистка рекомбинантных белков
E. coli штамма XL1 Blue выращивали в колбах объемом 800 мл, индуцировали изопропил-β-D-1- тиогалактопиранозидом до конечной концентрации 0,5 мМ и инкубировали при перемешивании в течение 3 ч. Далее все операции по выделению белка проводили на льду. Культуру клеток центрифугировали, супернатант сливали, осадок ресуспендировали в 4 мл фосфатного буфера (pH 7,4). Клетки разрушали ультразвуком, используя соникатор Sonics Vibra Cell (Sonics & Materials; США), и снова центрифугировали. Супернатант переносили в чистую пробирку и добавляли 400 мкл металл-аффинной смолы Talon (Clontech; США), уравновешенной фосфатным буфером. Пробирку помещали в шейкер на 1 ч 200 об./мин при комнатной температуре, после чего металл-аффинную смолу с белком несколько раз промывали фосфатным буфером. Затем элюировали белок раствором фосфатного буфера, содержащего 250 мМ имидазола.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для поиска мутантного варианта KillerRed с флуоресценцией в зеленой области спектра мы провели случайный мутагенез. Библиотека мутантов KillerRed была клонирована в бактериальный экспрессионный вектор под контроль промотора с высокой фоновой экспрессией, трансформирована в E. coli и выращена на чашках Петри без индукции. Мы визуально скринировали бактериальные колонии при облучении светом 400 нм и 480 нм для идентификации мутантов, обладающих значительной флуоресценцией в зеленой области спектра.
В результате скрининга был отобран мутант KillerRed I64L/D114G/T115S (см. таблица), который практически не обладал флуоресценцией в красной области спектра, зато обладал заметной зеленой флуоресценцией при облучении светом 480 нм (здесь и далее нумерация позиций в белке указана по традиционной нотации, согласно которой хромофор формируют аминокислоты в позициях 65–67 [1]). Подобные спектральные свойства свидетельствовали в пользу формирования «классического» GFP-подобного хромофора вместо DsRed-подобного хромофора, формируемого родительским KillerRed.
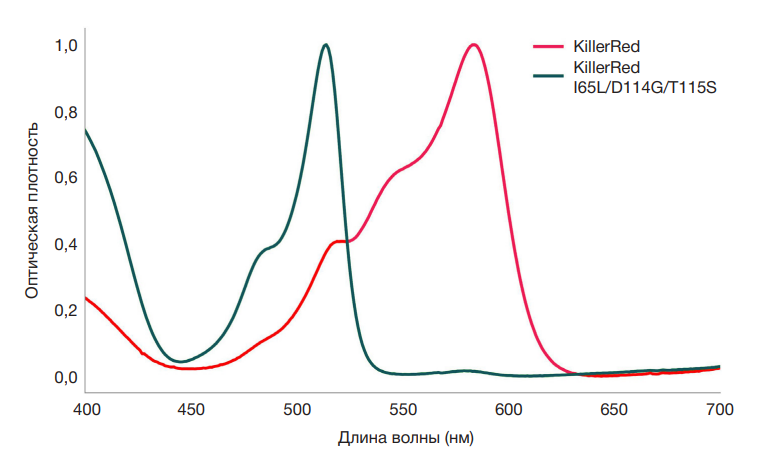
Поскольку белки с GFP- и DsRed-подобными хромофорами формируют легко отличимые друг от друга характерные спектры поглощения, мы получили препараты очищенного белка для мутантного белка KillerRed I64L/D114G/T115S и родительского KillerRed (рис. 1).
Спектр поглощения очищенного KillerRed I64L D114G T115S действительно существенно отличался от спектра поглощения KillerRed и демонстрировал пик с максимумом в зеленой области спектра (514 нм) и характерным для GFP-подобных хромофоров гипсохромно сдвинутым плечом.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Отсутствие пика в области 550–600 нм на спектре поглощения KillerRed I64L/D114G/T115S свидетельствует о том, что внесенные мутации почти полностью предотвращают формирование DsRed-подобного хромофора, образующегося в родительском белке. Формируемый вместо этого пик с максимумом в области 514 нм и характерным плечом в области 480–485 нм позволяет предполагать, что катализ хромофора останавливается на «классическом» GFP-подобном хромофоре [1].
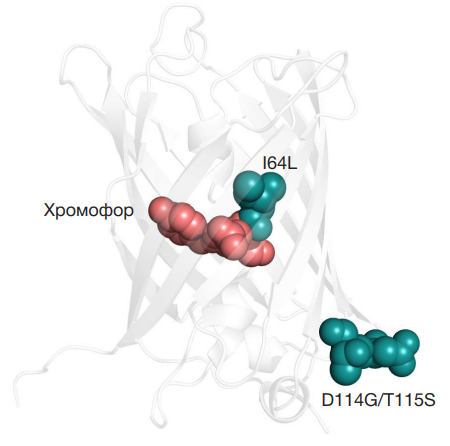
Представляются интересными мутации, обнаруженные в отобранном нами варианте KillerRed. Так, мутации в позиции 64 ранее уже были описаны как влияющие на созревание хромофора: например, в Aequorea victoria GFP мутация F64L улучшает созревание хромофора при экспрессии при 37 °C, а в хромобелке из Acropora millepora мутация S64C меняет цвет белка [16]. Мутации D114G и T115S находятся в соседних остатках на петле, соединяющей β-слои 5 и 6 (рис. 2), и, предположительно, могут участвовать в адаптации структуры β-бочонка белка к замене изолейцина на лейцин в позиции 64.
ВЫВОДЫ
Описанный в настоящей работе мутант KillerRed представляет собой перспективный вариант для дальнейшей направленной эволюции с целью создания нового поколения генетически кодируемых фотосенсибилизаторов с флуоресценцией в зеленой области спектра. В отличие от других разработанных на сегодняшний день спектральных вариантов KillerRed, мутант KillerRed I64L/D114G/T115S формирует хромофор на основе тирозина и обладает флуоресценцией в зеленой области спектра.
- Chudakov DM, Matz MV, Lukyanov S, Lukyanov KA. Fluorescent proteins and their applications in imaging living cells and tissues. Physiol Rev. 2010; (9)0: 1103–63. DOI:10.1152/ physrev.00038.2009/=.
- Bulina ME, Chudakov DM, Britanova OV, Yanushevich YG, Staroverov DB, Chepurnykh TV, et al. A genetically encoded photosensitizer. Nat Biotechnol. 2006; (24): 95–9. DOI:10.1038/ nbt1175.
- Pletneva NV, Pletnev VZ, Sarkisyan KS, Gorbachev DA, Egorov ES, Mishin AS, et al. Crystal Structure of Phototoxic Orange Fluorescent Proteins with a Tryptophan-Based Chromophore. PLoS One. 2015; (10): e0145740. DOI:10.1371/journal.pone.0145740.
- Pletnev S, Gurskaya NG, Pletneva NV, Lukyanov KA, Chudakov DM, Martynov VI, et al. Structural basis for phototoxicity of the genetically encoded photosensitizer KillerRed. J Biol Chem. 2009; (284): 32028–39. DOI:10.1074/jbc.M109.054973.
- Serebrovskaya EO, Gorodnicheva TV, Ermakova GV, Solovieva EA, Sharonov GV, Zagaynova EV, et al. Light-induced blockage of cell division with a chromatin-targeted phototoxic fluorescent protein. Biochem J. 2011; (435): 65–71. DOI:10.1042/BJ20101217.
- Lan L, Nakajima S, Wei L, Sun L, Hsieh C-L, Sobol RW, et al. Novel method for site-specific induction of oxidative DNA damage reveals differences in recruitment of repair proteins to heterochromatin and euchromatin. Nucleic Acids Res. 2014; (42): 2330–45. DOI:10.1093/nar/gkt1233.
- Shirmanova MV, Serebrovskaya EO, Lukyanov KA, Snopova LB, Sirotkina MA, Prodanetz NN, et al. Phototoxic effects of fluorescent protein KillerRed on tumor cells in mice. J Biophotonics. 2013; (6): 283–90. DOI:10.1002/jbio.201200056.
- Kuznetsova DS, Shirmanova MV, Dudenkova VV, Subochev PV, Turchin IV, Zagaynova EV, et al. Photobleaching and phototoxicity of KillerRed in tumor spheroids induced by continuous wave and pulsed laser illumination. J Biophotonics. 2015; 9999. DOI:10.1002/jbio.201400130.
- Yan L, Kanada M, Zhang J, Okazaki S, Terakawa S. Photodynamic Treatment of Tumor with Bacteria Expressing KillerRed. PLoS One. 2015; (10): e0131518. DOI:10.1371/journal.pone.0131518.
- Takemoto K, Matsuda T, Sakai N, Fu D, Noda M, Uchiyama S, et al. SuperNova, a monomeric photosensitizing fluorescent protein for chromophore-assisted light inactivation. Sci Rep. 2013; (3): 2629. DOI:10.1038/srep02629.
- Sarkisyan KS, Zlobovskaya OA, Gorbachev DA, Bozhanova NG, Sharonov GV, Staroverov DB, et al. KillerOrange, a Genetically Encoded Photosensitizer Activated by Blue and Green Light. PLoS One. 2015; (10): e0145287. DOI:10.1371/journal.pone.0145287.
- Riani YD, Matsuda T, Takemoto K, Nagai T. Green monomeric photosensitizing fluorescent protein for photo-inducible protein inactivation and cell ablation. BMC Biol. 2018; (16): 50. DOI:10.1186/s12915-018-0514-7.
- Shu X, Lev-Ram V, Deerinck TJ, Qi Y, Ramko EB, Davidson MW, et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms. PLoS Biol. 2011; (9): e1001041. DOI:10.1371/journal.pbio.1001041.
- Torra J, Burgos-Caminal A, Endres S, Wingen M, Drepper T, Gensch T, et al. Singlet oxygen photosensitisation by the fluorescent protein Pp2FbFP L30M, a novel derivative of Pseudomonas putida flavin-binding Pp2FbFP. Photochem Photobiol Sci. 2015; (14): 280–7. DOI:10.1039/c4pp00338a.
- Acharya A, Bogdanov AM, Grigorenko BL, Bravaya KB, Nemukhin AV, Lukyanov KA, et al. Photoinduced Chemistry in Fluorescent Proteins: Curse or Blessing? Chem Rev. 2017; (117): 758–95. DOI:10.1021/acs.chemrev.6b00238.
- Alieva NO, Konzen KA, Field SF, Meleshkevitch EA, Hunt ME, Beltran-Ramirez V, et al. Diversity and evolution of coral fluorescent proteins. PLoS One. 2008; (3): e2680. DOI:10.1371/journal. pone.0002680.