ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Синтез нового амидного производного вальпроевой кислоты и 1,3,4-тиадиазола с противоэпилептической активностью
1 Тверской государственный медицинский университет, Тверь, Россия
2 Всесоюзный научный центр по безопасности биологически активных веществ, Старая Купавна, Московская область, Россия
Вальпроаты являются основными препаратами для лечения эпилепсии различных форм. Среди проблем, возникающих при их клиническом использовании, — фармакорезистентность, нежелательные побочные реакции, а также проявления острой и хронической интоксикации. Путем модификации химической структуры вальпроевой кислоты возможно создание более эффективных и безопасных антиконвульсантов. Перспективно получение тиадиазолиламидных производных вальпроатов, так как 1,3,4-тиадиазол может повышать биодоступность и снижать токсичность лекарственных средств. Целью работы был синтез нового амидного производного вальпроевой кислоты и 1,3,4-тиадиазола с противоэпилептической активностью. Химическую структуру синтезированного вальпроата исследовали методами ИК-спектроскопии, 1Н-ЯМР, 13С-ЯМР-спектроскопии, масс-спектроскопии и элементного анализа. Чистоту и индивидуальность подтверждали методами тонкослойной и высокоэффективной жидкостной хроматографий. Противоэпилептическую активность оценивали в тесте антагонизма с изониазидом (250 мг/кг, интраперитонеально) у мышей методом пробит-анализа. В результате исследования был получен N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамид (вальпразоламид). ESI+-масс-спектр N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамида — m/z 256,1 [M + H]+, MRM-переходы — m/z 256,1 — m/z 81,0 и m/z 130,1. Синтезированный вальпроат оказывал противоэпилептическое действие при изониазид-индуцированных судорогах у мышей. Значение ED50 (интраперитонеально, мыши) в тесте антагонизма с изониазидом составило 126,8 мг/кг (95% ДИ: 65,5–245,4). Терапевтический индекс был равен 7,3.
Ключевые слова: противоэпилептические средства, вальпроевая кислота, 1-3-4-тиадиазол
Соблюдение этических стандартов: исследование одобрено этическим комитетом Тверского государственного медицинского университета (протокол № 4 от 26 марта 2018 г.). Подопытных животных содержали согласно правилам лабораторной практики при проведении доклинических исследований в РФ (Приказ МЗ РФ № 199н от 01.04.2016 «Правила надлежащей лабораторной практики»). Все эксперименты осуществляли в соответствии с методическими рекомендациями по проведению доклинических исследований лекарственных средств с соблюдением «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Directive 2010/63/EU).
Вклад авторов в работу: А. С. Малыгин — экспериментальное исследование, анализ результатов, обзор публикаций по теме статьи, написание текста; М. А. Демидова — концепция и дизайн исследования, написание и редактирование текста; С. Я. Скачилова, Е. В. Шилова — синтез и анализ соединения; все авторы участвовали в обсуждении результатов.
Для корреспонденции: Александр Сергеевич Малыгин
ул. Советская, д. 4, г. Тверь, 170100;
ur.xednay@m.s.a.rd
Эпилепсией страдает более 75 млн людей по всему миру, и их число постоянно растет [1–2]. Ключевая проблема современной эпилептологии — фармакорезистентность, низкий процент больных эпилепсией (14,9%), достигающих стойкой ремиссии. У 48,1% происходят повторные приступы с частотой до 12 раз в год [3–4]. Половина больных эпилепсией получают несколько антиконвульсантов одновременно. Часть пациентов страдают от нерациональной замены препаратов, необоснованной политерапии, ухудшающей качество жизни, повышающей вероятность возникновения нежелательных лекарственных реакций. Остро стоит проблема приверженности лечению: 18,05% больных эпилепсией в России не получают лекарственной терапии [5]. Оптимизация фармакотерапии эпилепсии — важнейшая задача эпилептологии.
Среди многочисленных антиконвульсантов особое положение занимает вальпроевая кислота, которую синтезировал в 1882 г. Беверли С. Бертон и первоначально использовали в качестве растворителя. Противосудорожные свойства вальпроевой (2-пропилпентановой) кислоты случайно открыли в 1963 г. и с тех пор широко используют в клинической практике [6]. Вальпроаты являются противоэпилептическими средствами широкого спектра действия, в связи с чем их относят к препаратам первого выбора при эпилепсии различных форм. Долгосрочные исследования показали эффективность вальпроатов при всех формах генерализованных эпилепсий [7–9]. Существенная проблема в использовании вальпроатов — нежелательные побочные реакции, а также проявления острой и хронической интоксикации [10–12]. Из- за высокой тератогенности они не рекомендованы женщинам детородного возраста [13]. За счет химической модификации вальпроевой кислоты возможно получение более эффективных и безопасных препаратов с антиконвульсивной активностью [14].
Целью исследования было получить новый антиконвульсант из группы тиадиазолиламидных дериватов вальпроевой кислоты.
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты и препараты
2-Амино-5-этил-1,3,4-тиадиазол (Acros Organics; Бельгия), 2-пропилпентановая кислота (Sigma Aldrich; США), пиридин («ЛенРеактив»; Россия), изониазид («Мосхимфармпрепараты им. Н. А. Семашко»; Россия), хлористоводородная кислота («ЛенРеактив»; Россия), пропанол-2 («ЛенРеактив»; Россия), ацетонитрил (LC-MS; Scharlau, Испания), ацетат аммония (Panreac AppliChem ITW reagents, США), этанол («Медхимпром»; Россия), вода деионизированная Milli-Q.
Оборудование
Масс-селективный квадрупольный детектор AB Sciex QTrap 3200 MD (Sciex; Сингапур), высокоэффективный жидкостный хроматограф Agilent 1260 Infinity II (Agilent Technologies; Германия), пластины для тонкослойной хроматографии (силикагель 60 F 254) (Merck; Германия), спектрометр Bruker Avance-400 (Bruker; Германия), ИК- спектрометр Agilent Cary 630 FTIR (Agilent; Германия), анализатор для элементного анализа EA 1108 (Carlo Erba Instruments; Италия), аналитические весы Acculab ALC- 80d4 (Acculab; США), центрифуга с охлаждением ротора Eppendorf 5810R (Eppendorf; Германия), система получения особо чистой воды Миллипор DirectQ UV (Millipore SAS; Франция), вортекс-встряхиватель Elmi V-3 (Elmi; Латвия), шейкер Elmi S-3 (Elmi; Латвия), термостат твердотельный «Термит» («ДНК-Технология»; Россия), автоматические дозаторы Eppendorf (Eppendorf; Германия) и Black Thermo («Термо Фишер Сайентифик»; Россия).
Методы идентификации
Химическую структуру синтезированного вальпроата (N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамида) исследовали методами ИК-спектроскопии, 1Н-ЯМР, 13С-ЯМР-спектроскопии, масс-спектроскопии и элементного анализа. Чистоту и индивидуальность подтверждали методами тонкослойной и высокоэффективной жидкостной хроматографии.
Экспериментальная оценка противоэпилептической активности
Противоэпилептическую активность синтезированного вальпроата оценивали в тесте антагонизма с изониазидом. Генерализованные клонико-тонические судороги индуцировали у мышей интраперитонеальным введением изониазида (ИЗН) в дозе 250 мг/кг [15]. Использовали аутбредных мышей-самцов SNK массой 19–21 г (n = 40). Животных содержали в условиях вивария Тверского ГМУ при постоянной температуре (22 ± 2 °C) и искусственном 12-часовом режиме дня и ночи (светлое время 08:00– 20:00) со свободным доступом к воде и пище. Мыши были рандомизированы на пять групп: контрольную (изониазид-индуцированные судороги) и опытные группы (интраперитонеальное введение тестируемого препарата в дозах 75, 150, 300 и 450 мг/кг за 40 мин до изониазида). Видеонаблюдение за подопытными животными осуществляли в течение 3 ч, регистрируя латентный период первого судорожного приступа, появление клонических и тонических судорог, исходы (выживание или гибель). Рассчитывали значения ED50 (средней терапевтической дозы, обеспечивающей выживание 50% животных в тесте) и терапевтического индекса (TI = DL50/ЕD50 — отношение среднесмертельной дозы к средней терапевтической).
Статистические методы исследования
Статистический анализ проводили с использованием программы «BioStat, 2009» (AnalystSoft; США). Для обработки результатов исследования применяли методы описательной статистики. После проверки гипотезы о нормальном распределении данных с помощью W-критерия Шапиро–Уилка проводили однофакторный дисперсионный анализ (ANOVA) с апостериорным сравнением (post-hoc тест множественного сравнения) с помощью критерия Тьюки HSD. Для статистического анализа относительных показателей использовали точный критерий Фишера. Данные представляли в виде m ± SEM. Значение ED50 рассчитывали путем пробит-анализа методом Финни.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Схема синтеза
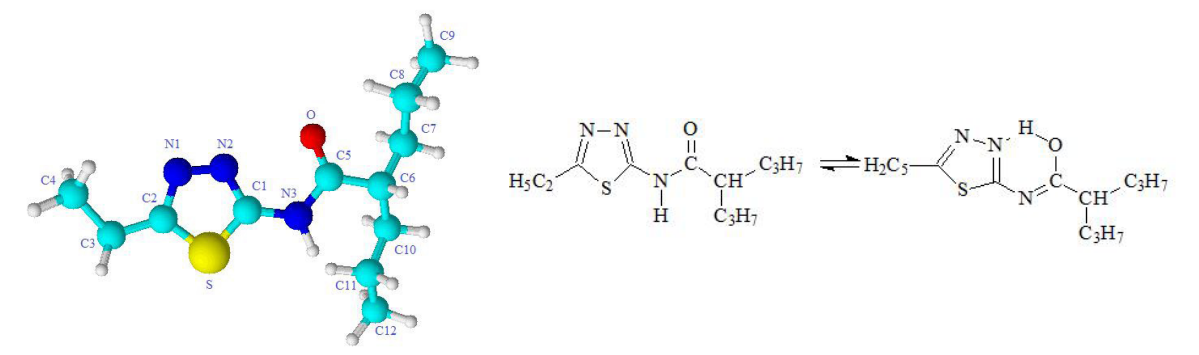
Синтезированный тиадиазолиламидный дериват вальпроевой кислоты — N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамид (брутто формула С12H21N3OS) с лабораторным наименованием вальпразоламид (ВПЗ) представлен на рис. 1.
Синтез нового антиконвульсанта состоял из следующих этапов: галогенирование 2-пропилпентановой кислоты хлорангидридом сернистой кислоты; стехиометрическое взаимодействие полученного хлорангидрида 2-пропилпентановой кислоты с 2-амино-5-этил-1,3,4-тиадиазолом; получение кристаллического осадка при подкислении реакционной массы HCl до рН = 1–2 при температуре 5 °С (рис. 2).
После синтеза осуществляли очистку полученного продукта. Поэтапная очистка включала: удаление водорастворимых примесей путем промывания охлажденной водой с повторной фильтрацией и перекристаллизацию с пропанолом-2 после предварительного высушивания в вакууме при 10 мм рт. ст. до постоянной массы (выход 67%). Эффективность очистки контролировали хроматографическими методами (ТСХ и ВЭЖХ).
Описание и идентификация N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамида
Полученная активная фармацевтическая субстанция — белый с желтоватым оттенком кристаллический порошок, молярная масса 255,14 г/моль, температура плавления 93–94 °С. Практически не растворим в воде, растворим в спирте, в ацетонитриле и других органических растворителях.
Химическую структуру N-(5-этил-1,3,4-тиадиазол-2- ил)-2-пропилпентанамида (С12H21N3OS) подтверждали методом элементного анализа и с помощью спектральных характеристик. Расчетным путем для С12H21N3OS было определено содержание элементов: C — 56,44%; H — 8,29%; N — 16,45%; O — 6,26%; S — 12,56%. Элементный анализ показал содержание C — 56,39%; H — 8,34%; N — 16,41%; O — 6,26%; S — 12,60%, что соответствовало химической структуре синтезированного соединения.
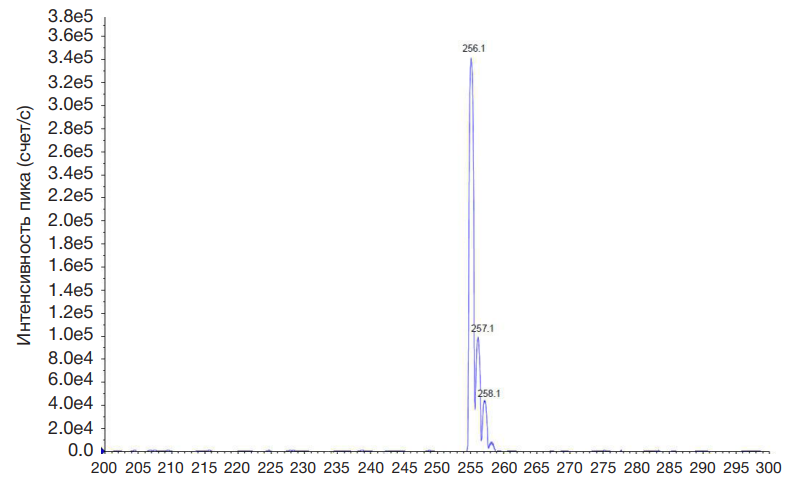
Результаты спектроскопии: ИК-спектры (при таблетировании с KBr), ν/см–1: 3302, 3030 (NH), 2981, 2959, 2860 (СН), 1545 (NHCO); 1H-ЯМР (400 MГц, DMSO-d6) δ ppm: 0,97 (s, 3H, CH3), 1,33 (s, 2H, CH2), 1,41–1,50 (m, 4H), 2,65 (s, 2H, CH2), 10,63 (s, 1H, NH); 13C-ЯМР (400 MГц, DMSO-d6) δ ppm: 13,48, 13,66, 20,06, 24,70, 35,27, 43,22, 155,85, 156,5, 175,00; ESI+-масс-спектр — m/z 256,1 ([M + H]+), значения MRM-переходов — m/z 256,1 → m/z 81,1 и m/z 130,1. ESI+-масс-спектр N-(5-этил-1,3,4-тиадиазол-2-ил)- 2-пропилпентанамида представлен на рис. 3.
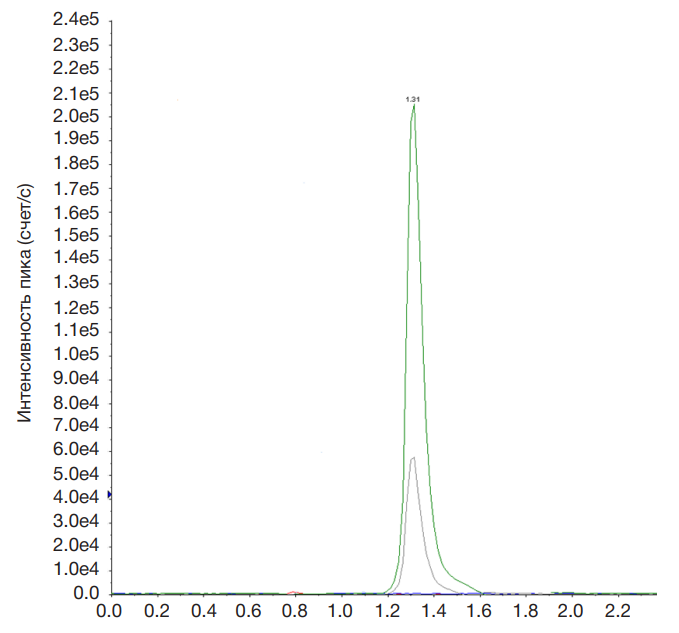
Индивидуальность синтезированного антиконвульсанта оценивали с помощью ВЭЖХ. Хроматографию проводили с использованием колонки Phenomenex synergi Fusion 4 мкм-C18 2 × 50 мм, при температуре 50 °С. Элюирование осуществляли метанолом с водой деионизированной в соотношении 90 : 10 и с добавлением 0,1%-го аммония ацетата. Время удерживания составило 1,31 мин (рис. 4).
Оценка противоэпилептической активности на модели изониазид-индуцированных судорог у мышей
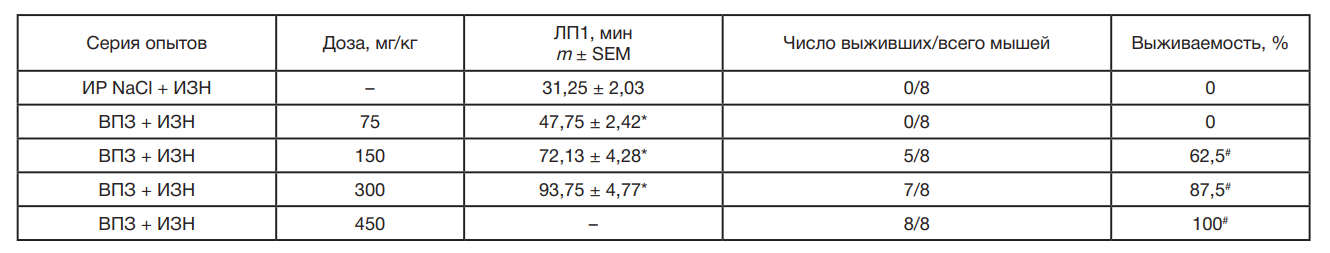
При интраперитонеальном введении изониазида (250 мг/кг) генерализованные клонико-тонические судороги со смертельным исходом развивались у всех подопытных мышей группы контроля. Предварительное введение ВПЗ за 40 мин до изониазида оказывало дозозависимое влияние на течение изониазид-индуцированных судорог у мышей (р < 0,0001; однофакторный дисперсионный анализ ANOVA). ВПЗ в дозе 75 мг/кг статистически значимо увеличивал продолжительность латентного периода первого судорожного приступа в среднем в 1,5 раза (р < 0,05) по сравнению с контролем, однако не предупреждал развития судорог и гибели подопытных животных. При использовании ВПЗ в дозах 150 мг/кг и 300 мг/кг наряду с увеличением латентного периода первого судорожного приступа отмечено уменьшение числа смертельных исходов. В серии опытов с использованием ВПЗ в дозе 450 мг/кг развития судорожного синдрома в течение 3 ч после введения изониазида зарегистрировано не было (см. таблица.).
По результатам пробит-анализа значение ED50 при интраперитонеальном введении ВПЗ в тесте антагонизма с изониазидом составило 126,8 мг/кг (95% ДИ: 65,5–245,4). Терапевтический индекс был равен 7,3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Основные критерии для поиска новых антиконвульсантов — эффективность при фармакорезистентной эпилепсии, меньшее количество побочных эффектов, лучшая переносимость, а также способность замедлять прогрессирование и модифицировать течение эпилепсии; дополнительные преимущества — линейность фармакокинетики, легкость титрации при клиническом использовании, наличие дополнительных терапевтических эффектов, в том числе обезболивающего при невропатической боли. Поиск таких препаратов осуществляют как среди новых молекул, так и путем создания новых производных известных антиконвульсантов.
В литературе показана возможность создания новой генерации вальпроатов [16]. Отмечено, что тератогенность амидных аналогов существенно ниже, чем у самой вальпроевой кислоты [17]. Среди амидов вальпроевой кислоты выявлены эффективные противоэпилептические [18], антиневропатические [19–20], противовирусные [21–22] и другие средства. Антиконвульсивная активность обнаружена также у ряда производных 1,3,4-тиадиазола, в том числе содержащих остаток вальпроевой кислоты [23]. Большинство тиадиазоловых производных отличалось от аналогов более высокой биодоступностью и меньшей токсичностью. Подобная закономерность отмечена и в отношении синтезированного вальпроата, содержащего в своей структуре 1,3,4-тиадиазолил. Показано, что значение полулетальной дозы 1,3,4-тиазиазолиламидного деривата вальпроевой кислоты (внутрибрюшинно, мыши) в среднем в 1,8 раза больше, чем у вальпроевой кислоты [24]. Наличие противоэпилептического эффекта у синтезированного вальпроата подтверждено на моделях максимального электрошока и пентилентетразоловых судорог у мышей [25–26]. Учитывая, что наибольшую активность ВПЗ проявил в тесте с антагонистом ГАМКА-рецепторов пентилентетразолом, в настоящем исследовании оценивали его влияние на судороги, индуцированные другим антагонистом ГАМК — гидразидом изоникотиновой кислоты изониазидом. Проконвульсивный эффект изониазида связан с угнетением синтеза ГАМК за счет антагонизма с пиридоксальфосфатом, являющимся коферментом глутаматдекарбоксилазы, которая катализирует превращение глутамата в ГАМК. Судорожный синдром, нередко описываемый как эпилептический статус, представляет собой серьезное осложнение при лечении туберкулеза гидразидами изоникотиновой кислоты. Изониазид-индуцированные судороги плохо поддаются лечению обычными антиконвульсантами и не всегда могут быть предупреждены пиридоксином [27–28]. Известно, что вальпроаты могут дозозависимо угнетать развитие судорог, вызванных изониазидом [29]. В настоящем исследовании показано, что предварительное введение N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамида увеличивало латентный период судорог и уменьшало гибель мышей в тесте антагонизма с изониазидом. На основании этих сведений N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамид можно отнести к потенциальным противоэпилептическим средствам с улучшенным профилем безопасности.
ВЫВОДЫ
Результаты исследования подтверждают перспективность поиска новых антиконвульсантов путем модификации вальпроевой кислоты за счет введения в ее химическую структуру 1,3,4-тиадиазола. Преимущество синтезированного N-(5-этил-1,3,4-тиадиазол-2-ил)- 2-пропилпентанамида в способности предупреждать развитие изониазид-индуцированных судорог, недостаток — нерастворимость в воде, что затрудняет получение инъекционных лекарственных форм. В дальнейшем для улучшения его биофармацевтических свойств предполагается получение нанокапсулированной формы с β-циклодекстрином. Методики идентификации N-(5-этил-1,3,4-тиадиазол-2-ил)-2-пропилпентанамида могут быть использованы для определения его подлинности и проведения фармакокинетических исследований.

- Singh A, Trevick S. The epidemiology of global epilepsy. Neurol Clin. 2016 Nov; 34 (4): 837–47. PubMed PMID: 27719996.
- Авакян Г. Н. Вопросы современной эпилептологии. Эпилепсия и пароксизмальные состояния. 2015; (4): 16–21.
- Авакян Г. Н., Белоусова Е. Д., Бурд С. Г., Власов П. Н., Ермоленко Н. А., Киссин М. Я. и др. Проблемы эпилептологии. Ключевые приоритеты, задачи, вызовы и способы их решения. Эпилепсия и пароксизмальные состояния. 2019; 11 (4): 395–406.
- Kalilani L, Sun X, Pelgrims B, Noack-Rink V, Villanueva V. The epidemiology of drug-resistant epilepsy: A systematic review and meta-analysis. Epilepsia. 2018; 59 (12): 2179–93. PubMed PMID: 30426482.
- Авакян Г. Н., Власов П. Н., Жидкова И. А., Карлов В. А., Лебедева А. В., Михаловска- Карлова Е. П. и др. Заключение Совета экспертов по применению вальпроатов у пациенток с эпилепсией. Неврология, нейропсихиатрия, психосоматика. Эпилепсия. 2015; (1): 63–64.
- Tomson T, Battino D, Perucca E. The remarkable story of valproic acid. Lancet Neurol. 2016 Feb; 15 (2): 141. PubMed PMID: 28463122.
- Воронкова К. В., Никитин А. Э., Рудакова И. Г., Власов П. Н., Бурд С. Г., Лебедева А. В. и др. Современный выбор антиэпилептической терапии: этапы и рекомендации. Эпилепсия и пароксизмальные состояния. 2018; 10 (2): 74–81.
- Мухин К. Ю., Петрухин А. С., Миронов М. Б. Вальпроат натрия (Депакин) в достижении ремиссии у больных идиопатической генерализованной эпилепсией (долгосрочный катамнез). Неврологический журнал. 2004; (4): 34–39.
- Perucca E. Pharmacological and therapeuti properties of valproate: a summary after 35 years of clinical experience. CNS Drugs. 2012; 16 (10): 695–714.
- Бадалян О. Л., Бурд С. Г., Савенков А. А., Авакян Г. Г., Юцкова Е. В., Авакян Г. Н. Сравнительная оценка эффективности и безопасности производных вальпроевой кислоты: опыт применения. Эпилепсия и пароксизмальные состояния. 2014; 6 (2): 39–44.
- Шнайдер Н. А., Дмитренко Д. В. Хроническая интоксикация вальпроевой кислотой в эпилептологии: диагностика и лечение. Неврология, нейропсихиатрия, психосоматика. 2016; 8 (2): 94–99.
- Sztajnkrycer MD. Valproic acid toxicity: overview and management. J Toxicol Clin Toxicol. 2002; 40 (6): 789–801. PubMed PMID:12475192.
- Tomson T, Battino D, Perucca E. Valproic acid after five decades of use in epilepsy: time to reconsider the indications of a time-honoured drug. Lancet Neurol. 2016 Feb; 15 (2): 210–8. PubMed PMID: 26655849.
- Pessah N, Yagen B, Hen N, Shimshoni JA, Wlodarczyk B, Finnell RH, Bialer M. Design and pharmacological activity of glycinamide and N-methoxy amide derivatives of analogs and constitutional isomers of valproic acid. Epilepsy Behav. 2011 Nov; 22 (3): 461–8. PubMed PMID:21959082.
- Sun XY, Wei CX, Deng XQ, Sun ZG, Quan ZS. Evaluation of the anticonvulsant activity of 6-(4-chlorophenyoxy)-tetrazolo[5,1-a] phthalazine in various experimental seizure models in mice. Pharmacological Reports: PR, 01 Mar 2010, 62 (2): 273–7. PubMed PMID: 20508282.
- Trojnar MK, Wierzchowska-Cioch E, Krzyzanowski M, Jargiełło M, Czuczwar SJ. New generation of valproic acid. Pol J Pharmacol. 2004 May–Jun; 56 (3): 283–8. PubMed PMID: 15215557.
- Lin YL, Bialer M, Cabrera RM, Finnell RH, Wlodarczyk BJ. Teratogenicity of valproic acid and its constitutional isomer, amide derivative valnoctamide in mice. Birth Defects Res. 2019 Aug 15; 111 (14): 1013–23. PubMed PMID: 30325584.
- Haines KM, Matson LM, Dunn EN1, Ardinger CE, Lee-Stubbs R, Bibi D, McDonough JH, Bialer M Comparative efficacy of valnoctamide and sec-butylpropylacetamide (SPD) in terminating nerve agent-induced seizures in pediatric rats. Epilepsia. 2019 Feb; 60 (2): 315–21. PMID: 30615805.
- Kaufmann D, Bialer M, Shimshoni JA, Devor M, Yagen B. Synthesis and evaluation of antiallodynic and anticonvulsant activity of novel amide and urea derivatives of valproic acid analogues. J Med Chem. 2009 Nov 26; 52 (22): 7236–48. PubMed PMID 19877649.
- Samur DN, Arslan R, Aydın S, Bektas N. Valnoctamide: The effect on relieving of neuropathic pain and possible mechanisms. Eur J Pharmacol. 2018 May 15; (827): 208–14. PubMed PMID: 29522726.
- Praena B, Bello-Morales R, de Castro F, López-Guerrero JA. Amidic derivatives of valproic acid, valpromide and valnoctamide, inhibit HSV-1 infection in oligodendrocytes. Antiviral Res. 2019 Aug; (168): 91–99. PubMed PMID: 31132386.
- Ornaghi S, Hsieh LS, Bordey A, Vergani P, Paidas MJ, van den Pol AN. Valnoctamide Inhibits Cytomegalovirus Infection in Developing Brain and Attenuates Neurobehavioral Dysfunctions and Brain Abnormalities. J Neurosci. 2017 Jul 19; 37 (29): 6877–93. PubMed PMID: 28630251.
- Jain AK, Sharma S, Vaidya A, Ravichandran V, Agrawal RK. 1,3,4-Thiadiazole and its Derivatives: A Review on Recent Progress in Biological Activities. Chem Biol Drug Des. 2013; (81): 557–76. PubMed PMID: 23452185.
- Малыгин А. С. Оценка острой токсичности и нейротоксичности нового амидного производного вальпроевой кислоты и 1,3,4-тиадиазола. Медицина. 2019; (3): 37–46.
- Малыгин А. С. Исследование противоэпилептической активности нового амидного производного вальпроевой кислоты и 1,3,4-тиадиазола. Эпилепсия и пароксизмальные состояния. 2019; 11 (4): 357–63.
- Скачилова С. Я., Малыгин А. С., Попов Н. С., Демидова М. А., авторы; Владелец патента: «Всесоюзный научный центр по безопасности биологически активных веществ». N-(5-этил- 1,3,4-тиадиазол-2-ил)-2-пропилпентанамид, обладающий противоэпилептической и обезболивающей активностями. Патент РФ № 2 672 887. 13.03. 2018.
- Asehinde S, Ajayi A, Bakre A, Omorogbe O, Adebesin A, Umukoro S. Effects of Jobelyn® on Isoniazid-Induced Seizures, Biomarkers of Oxidative Stress and Glutamate Decarboxylase Activity in Mice Basic Clin Neurosci. 2018 Nov–Dec; 9 (6): 389–96. PMID: 30719253.
- Minns AB, Ghafouri N, Clark RF. Isoniazid-induced status epilepticus in a pediatric patient after inadequate pyridoxine therapy. Pediatr Emerg Care. 2010 May; 26 (5): 380–1. PubMed PMID: 20453796.
- Bernasconi R, Klein M, Martin P, Portet C, Maître L, Jones RS et al. The specific protective effect of diazepam and valproate against isoniazid-induced seizures is not correlated with increased GABA levels. J Neural Transm.1985; 63 (2): 169–89. PubMed PMID: 3930661.