ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Иммуногистохимическая экспрессия белка Nanog в клетках рака предстательной железы различных прогностических групп
1 Российский университет дружбы народов, Москва, Россия
2 Научно-исследовательский институт морфологии человека, Москва, Россия
3 Госпиталь для ветеранов войн № 2, Москва, Россия
Рак предстательной железы — наиболее часто выявляемое онкологическое заболевание среди мужчин, этому во многом способствуют распространение скрининговых исследований и высокая частота биопсий органа. Верификация опухолей с потенциально более неблагоприятным прогнозом течения является первостепенной задачей при лечении рака предстательной железы. Целью исследования было определить клинико-морфологические ассоциации и прогностическую значимость экспрессии белка Nanog при раке предстательной железы в различных прогностических группах. Работа выполнена на материале ткани предстательной железы, полученном после оперативного вмешательства, а также образцах ткани биопсии (всего 89 случаев). Было проведено гистологическое и иммуногистохимическое исследование с использованием антител к белкам Ki-67 и Nanog. Корреляционные связи между выраженностью экспрессии указанных маркеров и прогностической группой определяли с помощью коэффициента Спирмена, а связь с клинико-морфологическими проявлениями — с использованием критерия хи-квадрат (χ2). Обнаружена статистически значимая прямая корреляционная связь между выраженностью экспрессии Ki-67 и Nanog и порядковым номером прогностической группы (rs = 0,619, p < 0,001 и rs = 0,786, p < 0,001 соответственно). Удалось обнаружить связь между высокой степенью экспрессии Nanog и экстрапростатическим распространением опухоли (p = 0,041). Повышенная экспрессия белка Nanog в клетках рака предстательной железы связана с более злокачественными формами аденокарциномы и свидетельствует о неблагоприятном прогнозе.
Ключевые слова: рак предстательной железы, аденокарцинома простаты, Ki-67, Nanog, индекс Глисона, прогностические группы
Соблюдение этических стандартов: исследование было одобрено Комитетом по этике Медицинского института РУДН (протокол № 13 от 19 декабря 2019 г.), дизайн исследования соответствовал правилам Хельсинкской декларации об использовании тканей человека. От всех пациентов было получено письменное информированное согласие.
Вклад авторов: Г. Ю. Кудрявцев, Я. Ю. Кудрявцева, Н. А. Соловьева — обзор литературы, написание текста; Л. В. Кудрявцева, В. А. Осипов — статистическая обработка данных; Л. М. Михалева — сбор и обработка материалов; И. И. Бабиченко — концепция и дизайн исследования.
Для корреспонденции: Георгий Юрьевич Кудрявцев
ул. Байкальская, д. 35, кв. 216, г. Москва, 107207; ur.liam@ahsogk
По данным статистики, в 2018 г. в России было выявлено 42 518 новых случаев заболеваемости раком предстательной железы (РПЖ), среди мужского населения более значимую цифру продемонстрировали только злокачественные новообразования трахеи, бронхов и легочной ткани [1].
РПЖ является одной из самых частых опухолей, встречающихся у мужчин во всем мире, его частота в развитых странах превышает 200 случаев на 100 000 мужчин. Хотя клиническое течение опухоли варьирует от медленно растущих локальных форм до высоко агрессивных наблюдений с быстрым метастазированием, РПЖ является одной из основных причин заболеваемости и смертности среди мужчин [2, 3].
Один из наиболее высоких показателей заболеваемости РПЖ зарегистрирован в США. У одного из шести американских мужчин в течение жизни развивается рак предстательной железы, в то же время среди таких пациентов только один умирает непосредственно от РПЖ или его осложнений, в остальных случаях опухоль, как правило, клинически не проявляется [4]. Эти данные подтверждают результаты вскрытия, в которых рак простаты посмертно диагностирован у одной трети пациентов в возрасте 50–60 лет и в 60% наблюдений умерших в возрасте старше 80 лет [5].
До момента внедрения в широкую практику исследования концентрации простатспецифического антигена (ПСА) РПЖ часто диагностировали после того, как у пациентов проявлялись симптомы местно- распространенного или метастатического процесса, а общая пятилетняя выживаемость составляла 70% [6]. Распространение скрининга ПСА привело к резкому увеличению выявления рака простаты, включающему, главным образом, локализованный рак. Тем не менее данный метод не обладает высокой специфичностью и зачастую способствует увеличению числа инвазивных процедур при лечении клинически незначимых видов рака [7]. Этим обусловлена необходимость дальнейшего поиска биологических маркеров для уточнения модели прогрессирования различных форм РПЖ с целью выбора наиболее адекватной лечебной тактики.
Одним из перспективных направлений решения данной проблемы является углубленное изучение основных механизмов гистогенеза наиболее частой формы РПЖ — аденокарциномы.
На современном этапе стохастическая модель канцерогенеза, предполагающая, что каждая опухолевая клетка по отдельности обладает способностью к амплификации и способна давать начало новому опухолевому пулу, постепенно отходит на второй план [8]. На смену ей приходит иерархический подход к прогрессированию опухоли. Такой подход предполагает модель, в которой опухоль состоит из полиморфных по своей пролиферативной активности и потенциалу дифференцировки атипичных клеток. Указанная теория подразумевает наличие стволовых опухолевых клеток, которые, аналогично нормальным стволовым клеткам, обладают способностью к многократному делению, в том числе асимметричному, и, соответственно, обладают мультипотентным потенциалом дифференцировки в пределах опухолевой ткани. Считается, что именно стволовые опухолевые клетки потенцируют рост опухоли [9].
Ранние наблюдения (1960-е гг.), основанные на изучении гемобластозов, доказали гетерогенность клеток в массе опухоли, предполагая существование незрелой популяции клеток. Первое доказательство, подтверждающее гипотезу о существовании раковых стволовых клеток (РСК) и основанное на исследовании острого миелолейкоза, было получено в 1990-х гг. [10]. Более поздние исследования показали наличие РСК и в других типах опухолей, в частности при РПЖ.
Механизмы сохранения РСК мультипотентного потенциала к дифференцировке изучены недостаточно, однако одна из главных ролей может принадлежать регуляторным белкам, отвечающим за аналогичные свойства эмбриональных стволовых клеток (ЭСК).
Белок Nanog представляет собой транскрипционный фактор, который участвует в самообновлении стволовых клеток. Впервые он был обнаружен в эмбриональных стволовых клетках мыши и описан как важный регулятор транскрипции, который отвечает за механизмы клеточной дифференцировки [11, 12].
Указанный белок, кодируемый геном NANOG1, состоит из 305 аминокислот и содержит три функциональных домена: N-концевой домен, C-концевой домен и консервативный гомеодоменовый мотив, необходимый для связывания с промоторной областью целевых участков ДНК и регуляции транскрипции [13].
Вместе с другими транскрипционными факторами, наиболее консервативными из которых являются SOX2 и OCT4, Nanog играет главную роль в поддержании свойств ЭСК [14]. Эти три ключевых фактора обычно функционируют совместно через формирование транскрипционной сети, контролируя экспрессию набора связанных с плюрипотентностью ЭСК генов. Nanog высоко экспрессируется в плюрипотентных стволовых клетках, а также в клетках эмбриональных карцином, и снижение его экспрессии происходит при созревании клеток [11]. Сверхэкспрессия белка Nanog не только поддерживает плюрипотентность ЭСК в мышиных моделях в отсутствие такого сильного внешнего фактора, как лейкемия-ингибирующий фактор (LIF), но также способствует росту ЭСК человека на искусственных средах в условиях отсутствия фидера — функциональной основы, представленной первичными эмбриональными фибробластами [15]. Таким образом, уровень белка Nanog определяет судьбу плюрипотентных клеток в физиологических условиях.
Идентификация в массиве опухолевой ткани клеток, проявляющих признаки и маркеры стволовости, могла бы помочь в прогнозировании клинически неблагоприятного течения РПЖ.
Целью исследования было определить прогностическую значимость экспрессии белка Nanog в клетках аденокарциномы предстательной железы.
ПАЦИЕНТЫ И МЕТОДЫ
В период с сентября 2017 г. по май 2019 г. на базе двух стационаров (Городская клиническая больница № 31 и Госпиталь для ветеранов воин № 2) был отобран материал, полученный от 89 пациентов урологического профиля в ходе хирургического лечения, а также в результате диагностических манипуляций, связанных с заболеваниями предстательной железы.
Средний возраст пациентов на момент взятия образцов ткани железы составлял 69,3 года (от 47 до 89 лет). Критерий включения: пациенты с морфологически верифицированным РПЖ, не получавшие неоадъювантную терапию. Критерии исключения: отсутствие данных клинико-инструментальных обследований (показатели ПСА, распространение опухоли), а также наблюдения с объемом материала, недостаточным для проведения иммуногистохимического анализа и последующей интерпретации результата. Оперативное вмешательство было проведено в 48 случаях (трансуретральная резекция в 23, радикальная простатэктомия — в 25 наблюдениях), диагностическая трансректальная мультифокальная биопсия была взята у 41 пациента. Морфологическая оценка РПЖ предполагала не только оценку степени злокачественности опухоли на основании системы градации Глисона, но также, согласно рекомендациям ВОЗ, была дополнена характеристикой прогностической группы в каждом наблюдении.
Иммуногистохимическое исследование материала проводили в соответствии со стандартным протоколом, в качестве первичных антител использовали кроличьи моноклональные антитела к белку Nanog (Clone EPR2027(2), Epitomics; США). Положительный контроль представлял собой образцы ткани семиномы яичка. Пролиферативную активность клеток оценивали при помощи моноклональных кроличьих антител к белку Ki-67 (Clone SP6, Cell Marque; США). В качестве положительного контроля использовали реакцию с лимфоидной тканью миндалин (клетки герминативных центров). ИГХ-реакцию проводили с использованием системы детекции QUANTO на Autostainer 360 (Thermo Fisher Scientific; США). Докрашивание срезов осуществляли гематоксилином Майера. Исследование препаратов проводили с помощью микроскопа Axioplan 2 imaging (Karl Zeiss; Германия) с фотофиксацией камерой AxioCam ERc 5s (Karl Zeiss; Германия).
Для количественной оценки пролиферативной активности осуществляли подсчет соотношения окрашенных ядер на 300 клеток при увеличении х400. Условно была принята следующая градация: отсутствие экспрессии (0 баллов), слабая экспрессия (1 балл) — окрашены менее 10% ядер клеток, умеренная экспрессия (2 балла) — более 10%, но менее 33% клеточных ядер, сильная экспрессия (3 балла) — более 33% ядер клеток в ткани были положительными.
Оценку экспрессии Nanog также осуществляли путем подсчета числа иммунопозитивных клеток при большом увеличении (х400, минимальное число клеток — 300), однако результат был скорректирован с учетом интенсивности окрашивания. Применяли шкалу с числом баллов от 0 до 3: 0 — отсутствие реакции, 1 — реакция слабая, 2 и 3 — реакция умеренная и сильная соответственно. Затем вычисляли иммуногистохимический индекс H-score (histochemical score) по следующей формуле:
H-score = Σ (Pi × i),
где i — интенсивность окрашивания, выраженная в баллах от 0 до 3; Pi — доля клеток, окрашенных с разной интенсивностью, в %. Значение индекса колебалось от 0 до 300 баллов [16].
Статистический анализ проводили при помощи программы Statistica 10.0 (StatSoft; США) в среде Windows 10. Достоверность различия выборок с распределением, отличным от нормального, определяли с помощью U-критерия Манна–Уитни. Различия считали статистически значимыми при р < 0,05. Корреляционные взаимоотношения оценивали с помощью коэффициента Спирмена, для оценки силы связи коэффициентов корреляции использовали шкалу Чеддока. Для выявления связи между экспрессией исследуемых маркеров и клинико-морфологическими характеристиками пациентов использовали критерий хи-квадрат (χ2) и точный критерий Фишера.
РЕЗУЛЬТАТЫ
После гистологического исследования РПЖ был диагностирован в 68 случаях, остальные наблюдения характеризовались наличием доброкачественной гиперплазии в сочетании с воспалительными изменениями различной степени выраженности. После морфологической оценки все наблюдения были разделены, согласно рекомендациям, на пять прогностических групп: к первой прогностической группе были отнесены 18 случаев (26,5%), ко второй — 16 случаев (23,6%), к третьей — 15 (22,1%). В четвертую и пятую прогностические группы попали 10 (14,7%) и 9 (13,2%) наблюдений соответственно. На основании клинико-морфологических данных определяли степень распространения опухолевого процесса: случаи случайно обнаруженной при обследовании опухоли, а также карциномы, ограниченной тканью органа, были отнесены к локализованным формам (Т1 и Т2 по классификации TNM AJCC, 8-е издание). Экстрапростатический рост расценивали как признак распространенной формы (Т3 и Т4). Пороговое значение концентрации ПСА в крови составляло 10 нг/мл.
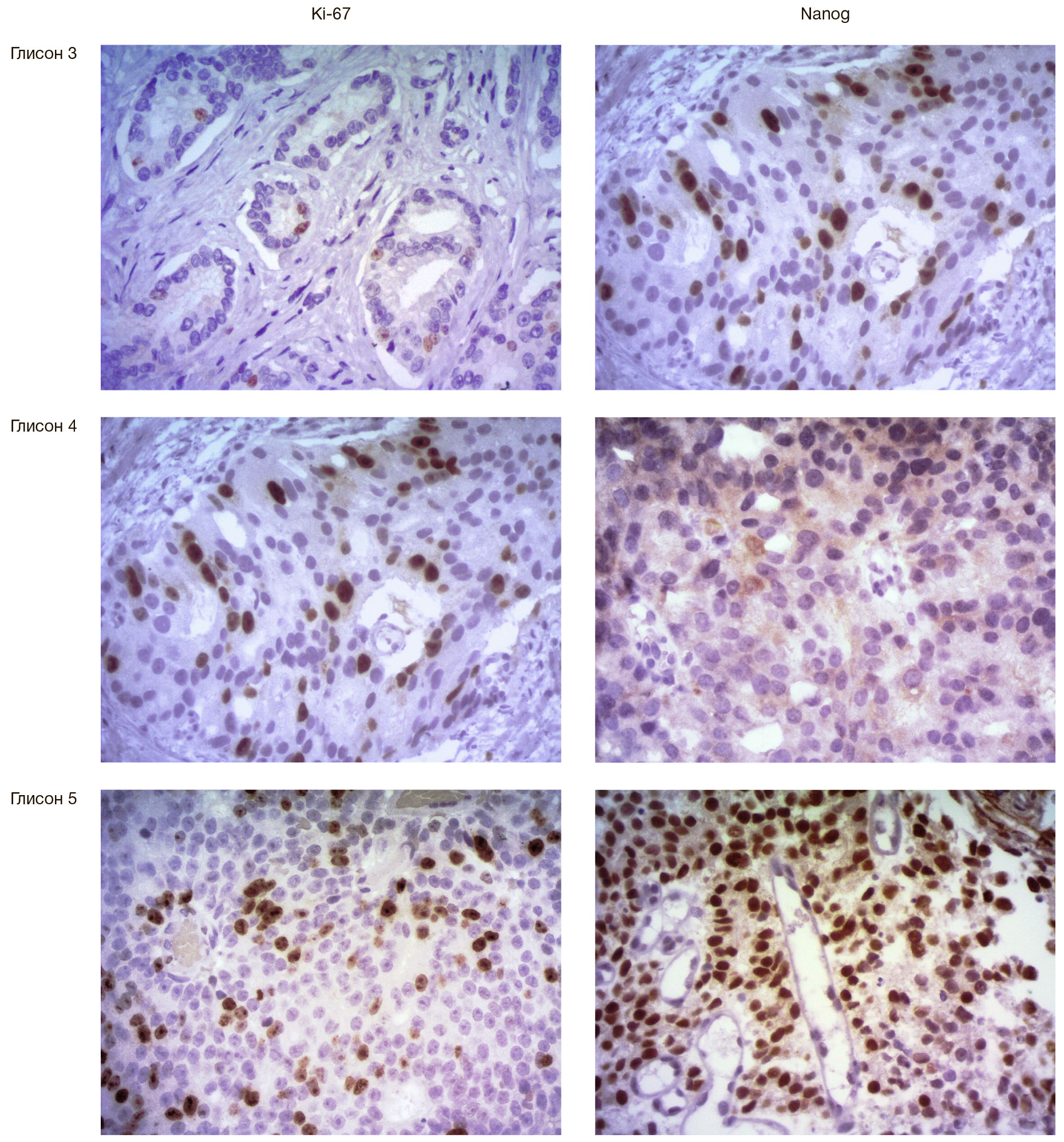
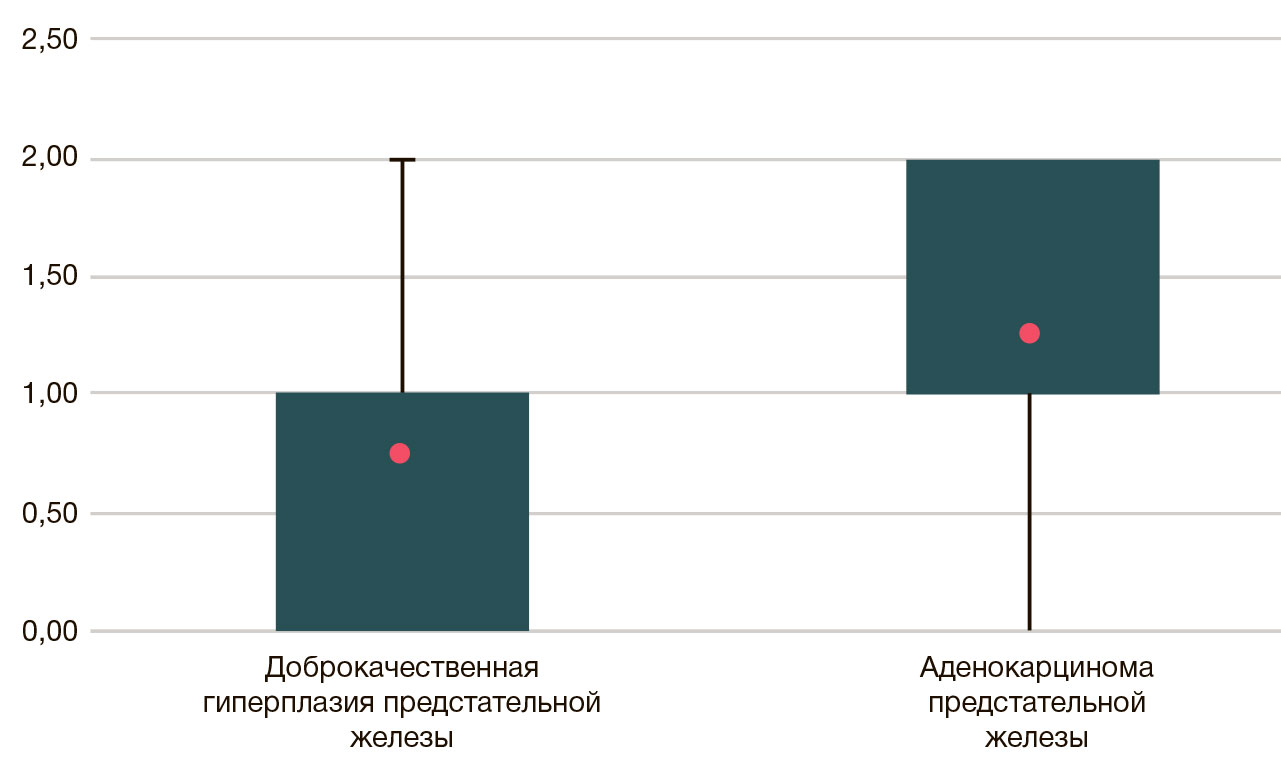
Среди всех наблюдений экспрессия Ki-67 была обнаружена в 82 случаях (92,1%). В группе доброкачественной гиперплазии предстательной железы экспрессия Ki-67 была выявлена в 14 наблюдениях (66,7%), причем подавляющее большинство случаев характеризовалось слабым уровнем экспрессии. При сравнении экспрессии этого маркера в наблюдениях доброкачественного поражения предстательной железы и РПЖ были получены статистически значимые различия, причем в целом показатели пролиферативной активности в последнем случае оказались на порядок выше (p < 0,001) (рис. 1).
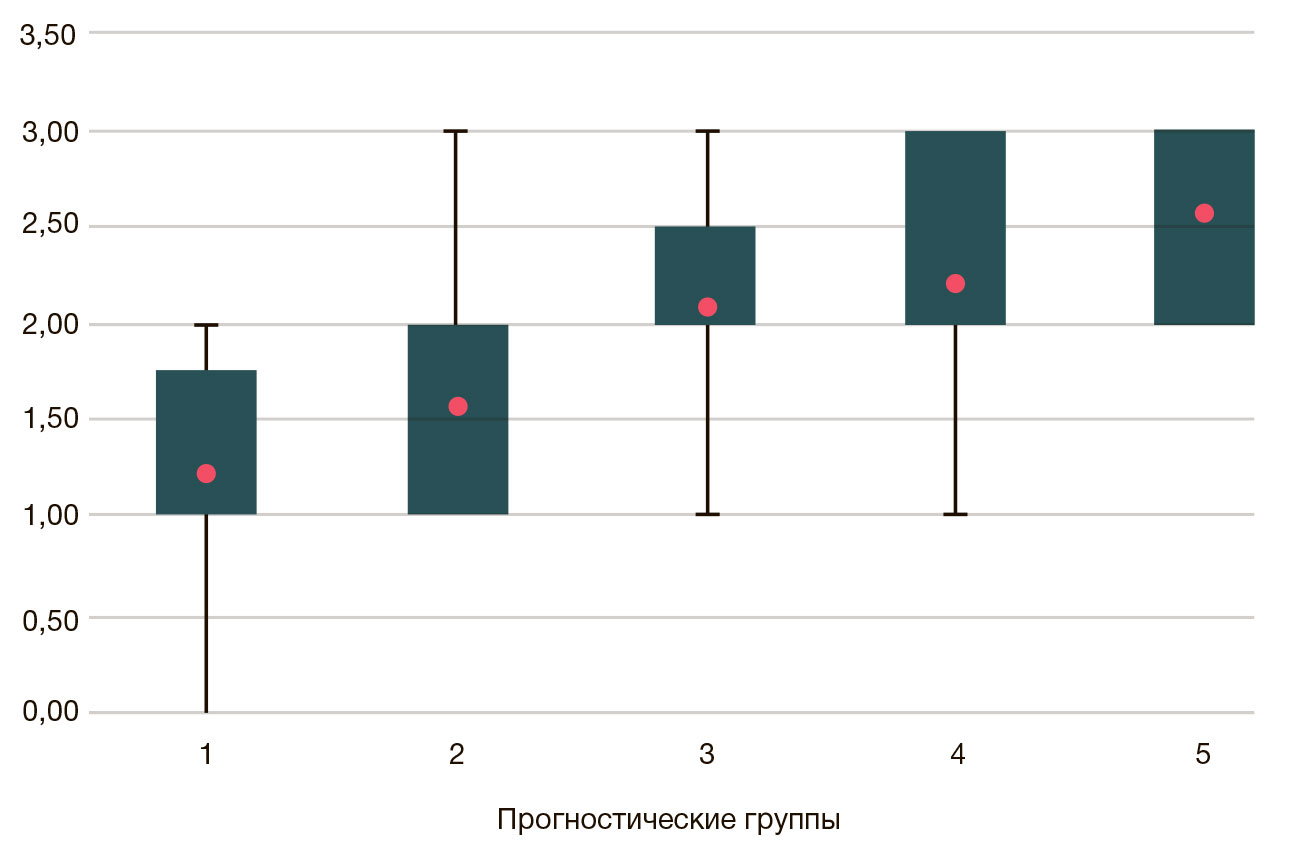
Сравнительный анализ показателей пролиферативной активности в различных прогностических группах продемонстрировал проградиентное увеличение средних значений уровня экспрессии Ki-67 с увеличением порядкового номера прогностической группы (рис. 2). Корреляционный анализ показал наличие сильной прямой связи между сравниваемыми параметрами (rs = 0,619, p < 0,001).
Экспрессия Nanog
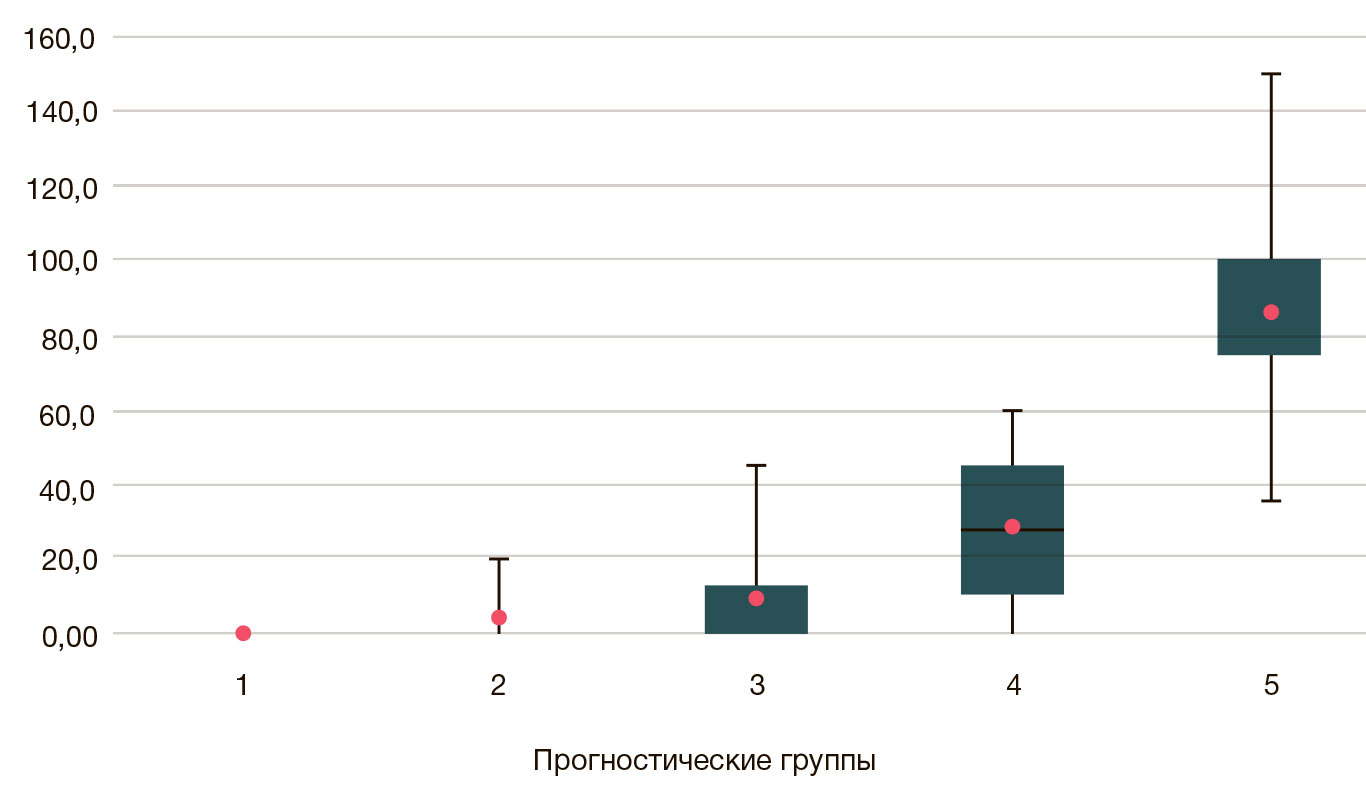
В нашем исследовании экспрессия Nanog отсутствовала во всех наблюдениях доброкачественной гиперплазии предстательной железы, в то время как среди 68 случаев РПЖ иммунопозитивными к данному белку оказались 26 наблюдений (38,2%). В прогностической группе 1 экспрессии Nanog выявлено не было, во 2-й прогностической группе позитивными оказались три наблюдения (18,75%), в 3-й — 6 (40%), в 4-й — 8 (80%), и, наконец, в 5-й — 9 из 9 наблюдений. Средние показатели экспрессии Nanog с учетом интенсивности окраски в различных прогностических группах представлены на рис. 3.
Сопоставление показателей иммуногистохимического индекса экспрессии Nanog в клетках аденокарциномы предстательной железы позволило выявить прямую связь с увеличением порядкового номера прогностической группы (rs = 0,786, p < 0,001).
Характер экспрессии исследуемых маркеров в основных морфологических паттернах РПЖ по классификации Глисона представлен на рис. 4.
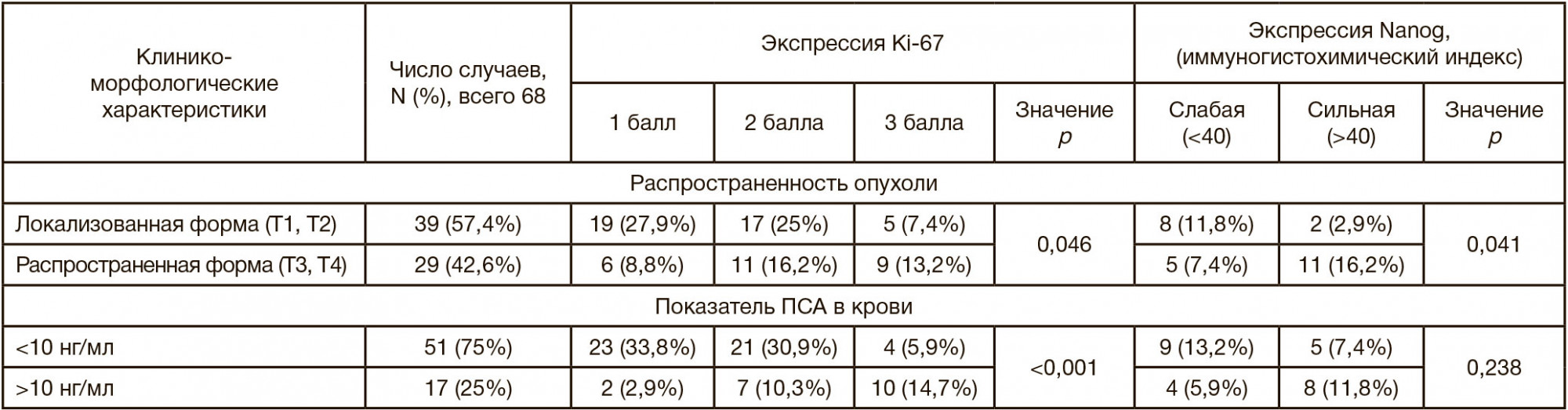
При сопоставлении клинико-морфологических особенностей с показателями экспрессии исследуемых маркеров (таблица) была обнаружена статистически значимая связь между уровнем экспрессии Ki-67 и наличием экстрапростатического распространения опухоли (р = 0,046), а также высоким уровнем ПСА в крови (> 10 нг/мл; р < 0,001). В то же время высокие значения иммуногистохимического индекса экспрессии Nanog были связаны с наличием распространенной формы рака (р = 0,041), однако статистически значимой связи между показателями реактивности к данному маркеру и концентрацией ПСА в крови выявлено не было.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Изучение особенностей раковых стволовых клеток (РСК) позволило пересмотреть подходы к основополагающим принципам опухолевой организации и метаболизму. Клеточная гетерогенность опухолевой ткани обусловлена ее иерархической организацией, отчасти моделирующей физиологическую гистоархитектонику исходной ткани. Симметричное и асимметричное деление РСК приводит к поддержанию опухолевой популяции, с одной стороны, и к увеличению объема опухолевой ткани за счет потерявших свойства стволовости клеток — с другой [17].
Было показано, что уровень экспрессии Nanog выше в РСК, чем в остальной популяции опухолевых клеток при некоторых типах онкологии [18, 19].
Функциональные исследования продемонстрировали, что Nanog является не только маркером РСК, но также способствует развитию РСК-подобных характеристик при некоторых видах рака. Например, активация эмбрионального гена NANOG заставляет субпопуляцию клеток колоректального рака принимать стволовой фенотип [20].
Экспрессия Nanog была обнаружена в различных опухолях, включая рак молочной железы, шейки матки, полости рта, почек, простаты, легких, желудка, мозга и яичников [21]. Выраженная экспрессия Nanog — показатель плохого прогноза для пациентов с серозной карциномой яичников, колоректальным раком и раком молочной железы. В плоскоклеточной карциноме полости рта и аденокарциноме легких более высокая экспрессия Nanog вместе с Oct4 связана с поздней стадией рака и более низкими показателями выживаемости [22, 23].
В раковых клетках аберрантная экспрессия Nanog была связана с повышенной скоростью пролиферации in vitro и ростом опухоли in vivo. Было показано, что сверхэкспрессия Nanog, наряду с Oct4, увеличивает клоногенный рост и образование сфероидных тел клеток аденокарциномы легких [24], и, наоборот, нокдаун Nanog в клетках рака молочной железы подавляет клоногенный рост и пролиферацию [25]. При нокдауне Nanog несколько генов, связанных с клеточным циклом (таких как циклины D1, D2, D3 и E1, а также циклин-зависимые киназы 1 и 6), а также связанный с p53 сигнальный путь (например, Bcl6 и Atf3) были подавлены, что может говорить об участии Nanog в клеточном цикле [25, 26].
Настоящее исследование позволило выявить экспрессию белка Nanog в клетках РПЖ, причем данный белок отсутствовал как в нормальных тканях предстательной железы, так и в наблюдениях доброкачественной гиперплазии предстательной железы. Гетерогенность выраженности экспрессии белка Nanog говорит о том, что различные варианты аденокарциномы, отличающиеся в первую очередь по степени клеточной анаплазии, имеют различный гистохимический профиль. Принимая во внимание, что этот транскрипционный белок присущ в основном эмбриональным клеткам, обнаружение его в клетках опухолевого массива говорит в пользу теории существования особого пула клеток с признаками «стволового» фенотипа. При сравнении различных прогностических групп было обнаружено, что с возрастанием степени клеточной анаплазии частота и степень выраженности экспрессии Nanog увеличивается, что находит свое отражение в оценке опухоли по классификации Глисона и в дальнейшем влияет на выбор прогностической группы. Такая прямая корреляция подтверждает тот факт, что в клеточном массиве наиболее низкодифференцированных аденокарцином предстательной железы существует значимая субпопуляция РСК, которые проявляют свойства мультипотентности благодаря наличию Nanog. Также в исследовании была продемонстрирована статистически значимая связь между выраженностью экспрессии Nanog и наличием экстрапростатического распространения опухоли, что является немаловажным фактором, влияющим на прогноз. Большинство наблюдений, оказавшихся в значительной степени иммунореактивными по экспрессии данного белка, также характеризовались высокими показателями экспрессии Ki-67, что говорит о высоком пролиферативном потенциале анаплазированных раковых клеток, в том числе РСК. ИГХ-реакция с маркерами Nanog и Ki-67 в прогностических группах 1 и 2 оказалась на порядок ниже, чем в 5-й группе, что свидетельствует о потенциально благоприятном течении хорошо дифференцированных карцином.
ВЫВОДЫ
Определение раковых стволовых клеток в тканях рака предстательной железы является перспективным методом диагностики и прогнозирования течения заболевания. Высокие показатели экспрессии Nanog связаны с высокой пролиферативной активностью опухоли, а также потенциально неблагоприятным прогнозом — обладающие свойством полипотентности раковые стволовые клетки могут служить источником самообновления популяции опухолевых клеток, играть роль в механизмах метастазирования и химиорезистентности. Обнаружение опухолевых клеток с таким потенциалом требует выбора более агрессивной лечебной тактики, направленной в первую очередь на радикальную элиминацию опухоли.
- Каприн А. Д., Старинский В. В, Петрова Г. В., редакторы. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.: ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, 2019; 250 с.
- Zhou CK, Check DP, Lortet-Tieulent J, Laversanne M, Jemal A, Ferlay J, et al. Prostate cancer incidence in 43 populations worldwide: аn analysis of time trends overall and by age group. Int J Cancer. 2016; 138 (6): 1388–400.
- Heidegger I, Heidenreich A, Pfister D. New biomarkers for selecting the best therapy regimens in metastatic castration-resistant prostate cancer. Target Oncol. 2017; 12 (1): 37–45.
- Horner MJ, Ries LAG, Krapcho M, Neyman N, Aminou R, Howlader N, et al (eds). SEER Cancer Statistics Review, 1975- 2006, National Cancer Institute. Bethesda, MD. Available from: http://seer.cancer.gov/csr/1975_2006/
- Bell KJL, Del Mar C, Wright G, Dickinson J, Glasziou P. Prevalence of incidental prostate cancer: а systematic review of autopsy studies. Int J Cancer. 2015; 137 (7): 1749–57.
- Howlader N, Noone AM, Krapcho M, Miller D, Bishop K, Altekruse SF, et al. SEER Cancer Statistics Review 1975-2013 National Cancer Institute SEER Cancer Statistics Review 1975-2013, National Cancer Institute. National Cancer Institute. Bethesda, 2016. Available from: https://seer.cancer.gov/csr/1975_2014/.
- Thompson IM, Pauler DK, Goodman PJ, et al. Prevalence of Prostate Cancer among Men with a Prostate-Specific Antigen Level ≤ 4.0 ng per Milliliter. N Engl J Med. 2004; 350 (22): 2239–46.
- Kreso A, Dick JE. Evolution of the cancer stem cell model. Cell Stem Cell. 2014; 14 (3): 275–91. DOI: 10.1016/j.stem.2014.02.006.
- Aguilar-Gallardo C, Simón C. Cells, stem cells, and cancer stem cells. Seminars in Reproductive Medicine. 2013; 31 (01): 005– 013. DOI: 10.1055/s-0032-1331792.
- Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997; 3: 730–7. DOI: 10.1038/nm0797-730.
- Chambers I, Colby D, Robertson M, Nichols J, Lee S, Tweedie S, Smith A. Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells. Cell. 2003; 113: 643–55. PubMed PMID: 12787505.
- Mitsui K, Tokuzawa Y, Itoh H, et al. The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell. 2003; 113: 631–42.
- Gawlik-Rzemieniewska N, Bednarek I. The role of NANOG transcriptional factor in the development of malignant phenotype of cancer cells. Cancer Biol Ther. 2015; 17 (1): 1–10. DOI:10.108 0/15384047.2015.1121348.
- Boiani M, Scholer HR. Regulatory networks in embryo-derived pluripotent stem cells. Nat Rev Mol Cell Biol. 2005; 6: 872–84.
- Gong S, Li Q, Jeter CR, Fan Q, Tang DG, Liu B. Regulation of NANOG in cancer cells. Mol Carcinog. 2015; 54 (9): 679–87. DOI: 10.1002/mc.22340.
- Hirsch FR, Varella-Garcia M, Bunn PA, et al. Epidermal growth factor receptor in non-small-cell lung carcinomas: correlation between gene copy number and protein expression and impact on prognosis. J Clin Oncol. 2003; 21 (20): 3798–807.
- Batlle E, Clevers H. Cancer stem cells revisited. Nat Med. 2017; 23 (10): 1124–34. DOI:10.1038/nm.4409.
- Zhang J, Espinoza LA, Kinders RJ, et al. NANOG modulates stemness in human colorectal cancer. Oncogene. 2013 Sep 12; 32 (37): 4397–405.
- Niu CS, Li DX, Liu YH, Fu XM, Tang SF, Li J. Expression of NANOG in human gliomas and its relationship with undifferentiated glioma cells. Oncol Rep. 2011; 26 (3): 593–601.
- Ibrahim EE, Babaei-Jadidi R, Saadeddin A, et al. Embryonic NANOG activity defines colorectal cancer stem cells and modulates through AP1- and TCF-dependent mechanisms. Stem Cells. 2012; 30 (10): 2076–87.
- Grubelnik G, Boštjančič E, Pavlič A, Kos M, Zidar N. NANOG expression in human development and cancerogenesis. Exp Biol Med. 2020; 245 (5): 456–64.
- Chiou SH, Yu CC, Huang CY, et al. Positive correlations of Oct- 4 and Nanog in oral cancer stem-like cells and high-grade oral squamous cell carcinoma. Clin Cancer Res. 2008; 14 (13): 4085–95.
- Gillis AJ, Stoop H, Biermann K, et al. Expression and interdependencies of pluripotency factors LIN28, OCT3/4, NANOG and SOX2 in human testicular germ cells and tumours of the testis. Int J Androl. 2011; 34 (4 Pt 2): e160–e174.
- Chiou SH, Wang ML, Chou YT, et al. Coexpression of oct4 and nanog enhances malignancy in lung adenocarcinoma by inducing cancer stem cell-like properties and epithelial-mesenchymal transdifferentiation. Cancer Res. 2010; 70 (24): 10433–4.
- Han J, Zhang F, Yu M, et al. RNA interference-mediated silencing of NANOG reduces cell proliferation and induces G0/G1 cell cycle arrest in breast cancer cells. Cancer Lett. 2012; 321 (1): 80–8.
- Choi SC, Choi JH, Park CY, Ahn CM, Hong SJ, Lim DS. Nanog regulates molecules involved in stemness and cell cycle-signaling pathway for maintenance of pluripotency of P19 embryonal carcinoma stem cells. J Cell Physiol. 2012; 227 (11): 3678–92.