ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Теломеризованные фибробласты как потенциальный объект для 3D-моделирования патологических гипертрофических рубцов in vitro
Научно-исследовательский институт биомедицинской химии имени В. Н. Ореховича, Москва, Россия
Поиск оптимальных клеточных моделей для изучения патогенеза гиперпластических рубцов является актуальной задачей. Целью исследования было оценить перспективу использования теломеризованных фибробластов в качестве объекта при 3D-моделировании патологических гипертрофических рубцов in vitro. Клетки НФ и Фб-hTERT культивировали в виде монослоя и сфероидов, в интактном состоянии и при воздействии TGFβ1. Метаболическую активность клеток оценивали методом МТТ. Скорость зарастания дефекта монослоя клеток вычисляли с помощью scratch-теста. Уровень экспрессии генов, ассоциированных с гиперпластическими процессами, определяли методом qRT-PCR. Для Фб-hTERT характерно более выраженное по сравнению с НФ усиление метаболической активности клеток при воздействии TGFβ1 (для 1 нг/мл 179 ± 12% и 135 ± 13% соответственно; p < 0,05). Сфероиды, сформированные из Фб-hTERT, были значительно крупнее сфероидов, полученных из НФ. Продукция основных специфичных для фибробластов белков, ассоциированных с продукцией внеклеточного матрикса (COL1A1, COL3A1, FN1), при стимуляции TGFβ1 была ниже в Фб-hTERT по сравнению с НФ (более чем в 25, 20 и 2 раза соответственно; p < 0,05). Интактные НФ более активно, по сравнению с Фб-hTERT, восстанавливали дефект монослоя (в 2,28 раза на вторые сутки; p < 0,05). При этом воздействие TGFβ1 приводило к увеличению скорости заполнения дефекта клетками Фб-hTERT (в 2 раза на вторые сутки; p < 0,05), но не НФ. Таким образом, теломеризованные фибробласты имеют ряд фенотипических признаков, характерных для келоидных фибробластов, но в то же время есть ограничения, которые следует учитывать при использовании Фб-hTERT для моделирования патологических гипертрофических рубцов.
Ключевые слова: фибробласты, in vitro модель, hTERT, гипертрофический рубец, келоидный рубец, TGFβ1
Финансирование: работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы» (соглашение № 05.604.21.0219, Уникальный идентификатор проекта RFMEFI60419X0219).
Вклад авторов: Н. Г. Лузгина, А. Л. Русанов — концепция и дизайн исследования; В. С. Шадрин, П. М. Кожин, О. О. Шошина, Н. Г. Лузгина, А. Л. Русанов — анализ литературы, анализ и интерпретация полученных данных, редактирование рукописи; В. С. Шадрин, П. М. Кожин — планирование и проведение исследования; В. С. Шадрин — написание статьи.
Для корреспонденции: Валериан Сергеевич Шадрин
ул. Погодинская, д. 10, стр. 8, г. Москва, 119121; moc.liamg@nirdahsnairelav
Ежегодно в мире после хирургических вмешательств, травм и ожогов более чем у 100 млн пациентов образуются рубцы кожных покровов. В зависимости от локализации и глубины повреждения, условий заживления раны и индивидуальных особенностей организма процесс регенерации может значительно варьировать по проявлениям и последствиям и приводить к образованию нормальных (нормотрофических) или патологических рубцов. Чрезмерная активация гиперпластических процессов, развивающихся в силу различных причин, приводит к образованию так называемых гипертрофических и келоидных рубцов. Оба варианта рубцов — проявление фибропролиферативного расстройства, в результате которого происходят чрезмерная активация фибробластов в ране и аберрантное образование внеклеточного матрикса [1].
Для изучения патогенеза гиперпластических рубцов и разработки эффективных средств их профилактики и лечения необходимы удобные и доступные экспериментальные модели in vitro, получаемые на основе клеток, способных наиболее полно воспроизводить патологические профиброгенные программы. Использование с этой целью фибробластов, выделенных из области келоидов, сопряжено со сложностями доступа к достаточному количеству клинического материала, а также вариабельностью фенотипа клеток, полученных от различных доноров. В связи с этим поиск оптимальных модельных клеток, наиболее полно воспроизводящих фенотип келоидных фибробластов, является актуальной задачей. Представляется перспективным использовать с этой целью иммортализованные клеточные линии, имеющие неограниченное число делений и стабильный фенотип вне зависимости от клеточного пассажа.
Известно, что для келоидных фибробластов характерны высокая пролиферативная активность и быстрый рост, повышенная экспрессия коллагена I, фибронектина, эластина, периостина (регулирует синтез коллагена I типа), тенасцина (участвует в клеточной адгезии) [2, 3], что приводит к избыточной наработке соединительной ткани, в том числе за пределами локуса повреждения кожи, а также ряд метаболических особенностей, свойственных клеткам опухолей [4, 5].
Есть мнение, что фенотип фибробластов в патологических рубцах может определять высокая активность теломеразы [6]. Так, за счет снижения теломеразной активности в келоидных фибробластах, авторам одного из исследований удалось уменьшить активность роста и пролиферации клеток, а также нормализовать ряд других фенотипических параметров клеток, что позволило прийти к заключению о перспективности стратегии ингибирования теломеразы при терапии келоидов [5]. В этой связи представляет интерес оценка перспективы использования теломеризованных фибробластов для моделирования патологических гиперпластических рубцов in vitro.
При разработке адекватных моделей патологических рубцов важно использовать оптимальные способы культивирования клеток. Известно, что в центре келоидных тканей часто возникает гипоксия вследствие окклюзии капилляров из-за избытка коллагена и эндотелиальных клеток [7]. Краевые фибробласты метаболически более активны, проникают в окружающие ткани и активируют ангиогенез, предположительно, для поддержания инвазивности [8]. В связи с этим перспективны модели, основанные на культивировании клеток в виде клеточных сфероидов.
Для индукции профиброгенного фенотипа фибробластов in vitro часто используют трансформирующий фактор роста β1 (TGFβ1) [9]. Этот многофункциональный белок регулирует рост клеток, дифференцировку, подвижность и выработку внеклеточного матрикса в нормальном процессе заживления ран, но его повышенная экспрессия может приводить к развитию фиброзных нарушений [10]. TGFβ1 стимулирует рост и секрецию коллагена, индуцирует биосинтез фибронектина в келоидных фибробластах [11]. Представляет интерес функциональный ответ потенциальных модельных клеток на воздействие данного ростового фактора.
Целью исследования было оценить перспективу использования теломеризованных фибробластов в качестве объекта при 3D-моделировании патологических гипертрофических рубцов in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Клеточные линии
Исследование проводил на культурах нормальных (НФ) и теломеризованных (Фб-hTERT) фибробластов кожи человека. НФ были получены из криобанка («Перспектива»; Россия) и представляли собой первичные клеточные линии фибробластов третьего пассажа, выделенные из крайней плоти доноров в возрасте 35–38 лет. Для учета индивидуальных особенностей клеток, полученных от различных доноров, при проведении экспериментов были использованы три клеточные линии.
Фб-hTERT были любезно предоставлены проф. Е. Е. Егоровым (Институт молекулярной биологии имени В. А. Энгельгардта РАН). Культура была получена в результате введения гена каталитического компонента теломеразы в фибробласты кожи линии 1608. Данные клетки имеют устойчивый фенотип, воспроизводимый до 200-го пассажа [12].
Культивирование клеток
Для культивирования использовали полную культуральную среду DMEM/F-12 (Gibco; США), содержавшую 10% FBS («Диаэм»; Россия), 1%-й раствор антибиотика- антимикотика (в финальной концентрации: пенициллин 100 ед./мл, стрептомицин 100 ед./мл, амфотерицин Б 0,25 мкг/мл) (Gibco; США) и 1%-й раствор GlutaMAX (финальная концентрация дипептида L-аланил-L-глутамина — 2 мМ) (Gibco; США).
Исследование влияния TGFβ1 на клетки методом МТТ
Для МТТ-теста [13] в каждую лунку плоскодонного 96-луночного планшета вносили по 2,5 тыс. клеток НФ (четвертый пассаж) и Фб-hTERT из культурального флакона с 70%-й конфлюентностью и преинкубировали 24 ч в полной среде DMEM/F-12 при 37 °С и 5% СО2. Затем среду меняли на свежую, содержащую TGFβ1 (ProSpec; Израиль), и инкубировали клетки еще 48 ч, меняя среду каждые 24 ч. Среду отбирали, лунки промывали раствором DPBS (Gibco; США), добавляли по 100 мкл раствора МТТ («Диаэм»; Россия) с концентрацией 1 мг/мл и инкубировали 2,5 ч при 37 °С и 5% СО2. По истечении этого времени раствор МТТ заменяли раствором ДМСО («Биолот»; Россия) и инкубировали клетки при комнатной температуре до полного растворения кристаллов формазана. Определяли оптическую плотность в каждой лунке на 490 нм (с учетом фонового поглощения на 655 нм). МТТ-тест проводили в трех повторах по пять лунок при следующих концентрациях TGFβ1: 0 нг/мл; 0,1 нг/мл; 1 нг/мл; 5 нг/мл; 10 нг/мл.
Метаболическую активность рассчитывали по следующей формуле (ОП — оптическая плотность): 100% * (ОП490 (опытных лунок) — ОП490 (среды))/(ОП655 (контрольных лунок) — ОП655 (среды)).
Культивирование клеток в виде сфероидов
Для получения сфероидов использовали 96-луночные планшеты ultra low attachment (Corning; США), в которые вносили 5, 10 или 20 тыс. клеток (НФ или Фб-hTERT) на лунку из культурального флакона с 70%-й конфлюентностью и инкубировали девять суток в полной среде DMEM/F-12 при 37 °С и 5% СО2. Среду меняли каждые 24 ч.
Для исследования влияния TGFβ1 на сфероиды вносили 20 тыс. клеток НФ и 10 тыс. клеток Фб-hTERT на лунку (для получения сфероидов примерно одинакового размера) из культурального флакона с 70%-й конфлюентностью и инкубировали трое суток в полной среде DMEM/F-12 с добавлением 1 нг/мл TGFβ1 при 37 °С и 5% СО2. Среду меняли каждые 24 ч для поддержания концентрации фактора роста на постоянном уровне.
Каждый сфероид фотографировали ежедневно в течение всего срока культивирования с помощью микроскопа Primovert (Carl Zeiss; Германия). Определение параметров сфероидов (диаметр) производили с помощью программного пакета для обработки изображений ImageJ и его расширения Fiji (National Institutes of Health; США) [14].
Оценка скорости зарастания дефекта монослоя клеток с помощью scratch-теста
В лунки 24-луночного планшета вносили по 50 тыс. клеток НФ и Фб-hTERT из культурального флакона с 70%-й конфлюентностью и преинкубировали 24 ч в полной среде DMEM/F-12 при 37 °С и 5% СО2 до образования монослоя в лунке. Затем среду меняли, наносили стандартизированное повреждение монослоя с помощью наконечника объемом 1 мл, промывали клетки раствором DPBS и добавляли среду DMEM/F-12 (контроль) или DMEM/F-12 с TGFβ1 в концентрации 1 нг/мл (опыт). После этого клетки инкубировали в течение двух суток. Каждую лунку фотографировали по всей длине повреждения ежедневно. Обработку фотографий проводили в программе CellProfiler (Broad Institute of Harvard and MIT; США) [15]. Вычисляли площадь восстановления дефекта за 24 ч и 48 ч и находили процентное соотношение с начальной площадью дефекта. Эксперимент проводили в трех повторах по три лунки.
Определение уровня экспрессии генов, ассоциированных с гиперпластическими процессами, методом qRT-PCR
С учетом литературных данных в качестве целевых генов были выбраны гены, кодирующие синтез коллагена I, коллагена III, фибронектина, а также ген PAI-1. Данный список генов, безусловно, не является исчерпывающим, но увеличение уровня их экспрессии позволяет констатировать факт модуляции профиброгенного потенциала клеток.
Для qRT-PCR во флакон вносили клеточную суспензию (по 200 тыс. клеток в 5 мл среды) преинкубировали клетки 48 ч в полной среде DMEM/F-12 при 37 °С и 5% СО2. Затем среду меняли на содержащую 1 нг/мл TGFβ1 и инкубировали клетки еще 48 ч, меняя среду каждые 24 ч. После этого из клеток выделяли РНК с помощью набора RNeasy Mini Kit (Qiagen; Германия) по стандартному протоколу. Количество полученной РНК измеряли на приборе NanoDrop 2000c (Thermo Scientific; США). Для проведения реакции обратной транскрипции использовали набор MMLV RT kit («Евроген»; Россия) по стандартному протоколу, добавляя в реакцию по 1 мкг РНК. qPCR проводили, используя qPCRmix-HS SYBR+LowROX («Евроген»; Россия). Для каждого гена и каждого образца реакцию проводили в трех повторах. В качестве референсного гена использовали GAPDH.
Использовали следующие праймеры: GAPDH Forward Primer F: 5'-TCGACAGTCAGCCGCATCTTCTTT-3' Reverse Primer R: 5'-ACCAAATCCGTTGACTCCGACCTT-3'; COL1A1 F: 5'-CCAAGAGGAAGGCCAAGTC-3' R:5'ACACGTCTCGGTCATGGTA-3'; COL3A1 F: 5'-CTGGTGCTAAGGGTGAAGTT-3' R: 5'-GTCCAGGTTCTCCTCTTTGTC-3'; FN1 F: 5'-GAATAAGCTGTACCATCGCAAAC-3' R: 5'-ACCAAGACACACACACTCTAAC-3'; PAI-1 F: 5'-GGCTGACTTCACGAGTCTTT-3' R: 5'-CGTTCACCTCGATCTTCACTT-3';
Определение синтеза коллагена I клетками сфероидов
Сфероиды формировали, как описано выше. После трех суток инкубации сфероиды из 10 тыс. клеток фиксировали в 4%-м формалине, подвергали стандартной гистологической проводке с заключением в парафин, изготавливали парафиновые срезы и окрашивали первичными антителами козы к коллагену I человека («ИМТЕК»; Россия) и вторичными FITC-конъюгированными антителами к IgG козы (ab6881, Abcam; США). Для каждой группы использовали три биологических образца, для дальнейшей окраски брали по пять срезов с образца. Все препараты подвергали окрашиванию одновременно с использованием единого набора реактивов (разведений антител и буферов).
Полученные препараты последовательно визуализировали с помощью лазерного конфокального микроскопа LSM 710 (Carl Zeiss; Германия) с использованием одинаковых настроек. Обработку фотографий проводили в программе CellProfiler [15]. Для каждого образца вычисляли среднюю интенсивность флуоресценции (суммарная интенсивность, деленная на площадь сфероида). Значения средней интенсивности флуоресценции нормировали на значение средней интенсивности флуоресценции в группе НФ без воздействия TGFβ1.
Статистическая обработка данных
Полученные результаты обрабатывали с помощью языка программирования для статистической обработки данных R. Различие между группами определяли с помощью t-критерия с поправкой Бенджамини–Хохберга на множественное сравнение. Статистически значимыми различия считали при p < 0,05. Данные представлены в виде M ± m, если не указано иное.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
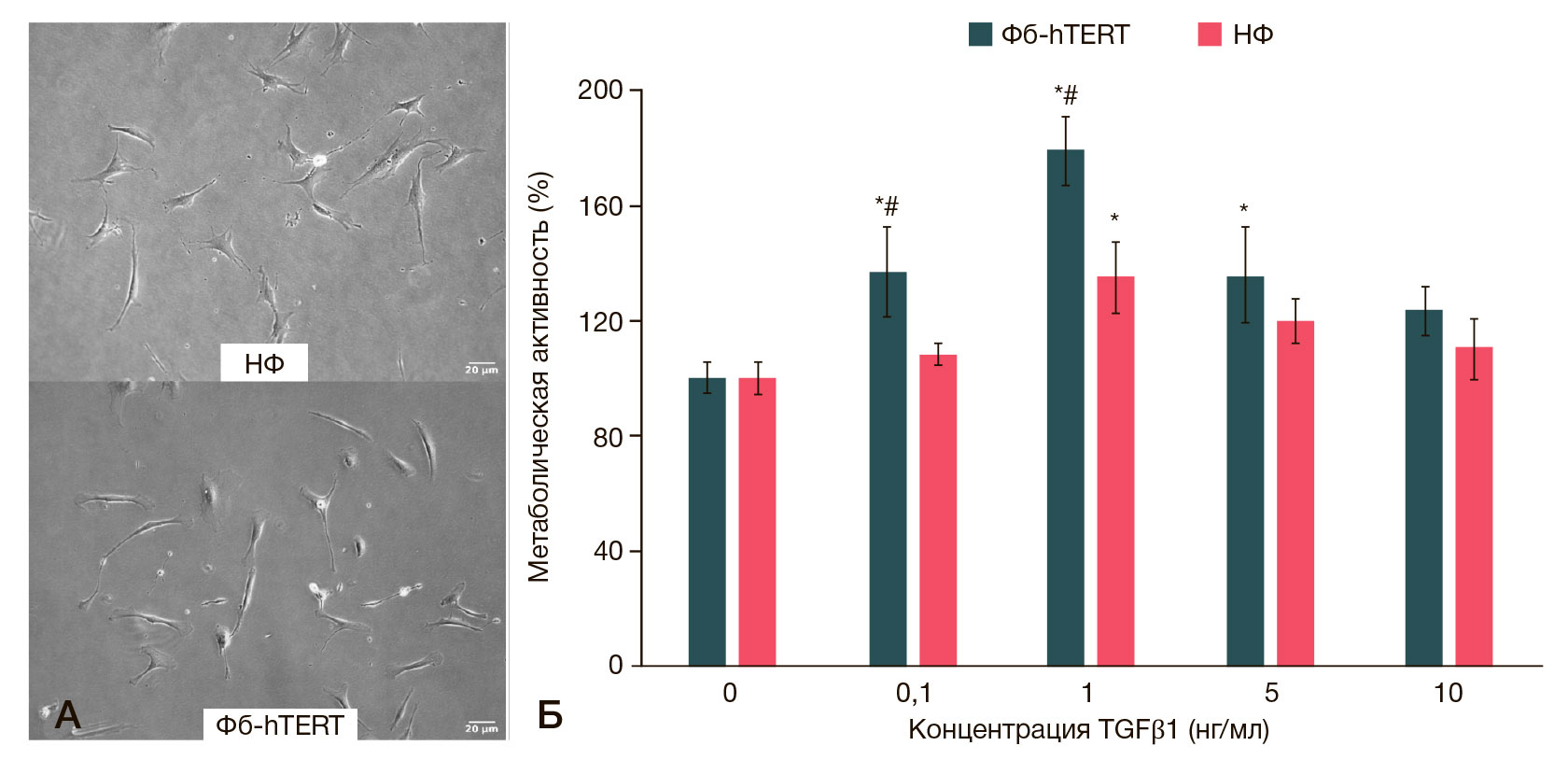
Нормальные и иммортализованные фибробласты кожи различались размерами и пролиферативной активностью. При выращивании в низкой плотности (менее 50% конфлюентности) НФ имели площадь 723 ± 54 мкм2 (рис. 1А). Время удвоения, рассчитанное по формуле DT = T * ln2 / ln (X1/X0), где Т — время инкубации, Х1 — конечное количество клеток, Х0 — начальное количество клеток, для данных клеток составило 3,1 ± 0,6 сут. 100%-ю конфлюентность клетки при культивировании в виде монослоя достигали при плотности 16,5 ± 3,1 тыс./см2.
Площадь клеток Фб-hTERT была меньшей 675 ± 29 мкм2 (рис. 1А). Время удвоения составило 1,8 ± 0,4 сут. 100%-ю конфлюентность клетки достигали при плотности 41,9 ± 7,2 тыс./см2.
МТТ-тест показал дозозависимое влияние TGFβ1 на культуры НФ и Фб-hTERT (рис. 1Б). Достоверное увеличение метаболической активности Фб-hTERT и НФ обнаружено при добавлении 0,1 нг/мл и 1 нг/мл TGFβ1 соответственно. Максимальное увеличение метаболической активности клеток обеих линий наблюдали при воздействии TGFβ1 в концентрации 1 нг/мл, и оно было достоверно выше у Фб- hTERT (179 ± 12% и 135 ± 13% соответственно; p < 0,05). Дальнейшее увеличение концентрации ростового фактора в среде приводило к уменьшению метаболической активности клеток, по сравнению с воздействием 1 нг/мл TGFβ1. Исходя из полученных данных, для повышения профиброгенной активности клеток в дальнейшем использовали TGFβ1 в концентрации 1 нг/мл.
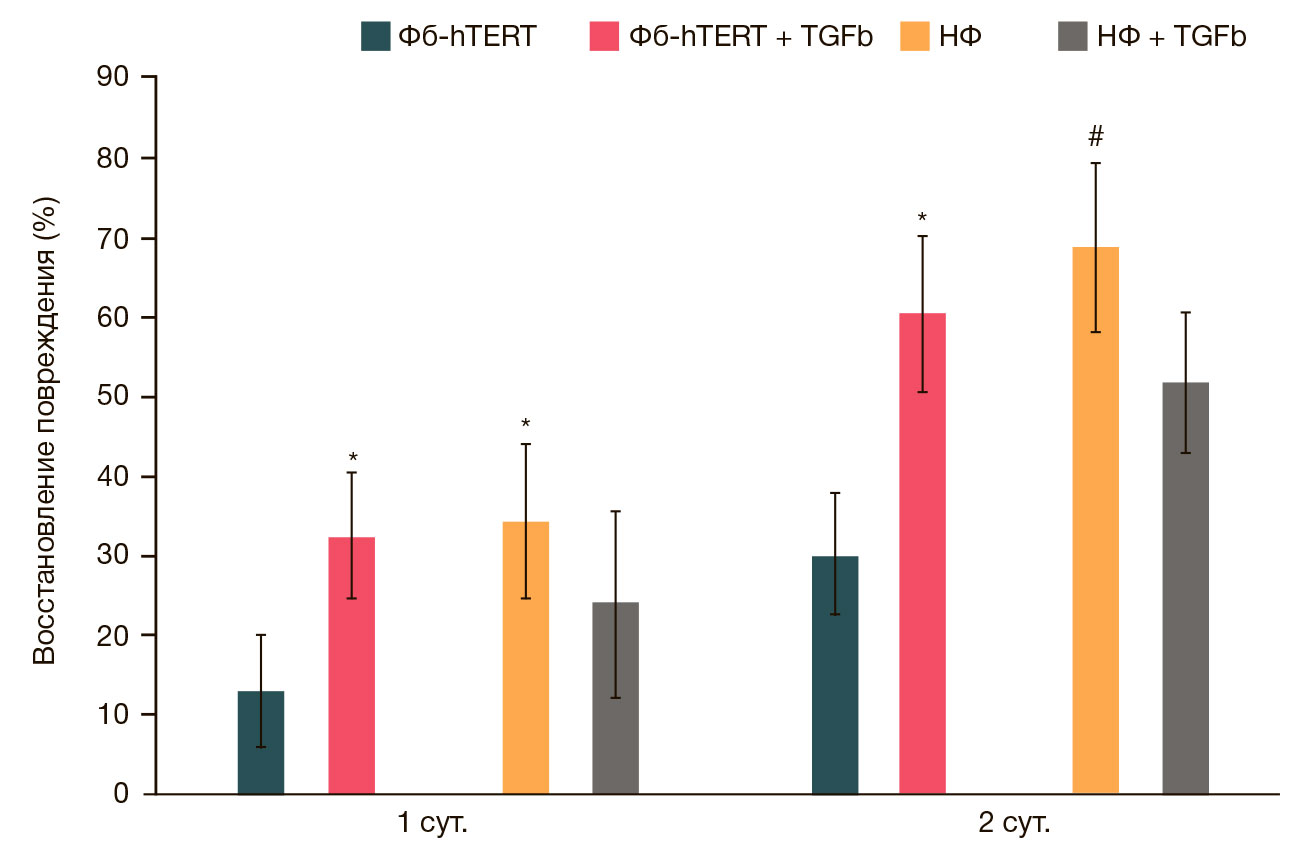
С помощью scratch-теста было продемонстрировано, что восстановление дефекта монослоя клеток НФ и Фб-hTERT, в том числе в условиях воздействия TGFβ1, различалось (рис. 2).
Величина данного показателя через 24 и 48 ч от начала исследования была достоверно выше у контрольных (без воздействия TGFβ1) клеток НФ, в сравнении с контрольными клетками Фб-hTERT. В то же время после добавления в среду культивируемых клеток TGFβ1 скорость зарастания дефекта монослоя у НФ на всем протяжении исследования не имела достоверных различий с контролем. В тех же условиях величина анализируемого показателя у Фб-hTERT достоверно превышала таковую у клеток контроля более чем в два раза как через 24 ч после начала исследования (33 ± 8% и 13 ± 7% соответственно), так и на вторые сутки наблюдения (61 ± 10% и 30 ± 7% соответственно). Таким образом, НФ в сравнении с Фб-hTERT быстрее восстанавливали дефект монослоя в интактном состоянии, а клетки Фб-hTERT, напротив, при стимуляции TGFβ1.
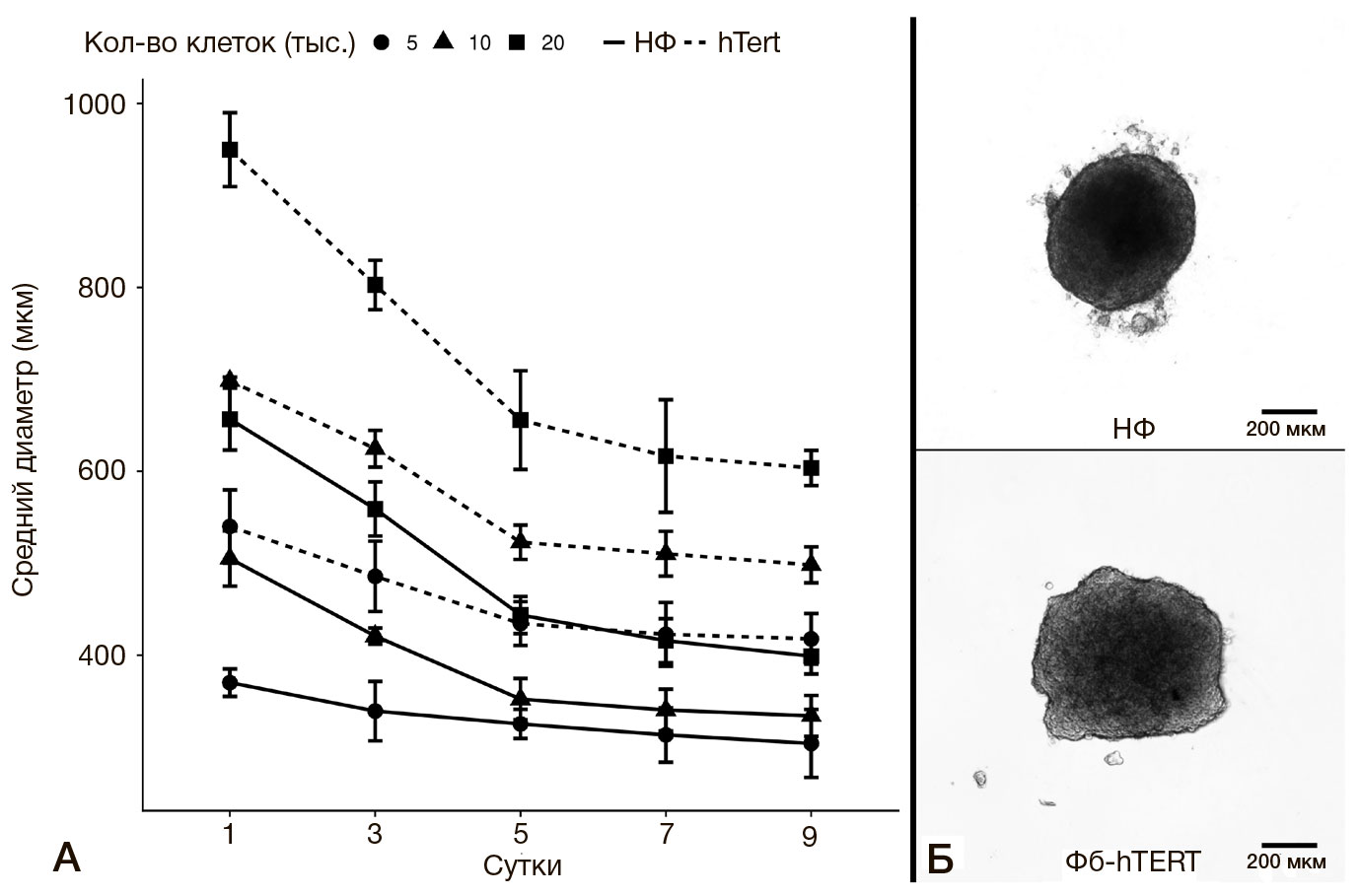
При культивировании клеток в виде клеточных сфероидов, сформированных из различного количества исследуемых клеток (5 тыс., 10 тыс. и 20 тыс.), было установлено, что во всех экспериментальных ситуациях размер сфероидов уменьшался в течение первых пяти суток культивирования, а затем оставался относительно стабильным (рис. 3А). Причем, чем больше было взято клеток для формирования сфероида, тем более выраженной была скорость уменьшения его размеров, что характерно как для НФ, так и для Фб-hTERT.
Размеры сфероидов из клеток Фб-hTERT превосходили размеры сфероидов из НФ примерно в два раза, несмотря на то что сами клетки Фб-hTERT меньше, чем НФ.
Для оценки влияния TGFβ1 на клетки НФ и Фб- hTERT, культивируемые в виде сфероидов, использовали клеточные образования, сформированные из 20 тыс. клеток — для НФ и 10 тыс. клеток — для Фб-hTERT (рис. 3Б).
Используемое число клеток позволяло получить сфероиды примерно сопоставимых размеров. Данный параметр важен для функционирования подобных клеточных образований, так как определяет интенсивность трофических процессов в краевых и центральных клетках, а также интенсивность гипоксии в центре сфероида.
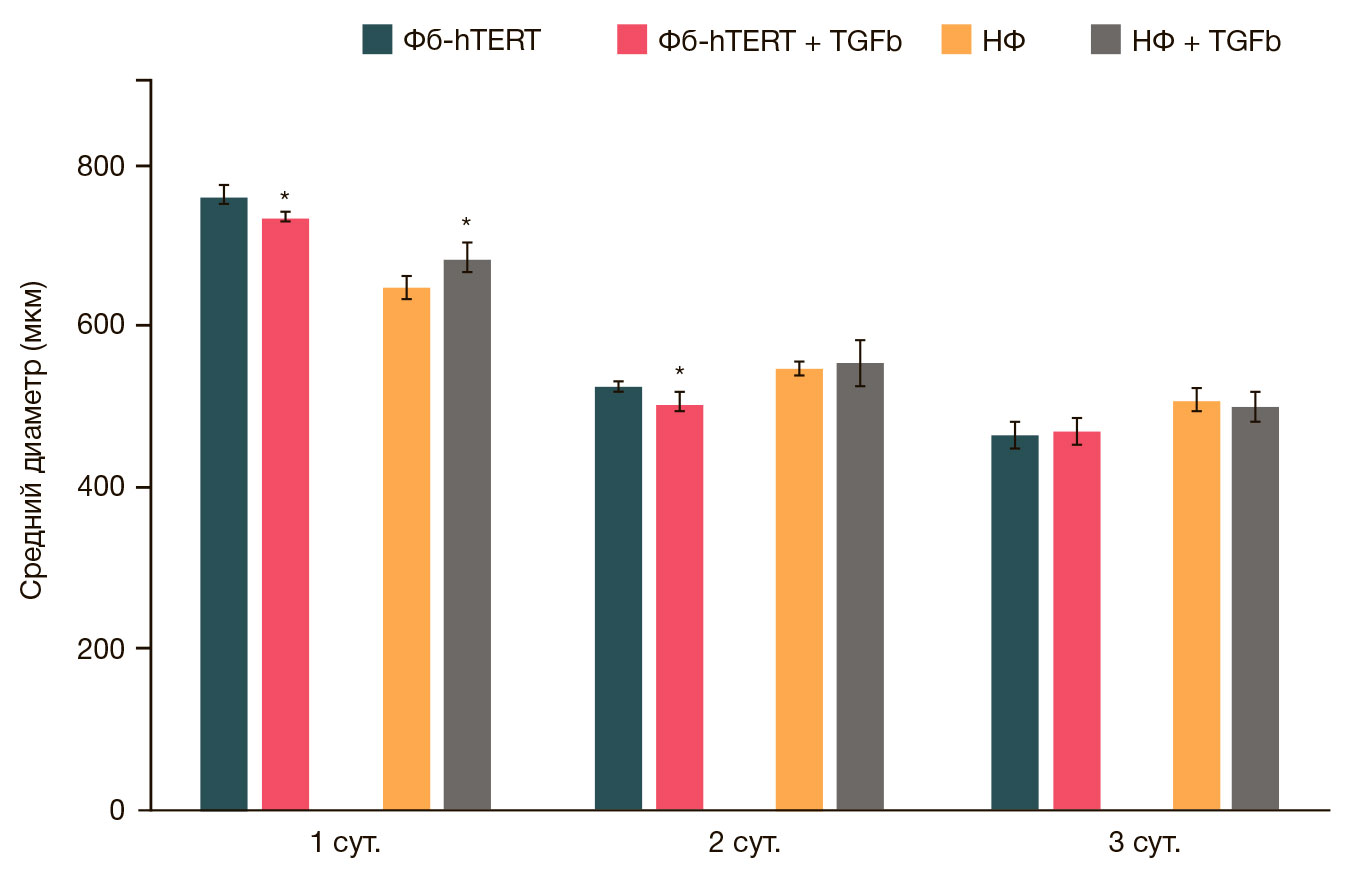
В условиях добавления в питательную среду TGFβ1 в концентрации 1 нг/мл через 24 ч было обнаружено достоверное увеличение размеров сфероидов, сформированных из НФ, в сравнении с размерами сфероидов контрольной группы, состоящих из клеток НФ (рис. 4). Затем данные различия уменьшались и исчезали к третьим суткам культивирования.
Сфероиды, полученные из Фб-hTERT, вели себя несколько иначе. В присутствии TGFβ1 их размер на первые и вторые сутки культивирования достоверно уменьшался по сравнению с контролем. К третьим суткам данные различия также нивелировались.
Отмеченные незначительные различия в динамике изменения размеров сфероидов из НФ и Фб-hTERT при воздействии TGFβ1 на ранних сроках культивирования можно объяснить фенотипическими особенностями клеток разных линий, а также их исходно разным числом в клеточном образовании. Однако следует отметить, что на третьи сутки культивирования по мере формирования и уплотнения сфероидов данные различия практически отсутствовали.
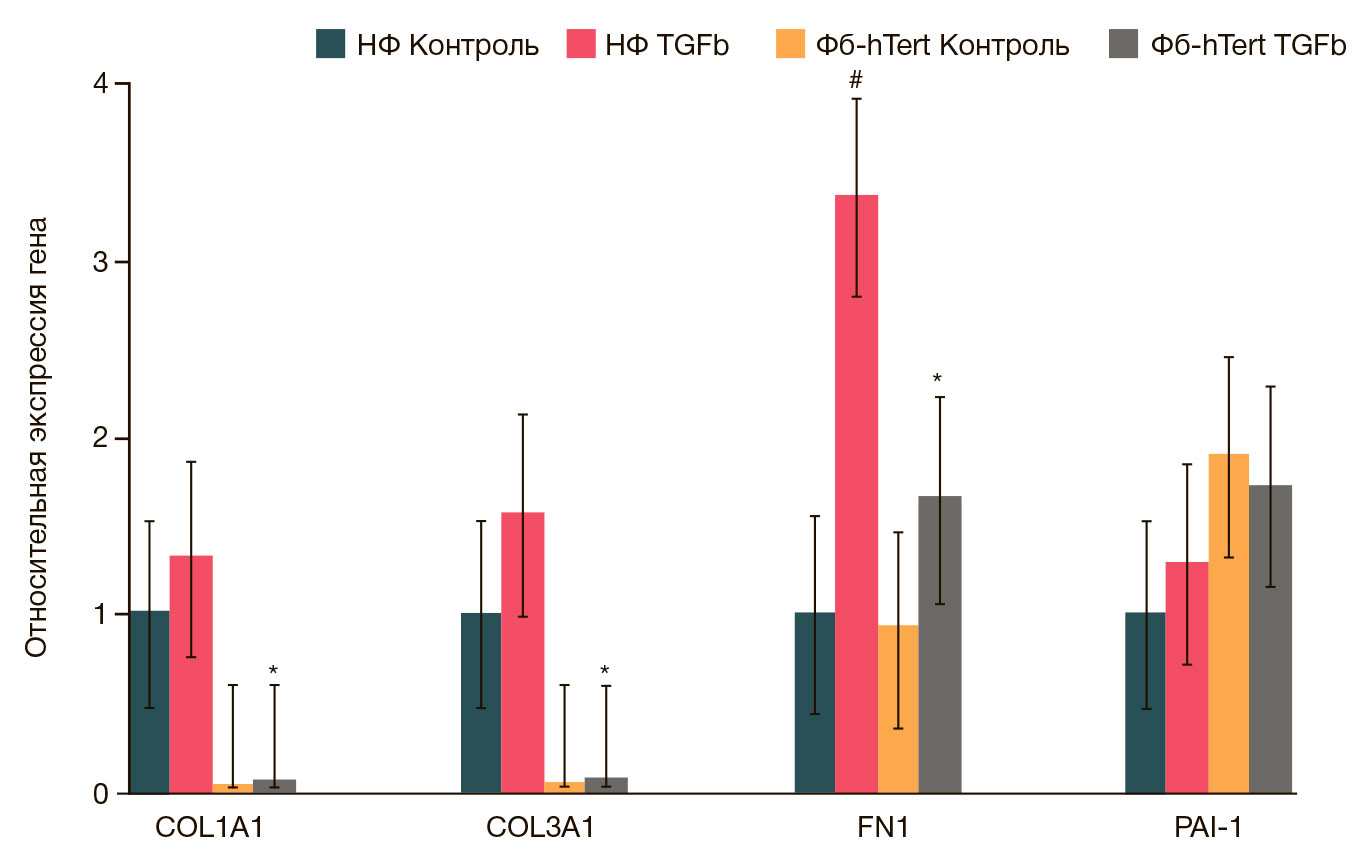
Клетки НФ и Фб-hTERT имели различия в экспрессии генов, ассоциированных с развитием гиперпластических процессов, как в интактном состоянии, так и при воздействии TGFβ1 (рис. 5).
В интактных НФ по сравнению с Фб-hTERT выявлена тенденция к повышению экспрессии генов, кодирующих синтез коллагенов I и III. В клетках Фб-hTERT, в свою очередь, несколько более активно экспрессировался PAI-1. Экспрессия гена, кодирующего синтез фибронектина, в клетках НФ и Фб-hTERT была сопоставимой.
При инкубации исследуемых клеток с TGFβ1 в концентрации 1 нг/мл в течение двух суток в клетках НФ по сравнению с контролем отмечена тенденция к увеличению экспрессии всех исследованных генов. Значимые различия выявлены для гена, кодирующего синтез фибронектина.
В то же время в клетках Фб-hTERT при воздействии TGFβ1 достоверное изменение экспрессии COL1A1, COL3A1, FN1, PAI-1 не обнаружено.
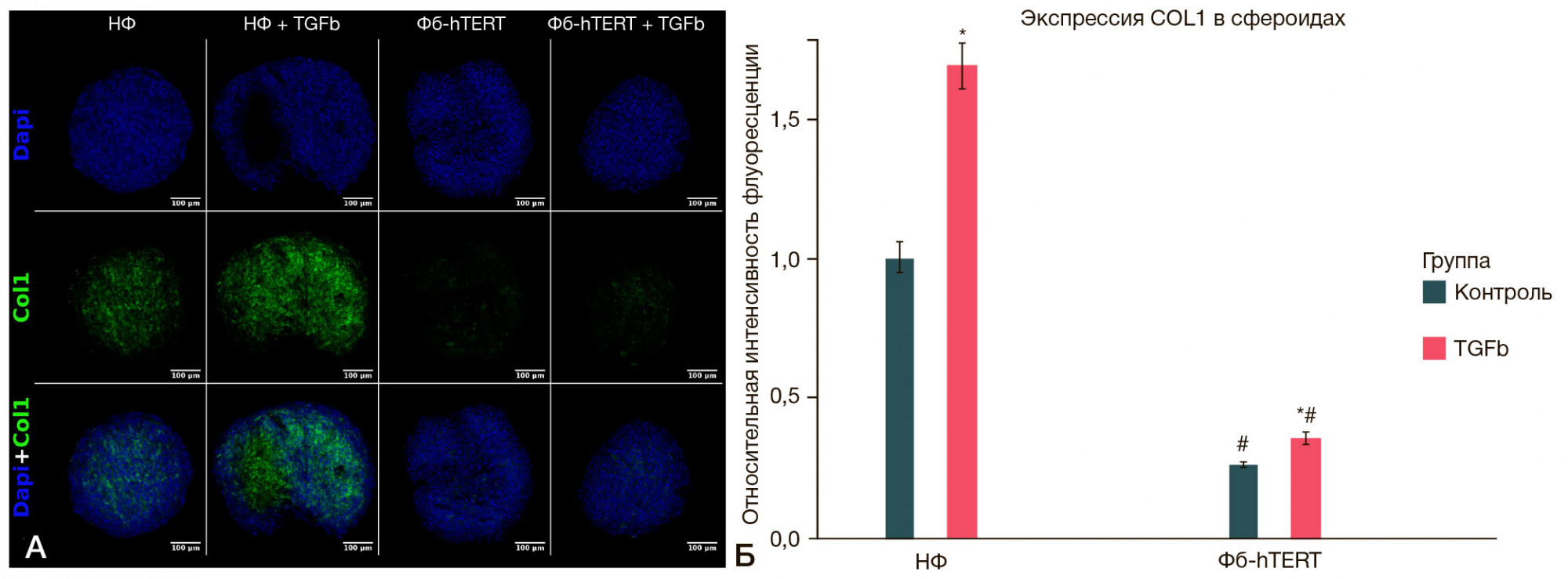
Отмеченные различия базовой и стимулированной TGFβ1 экспрессии коллагена I клетками НФ и Фб-hTERT сохранялись и при их культивировании в виде сфероидов (рис. 6А). По данным микроскопического исследования, уровень экспрессии коллагена в сфероидах, сформированных из НФ, был значительно выше, чем в сфероидах Фб-hTERT (рис. 6Б). При воздействии TGFβ1 в сфероидах, сформированных из НФ, наблюдалось выраженное увеличение продукции коллагена I в 1,7 раз, в то время как в сфероидах, полученных из Фб-hTERT, в тех же экспериментальных условиях увеличение экспрессии коллагена I было умеренным (в 1,4 раза).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведено сравнительное исследование нормальных и теламеризованных фибробластов кожи человека (НФ и Фб-hTERT соответственно) в аспекте возможности стимулирования их профиброгенного потенциала in vitro. Известно, что в фибробластах, выделенных из келоидных рубцов, происходит активация теломеразы [6]. По этому параметру келоидные фибробласты оказываются отчасти схожими с иммортализованными клетками, что определяет перспективность использования Фб-hTERT в качестве модельных клеток при разработке in vitro моделей патологических гиперпластических (келоидных и гипертрофических) рубцов. В то же время, по данным литературы, фенотип нормальных фибробластов может быть значительно приближен к таковому у клеток, выделенных из патологических рубцов, в результате использования ростовых факторов, играющих ключевое значение в патогенезе гиперпластических патологических процессов, в частности TGFβ1 [16]. Известно, что данный ростовой фактор активирует множество сигнальных каскадов, приводящих к увеличению пролиферации, адгезии и миграции клеток, продукции внеклеточного матрикса [17].
Как было отмечено ранее, для моделирования in vitro любой ткани, в том числе соединительной ткани в норме и при патологическом рубцевании, важно воспроизведение ее трехмерной структуры, позволяющее обеспечивать поведение клеток с учетом их межклеточного взаимодействия и взаимного влияния. В связи с этим исследованы фенотипические особенности НФ и Фб-hTERT при их культивировании в виде клеточных сфероидов. Эту модель активно используют для исследования канцерогенеза и экспериментальной оценки эффективности противораковой терапии, ввиду того что микроокружение, питание, газообмен и физиология клеток в сфероидах наиболее точно воспроизводят таковые в опухолях [18]. В то же время сфероиды ранее не использовали для создания клеточной модели патологического гиперпластического рубца, что определяет новизну полученных результатов.
В целом, интактные Фб-hTERT по сравнению с НФ имели ряд фенотипических признаков, характерных для иммортализованных клеток: более мелкие размеры, высокую скорость удвоения и формирования конфлюентного монослоя, что, по-видимому, обусловлено их высокой пролиферативной активностью. Эта особенность Фб-hTERT, вероятно, также определяет и более высокую по сравнению с НФ метаболическую активность клеток в покое и при воздействии TGFβ1 (данные МТТ-теста).
Метод МТТ позволяет оценить метаболическую или при некоторых допущениях пролиферативную активность клеток [19]. В настоящем исследовании показано дозозависимое влияние TGFβ1 на метаболическую активность НФ и Фб-hTERT, более выраженное для Фб- hTERT. Данное наблюдение согласуется с результатами других исследований, посвященных оценке влияния TGFβ1 на пролиферативную и метаболическую активность фибробластов [20, 21]. В целом наибольшее увеличение метаболической активности исследованных клеток было отмечено при воздействии TGFβ1 в концентрации 1 нг/мл, более выраженное — у Фб-hTERT.
Динамика изменения размеров сфероидов в процессе их культивирования, зарегистрированная в настоящем исследовании, согласуется с результатами других экспериментов [22, 23]. В них также отмечены резкое уменьшение размеров сфероидов в первые сутки культивирования и последующий постепенный переход на плато, что называют «созреванием» клеточного сфероида. Представляются также закономерными результаты о более резком уменьшении размеров сфероидов, для формирования которых использовали большее число клеток (максимальным этот показатель был для сфероидов, сформированных из 20 тыс. клеток), так как оптимальными, с точки зрения возможности обеспечения проникновения питательных веществ к клеткам сфероида и адекватного газообмена, считают диаметры сфероидов в диапазоне от 200–500 мкм [24].
Необходимо отметить, что сфероиды, сформированные из Фб-hTERT, были значительно крупнее сфероидов, полученных из НФ, несмотря на более крупные размеры данных клеток. Это может быть обусловлено более высокой пролиферативной активностью теламеризованных клеток. В то же время нельзя исключить, что сфероиды из Фб- hTERT имели сниженную способность к уплотнению (ретракции) за счет слабых межклеточных контактов.
Воздействие TGFβ1 приводило к уменьшению размеров сфероидов, сформированных из Фб-hTERT, а также увеличивало скорость заполнения дефекта монослоя (scratch-тест), более низкую у интактных Фб-hTERT, по сравнению с НФ. Возможно, наряду с увеличением пролиферативной активности в данной экспериментальной ситуации усиливалась способность клеток Фб-hTERT к адгезии и межклеточной кооперации. Однако данный вопрос требует дальнейшего изучения.
Важно отметить, что клетки Фб-hTERT имели и другие фенотипические отличия от нормальных дифференцированных фибробластов. Например, продукция основных специфических для данных клеток белков, используемых для формирования структур волокнистой соединительной ткани (коллаген I и III типов, фибронектин), была снижена, по сравнению с НФ как в интактных клетках, так и при стимуляции TGFβ1, в том числе при культивировании клеток в виде сфероидов (данные ПЦР-исследования, флуоресцентного окрашивания клеток в составе сфероидов). Так как данные клетки иммортализованы, по-видимому, в них наиболее активны программы пролиферации, а не дифференцировки. В связи с этим, как в исходных, так и в стимулированных клетках, наблюдается низкая экспрессия генов, связанных с продукцией коллагена (характерна для дифференцированных клеток соединительной ткани). В то же время НФ демонстрировали состоятельность этих программ, активность которых возрастала при воздействии TGFβ1.
Как известно, экспрессия генов, обеспечивающих синтез компонентов соединительной ткани, оказывается повышенной в клетках келоидных рубцов. Рядом исследователей показано повышение транскрипции и трансляции коллагена I и III типов, фибронектина в локусах гиперпластических процессов [2]. Повышенным уровнем экспрессии гена ингибитора активатора плазминогена PAI-1, не характерным для нормальных фибробластов, объясняют увеличение количества коллагена в келоидах [25]. Примечательно, что в нашем исследовании экспрессия гена PAI-1 у интактных клеток Фб-hTERT была выше, чем у НФ.
Кроме того, интактные НФ более активно, по сравнению с Фб-hTERT, восстанавливали дефект монослоя (scratch- тест). Данный методический подход используют для косвенной оценки регенераторного потенциала клеток (способности восстанавливать дефект). При этом скорость заполнения дефекта клетками обусловлена увеличением их пролиферации и/или миграционной активности. Известно, что TGFβ1 способствует заживлению ран [17]. В наших экспериментах воздействие TGFβ1 приводило к увеличению скорости заполнения дефекта клетками Фб- hTERT, но не НФ. Для оценки данного результата необходим дальнейший анализ влияния TGFβ1 в клетках Фб-hTERT и НФ на клеточные программы адгезии и межклеточной кооперации, участвующие в реализации способности клеток к миграции.
ВЫВОДЫ
Теломеризованные фибробласты имеют ряд фенотипических признаков, характерных для келоидных фибробластов: высокую пролиферативную и метаболическую активность; способность по сравнению с НФ восстанавливать дефект монослоя (scratch-тест) под воздействием TGFβ1; повышенный по сравнению с НФ уровень экспрессии гена PAI-1 (на уровне тенденции, статистически незначимо). Важны их способность к неограниченному числу делений, фенотипическая однородность клеток различных пассажей, способность образовывать клеточные сфероиды, что определяет перспективность использования данных клеток при 3D-моделировании патологических гиперпластических рубцов. Однако в данных клетках снижена экспрессия белков, ассоциированных с продукцией компонентов внеклеточного матрикса (COL1A1, COL3A1, FN1), в том числе и при воздействии TGFβ1. В то время как для келоидных фибробластов характерна гиперпродукция данных белков. Данное обстоятельство следует учитывать при использовании Фб-hTERT для моделирования патологических гипертрофических рубцов. Целесообразны дальнейшие исследования для оценки возможности и условий активации экспрессии белков внеклеточного матрикса в данных клетках.
- Jumper N, Paus R, Bayat A. Functional histopathology of keloid disease. Histology and histopathology. 2015; 30 (9): 1033–57.
- Sidgwick GP, Bayat A. Extracellular matrix molecules implicated in hypertrophic and keloid scarring. Journal of the European Academy of Dermatology and Venereology. 2012; 26 (2): 141–152.
- Liang CJ, Yen YH, Hung LY, Wang SH, Pu CM, Chien HF, et al. Thalidomide inhibits fibronectin production in TGF-β1-treated normal and keloid fibroblasts via inhibition of the p38/Smad3 pathway. Biochemical pharmacology. 2013; 85 (11): 1594–02.
- De Felice B, Wilson RR, Nacca M. Telomere shortening may be associated with human keloids. BMC medical genetics. 2009; 10 (1): 110.
- Huang Y, Lin LX, Bi QX, Wang P, Wang XM, Liu J, et al. Effects of hTERT antisense oligodeoxynucleotide on cell apoptosis and expression of hTERT and bcl-2 mRNA in keloid fibroblasts. European Review for Medical and Pharmacological Sciences. 2017; 21 (8): 1944–51.
- Yu D, Shang Y, Yuan J, Ding S, Luo S, Hao L. Wnt/β-catenin signaling exacerbates keloid cell proliferation by regulating telomerase. Cellular Physiology and Biochemistry. 2016; 39 (5): 2001–13.
- Kischer CW, Thies AC, Chvapil M. Perivascular myofibroblasts and microvascular occlusion in hypertrophic scars and keloids. Human pathology. 1982; 13 (9): 819–24.
- Bran GM, Goessler UR, Hormann K, Riedel F, Sadick H. Keloids: current concepts of pathogenesis. International journal of molecular medicine. 2009; 24 (3): 283–93
- Chin D, Boyle GM, Parsons PG, Coman WB. What is transforming growth factor-beta (TGF-β)?. British journal of plastic surgery. 2004; 57 (3): 215–21.
- Yang GP, Lim IJ, Phan TT, Lorenz HP, Longaker MT. From scarless fetal wounds to keloids: molecular studies in wound healing. Wound repair and regeneration. 2003; 11 (6): 411–8.
- Jagadeesan J, Bayat A. Transforming growth factor beta (TGFβ) and keloid disease. International journal of surgery. 2007; 5 (4): 278–85.
- Egorov EE, Terekhov SM, Vishniakova K, Karachentsev DN, Kazimirchuk EV, Tsvetkova TG, et al. Telomerization as a method of obtaining immortal human cells preserving normal properties. Ontogenez. 2003; 34 (3): 183.
- Kupcsik L. Estimation of cell number based on metabolic activity: the MTT reduction assay. In Mammalian cell viability. Humana Press. 2011: 13–19.
- Schindelin J, Arganda-Carreras I, Frise E, Kaynig V, Longair M, Pietzsch T, et al. Fiji: an open-source platform for biological-image analysis. Nature methods. 2012; 9 (7): 676–82.
- Carpenter AE, Jones TR., Lamprecht MR, Clarke C, Kang IH, Friman O, et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome biology. 2006; 7 (10): R100.
- Lee TY, Chin GS, Kim W, Chau D, Gittes GK, Longaker MT. Expression of transforming growth factor beta 1, 2, and 3 proteins in keloids. Annals of plastic surgery. 1999; 43 (2): 179–84.
- Klass BR, Grobbelaar AO, Rolfe KJ. Transforming growth factor β1 signalling, wound healing and repair: a multifunctional cytokine with clinical implications for wound repair, a delicate balance. Postgraduate Medical Journal. 2009; 85 (999): 9–14.
- Friedrich J, Ebner R, Kunz-Schughart LA. Experimental anti-tumor therapy in 3-D: spheroids–old hat or new challenge? International journal of radiation biology. 2007; 83 (11–12): 849–71.
- Ohno M, Abe T. Rapid colorimetric assay for the quantification of leukemia inhibitory factor (LIF) and interleukin-6 (IL-6). Journal of immunological methods. 1991; 145 (1–2): 199–203.
- Meran S, Thomas DW, Stephens P, Enoch S, Martin J, Steadman R, et al. Hyaluronan facilitates transforming growth factor-β1-mediated fibroblast proliferation. Journal of Biological Chemistry. 2008; 283 (10): 6530–45.
- Negreros M, Hagood JS, Espinoza CR, Balderas-Martínez YI, Selman M, Pardo A. Transforming growth factor beta 1 induces methylation changes in lung fibroblasts. PloS one. 2019; 14 (10): e0223512.
- Takezawa T, Mori Y, Yonaha T, Yoshizato K. Characterization of morphology and cellular metabolism during the spheroid formation by fibroblasts. Experimental cell research. 1993; 208 (2): 430–41.
- Frandsen SK, Gibot L, Madi M, Gehl J, Rols MP. Calcium electroporation: evidence for differential effects in normal and malignant cell lines, evaluated in a 3D spheroid model. PLoS One. 2015; 10 (12): e0144028.
- Mittler F, Obeïd P, Rulina AV, Haguet V, Gidrol X, Balakirev MY. High-content monitoring of drug effects in a 3D spheroid model. Frontiers in oncology. 2017; 7: 293.
- Tuan TL, Wu H, Huang EY, Chong SS, Laug W, Messadi D, et al. Increased plasminogen activator inhibitor-1 in keloid fibroblasts may account for their elevated collagen accumulation in fibrin gel cultures. The American journal of pathology. 2003; 162 (5): 1579–89.