ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Полиморфизм гена CDKN2B-AS1 ассоциирован с первичной открытоугольной глаукомой у женщин Центрального Черноземья России
Белгородский государственный национальный исследовательский университет, Белгород, Россия
Первичная открытоугольная глаукома (ПОУГ) — это многофакторное заболевание, в развитии которого значимую роль играют наследственные факторы. Распространенность ПОУГ имеет гендерные особенности — заболевание чаще выявляют у женщин. Результаты полногеномных исследований (GWAS) свидетельствуют в пользу ассоциации полиморфизма гена CDKN2B-AS1 с ПОУГ. Целью исследования было репликативное изучение ассоциаций полиморфных локусов гена CDKN2B-AS1 с ПОУГ у женщин Центрального Черноземья России. У 290 пациенток с ПОУГ и 220 женщин контрольной группы было выполнено генотипирование пяти однонуклеотидных полиморфизмов (SNP) гена CDKN2B-AS1 — rs1063192, rs7865618, rs2157719, rs944800 и rs4977756. При использовании алгоритма «Solid Spine» (заданный порог D’ > 0,8) были выявлены различия в структуре блоков сцепления по исследуемым пяти SNP гена CDKN2B-AS1 между больными ПОУГ (блоки сцепления отсутствовали) и контролем (установлен блок сцепления, состоящий из трех SNP — rs1063192, rs7865618 и rs2157719). У женщин гаплотип GGG rs1063192–rs7865618–rs2157719 гена CDKN2B-AS1 ассоциирован с ПОУГ — он является протективным фактором развития заболевания (ОШ = 0,66; p = 0,006, рperm = 0,037).
Ключевые слова: полиморфизм, женщины, первичная открытоугольная глаукома, CDKN2B-AS1, ассоциации
Вклад авторов: Н. В. Елисеева — формирование выборки, молекулярно-генетические исследования, подготовка рукописи; И. В. Пономаренко — молекулярно-генетические исследования, статистическая обработка данных, подготовка рукописи; М. И. Чурносов — концепция исследования, редактирование рукописи; все авторы прочли и одобрили окончательный вариант рукописи.
Соблюдение этических стандартов: исследование одобрено этическим комитетом медицинского института Белгородского государственного национального исследовательского университета (протокол № 4 от 19 мая 2015 г.); все участники подписали добровольное информированное согласие на участие в исследовании.
Для корреспонденции: Михаил Иванович Чурносов
ул. Победы, д. 85, г. Белгород, 308015; ur.ude.usb@vosonruhc
Глаукома — это заболевание, характеризующееся хронической прогрессирующей оптической нейропатией, при котором имеют место не связанные с другими глазными заболеваниями или врожденными аномалиями морфологические изменения в головке зрительного нерва, а также в нервных волокнах сетчатки [1]. Одной из самых распространенных форм глаукомы является
первичная открытоугольная глаукома (ПОУГ) [2]. О медикосоциальной значимости глаукомы свидетельствуют данные о неуклонном и стабильном росте заболеваемости, хроническом течении болезни с прогрессированием нарушений зрительных функций, в конечном итоге приводящим к потере работоспособности и инвалидизации [1]. Следует отметить, что в подавляющем большинстве случаев ПОУГ диагностируют у пациентов в возрасте от 60 до 69 лет, нередко при наличии системных сопутствующих заболеваний. Заболевание почти в 1,5 раза чаще регистрируют у женщин [1–3].
В развитии ПОУГ значимую роль играют наследственные факторы [4]. Полученные к настоящему моменту молекулярно-генетические данные указывают на то, что в развитие ПОУГ вовлечены полиморфизмы ряда генов-кандидатов [4–6]. Несколько полногеномных исследований (GWAS) ПОУГ выявили ассоциации полиморфных локусов гена CDKN2B-AS1 с развитием заболевания [7–12].
Ген CDKN2B-AS1 расположен в кластере генов CDKN2B и CDKN2A на хромосоме 9p21. Он относится к группе генов, контролирующих образование длинных некодирующих РНК (lncRNAs) [13]. Кодируемая им lncRNA осуществляет взаимодействие с Polycombрепрессивными комплексами 1 (PRC1) и 2 (PRC2), что обусловливает значительные эпигенетические изменения (процессы метилирования и моноубиквитинирования гистоновых белков хроматина и т. д.). Это, в свою очередь, приводит к существенным изменениям структуры хроматина и непосредственно влияет на экспрессию генов [13]. Следует отметить, что полученные для ПОУГ данные GWAS требуют проведения репликативных исследований в разных популяциях, для которых подобные исследования не были проведены к настоящему моменту — в том числе среди населения России.
Целью настоящей работы было исследовать ассоциации однонуклеотидного полиморфизма (SNP) гена CDKN2B-AS1 с ПОУГ у женщин Центрального Черноземья России.
ПАЦИЕНТЫ И МЕТОДЫ
В выборку были включены 290 пациенток с ПОУГ и 220 женщин контрольной группы. Критерии включения: русская национальность, место рождения и проживания — Центрально-Черноземный регион России [14]. Критерии исключения: не русская национальность, место рождения и/или проживания — вне Центрально-Черноземного региона России.
В группу больных были включены индивидуумы с диагнозом ПОУГ, который был верифицирован в результате клинического и клинико-инструментального обследования пациентов. Диагностику ПОУГ осуществляли по следующим критериям [6]: высокое внутриглазное давление (ВГД выше 21 при пневмотонометрии и выше 25 при тонометрии по Маклакову), глаукоматозная экскавация диска зрительного нерва, характерные изменения периферического поля зрения. В контрольную группу включали индивидуумов, не имеющих ПОУГ (ВГД ниже 21 при пневмотонометрии и ниже 25 при тонометрии по Маклакову, отсутствие глаукоматозной экскавации диска зрительного нерва и характерных изменений периферического поля зрения), других заболеваний глаз и тяжелой сопутствующей соматической патологии, сопровождающейся поражением глаз.
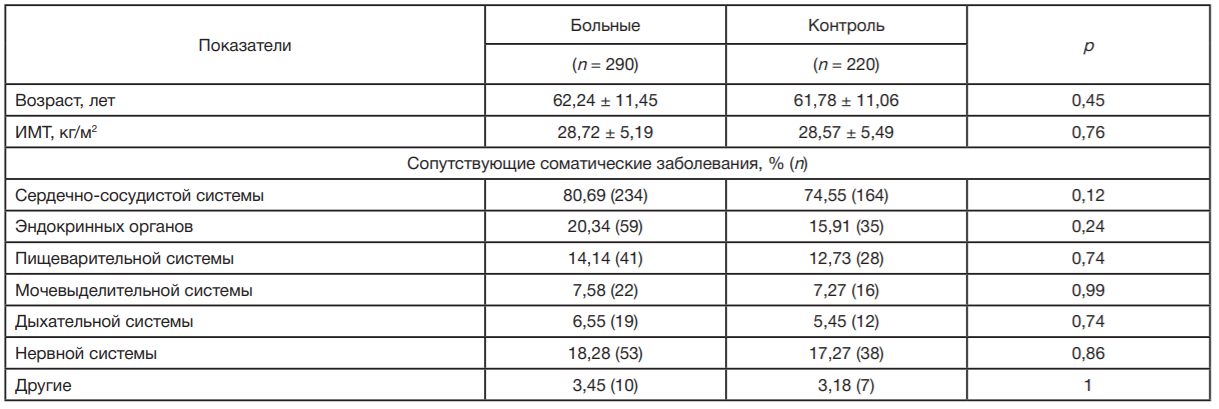
Возраст и индекс массы тела (ИМТ) больных ПОУГ и контрольной группы, а также встречаемость сопутствующей соматической патологии в группах были сопоставимыми (р > 0,05) (табл. 1). Офтальмологическое обследование проводили в профильном отделении Белгородской областной клинической больницы святителя Иоасафа.
Обьектом генетического исследования была геномная ДНК, полученная из периферической венозной крови фенол-хлороформным методом [15]. Однонуклеотидный полиморфизм гена CDKN2B-AS1 был отобран для исследования на основании следующих критериев [16]: 1) ассоциации с ПОУГ по данным ранее проведенных полногеномных исследований; 2) значимый регуляторный потенциал; 3) распространенность минорного аллеля 5% и более.
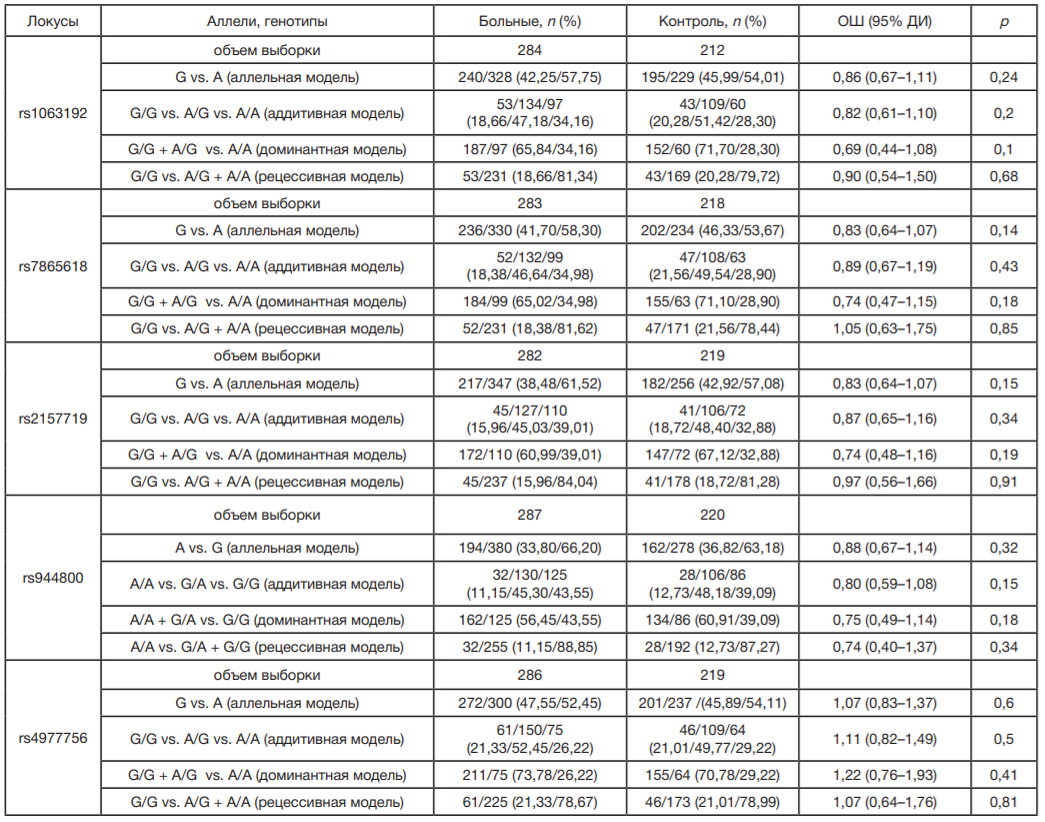
Отбор SNP для исследования проводили с помощью каталога GWAS [17] и базы данных HaploReg [18]. В соответствии с обозначенными выше критериями в исследование были включены пять SNP гена CDKN2BAS1 — rs1063192, rs7865618, rs2157719, rs944800 и rs4977756. Все пять SNP имели ассоциации с ПОУГ по данным ранее выполненных GWAS [7–12], характеризовались значимым регуляторным потенциалом (rs7865618, rs2157719, rs944800 находятся в регионе модифицированных гистоновых белков, маркирующих энхансеры; rs1063192, rs2157719, rs944800, rs4977756 расположены в участках повышенной чувствительности к ДНКазе 1; rs1063192, rs2157719, rs944800 локализованы в области регуляторных мотивов ДНК к различным факторам транскрипции), а частота их минорных аллелей превышала 5%.
Генотипирование образцов ДНК было выполнено на амплификаторе Real-Time CFX96 (Bio-Rad; США) методом TaqMan зондов с использованием специально разработанных коммерческих наборов («ТестГен»; Россия).
Изучение ассоциаций полиморфных локусов с ПОУГ проводили методом логистической регрессии в рамках аллельной (для полиморфизмов rs1063192, rs7865618, rs2157719, rs4977756 рассматривали аллели G vs. A при минорном аллеле G; для локуса rs944800 — A vs. G при минорном аллеле А), доминантной (для полиморфизмов rs1063192, rs7865618, rs2157719, rs4977756 — G/G + A/G vs. A/A; для rs944800 — A/A + G/A vs. G/G), аддитивной (G/G vs. A/G (G/A) vs. A/A) и рецессивной (для полиморфизмов rs1063192, rs7865618, rs2157719, rs4977756 — G/G vs. A/G + A/A; для rs944800 — A/A vs. G/A + G/G) генетических моделей в программе plink 1.06 [19] с коррекцией на ковариату — возраст. Оценку характера ассоциации выполняли с использованием показателя отношения шансов (ОШ) и его 95%-го доверительного интервала (95% ДИ). Для коррекции на множественные сравнения использовали адаптивный пермутационный тест. Статистически значимым считали рperm < 0,05.
Для оценки неравновесия по сцеплению и определения блоков сцепления пяти SNP гена CDKN2B-
AS1 использовали коэффициент D’ Левонтина и коэффициент корреляции r2 Пирсона. Анализ блоков сцепления проводили в программе Haploview v.4.2 [20] с помощью алгоритма «Solid Spine» при заданном пороге D’>0,8. Визуализацию неравновесия по сцеплению между изучаемыми SNP гена CDKN2B-AS1 выполняли в программном обеспечении Haploview v.4.2. Частоты гаплотипов определяли с помощью EM-алгоритма. Для оценки ассоциаций гаплотипов с ПОУГ использовали метод логистической регрессии (программа plink 1.06) с включением в анализ ковариаты (возраст) и коррекцией на множественные сравнения (выполняли пермутационный тест — проводили 1000 пермутаций). Оценку характера ассоциации гаплотипов с заболеванием осуществляли с использованием показателя отношения шансов (ОШ). Статистически значимым считали ррerm < 0,05 [21].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
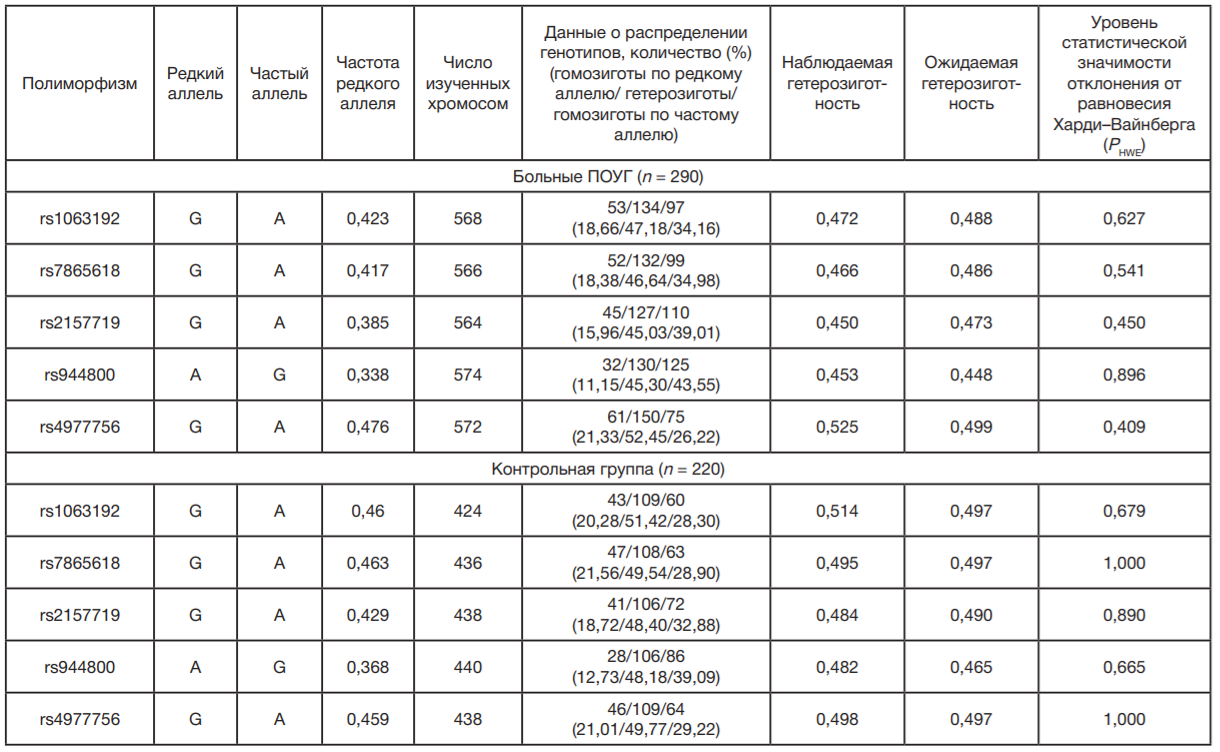
Популяционно-генетический анализ показал, что для распределения генотипов по всем пяти SNPs гена CDKN2BAS1 в группе больных ПОУГ и в контроле выполняется равновесие Харди–Вайнберга (pHWE > 0,05) (табл. 2). Значимых ассоциаций рассматриваемых полиморфных локусов гена CDKN2B-AS1 с ПОУГ у женщин выявлено не было (табл. 3).
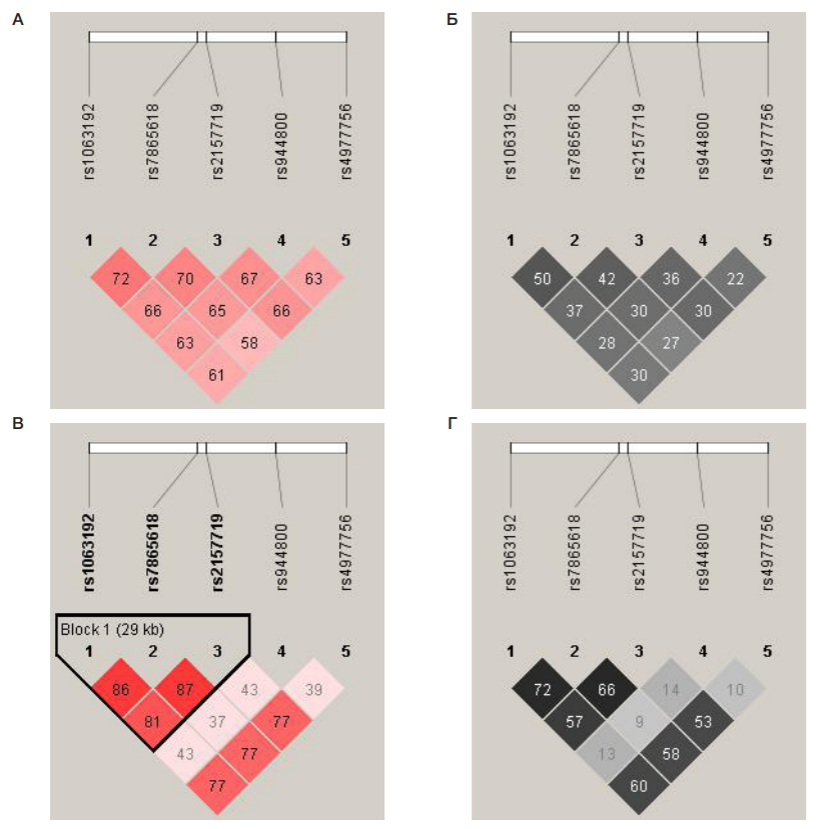
Анализ неравновесия по сцеплению по исследуемым пяти полиморфизмам гена CDKN2B-AS1 при использовании алгоритма «Solid Spine» (заданный порог D’>0,8) не выявил блоков сцепления у женщин, больных ПОУГ, при этом у женщин контрольной группы был выявлен блок сцепления, включающий три полиморфизма — rs1063192, rs7865618 и rs2157719 (см. рисунок.). Наряду с этим представленные на рисунке материалы указывают на наличие в контрольной группе «горячей точки» рекомбинации между локусами rs2157719 и rs944800 при очень низком уровне сцепления между rs944800 и rs4977756, а также выраженном сцеплении между локусом rs4977756 и тремя полиморфизмами (rs1063192, rs7865618 и rs2157719). При этом, если в группе контроля имеется зона с показателями D’ около 0,4 (см. выше), то среди больных показатель D’ для всех рассматриваемых полиморфизмов составляет около 0,6–0,7.
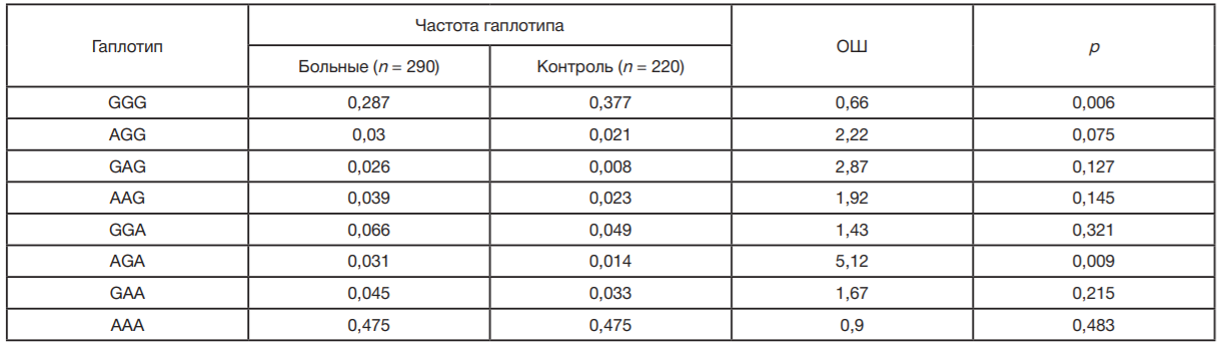
Установлена ассоциация гаплотипа GGG в рамках выявленного блока сцепления rs1063192–rs7865618– rs2157719 гена CDKN2B-AS1 с ПОУГ у женщин. Рассчитанный для данного гаплотипа показатель ОШ составляет 0,66 (при p = 0,006 и рperm = 0,037), что свидетельствует о протективном значении гаплотипа в отношении развития заболевания у женщин (табл. 4). Связь гаплотипа AGA с ПОУГ (ОШ = 5,12, p = 0,009) по результатам пермутационного теста не достигала статистически значимого уровня (рperm = 0,06).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При cравнительном анализе пациенток с ПОУГ и женщин из контрольной группы по пяти SNP гена CDKN2B-AS1 установлены различия в неравновесии по сцеплению между рассматриваемыми локусами (низкий уровень сцепления между отдельными локусами в контрольной группе при D’ около 0,4 и практически «равномерном» сцеплении всех рассматриваемых локусов в группе больных при D’ около 0,6–0,7) и связанные с этим различия в структуре блоков сцепления (при использовании алгоритма «Solid Spine» и пороге D’ > 0,8 у больных ПОУГ блоки сцепления отсутствовали, при этом у женщин из контрольной группы установлен блок сцепления, состоящий из трех SNP — rs1063192, rs7865618 и rs2157719). Показана ассоциация гаплотипа GGG rs1063192–rs7865618– rs2157719 гена CDKN2B-AS1 с ПОУГ у женщин (ОШ = 0,66) и отсутствие значимых самостоятельных ассоциаций пяти анализируемых SNP гена CDKN2B-AS1 с заболеванием.
Считается, что характер неравновесия по сцеплению в современных популяциях является результатом эволюционного процесса, отражающего как демографическую историю популяции (миграционные процессы, формирование определенной подразделенности и др.), так и ген-специфические факторы, связанные с частотой мутационного процесса и рекомбинаций, отбором и др. [22]. Несмотря на то что использование структуры LD при изучении многофакторных заболеваний человека ограничено популяционной специфичностью [22], считается, что использование в ассоциативных исследованиях гаплотипов, а не отдельных SNP позволяет существенно повысить статистическую мощность проводимого исследования, особенно в тех случаях, когда предрасполагающие к болезни локусы не анализируют непосредственно, или при наличии высокой степени мультилокусного неравновесия по сцеплению [22, 23]. Непосредственное влияние на эффективность гаплотипических тестов оказывают генетическая дистанция между изучаемыми локусами и «причинной» мутацией, а также частоты аллелей и возраст «причинной» мутации [22].
Несмотря на то что в хромосомном регионе изученных в нашей работе SNP гена CDKN2B-AS1 к настоящему моменту не было выявлено «очевидных» «причинных» в отношении ПОУГ мутаций (например, нонсенс-мутаций или мутаций, связанных с заменой аминокислот), в ряде работ показано важное функциональное значение полиморфных локусов этого региона (влияние на экспрессию генов CDKN2A, CDKN2B и др.) [8, 12].
Выявленные нами особенности неравновесия по сцеплению и связанные с этим особенности в выделении блока сцепления среди рассматриваемых пяти SNP гена CDKN2B-AS1 в контрольной группе могут быть лишь «частной» картиной структуры гаплотипов в «локальном масштабе» этих пяти локусов. При увеличении количества анализируемых локусов «общая картина» неравновесия по сцеплению между множеством локусов данного региона хромосомы может значительно измениться (могут быть выявлены «горячие точки» рекомбинации между отдельными локусами и в группе больных, участки более выраженного сцепления в контрольной группе и др.), и в целом в «масштабе» значительно большего количества рассматриваемых локусов (нежели рассмотренные нами пять SNP) характер структуры LD в группе пациенток с ПОУГ и в контрольной группе будет иметь схожие черты. Так, например, в работе [24] при изучении неравновесия по сцеплению и блоков сцепления (авторы использовали алгоритм «Solid Spine» с заданным порогом D' ≥ 0,75) между 12 SNP гена MTHFR у больных коронарным атеросклерозом, и в контрольной группе было выявлено три блока сцепления у больных и два блока сцепления в контроле. Кроме того, было показано более выраженное сцепление в 5'-области гена MTHFR у больных в сравнении с контролем. Несмотря на перечисленные выше отдельные отличающиеся «детали», анализируя «общую картину» неравновесия по сцеплению между 12 SNP гена MTHFR, авторы делают вывод о сходстве структуры LD в группе пациентов с коронарным атеросклерозом и в контрольной группе (есть схожие «горячие точки» рекомбинации, выявлен схожий блок сцепления 3'-области гена MTHFR).
Следует отметить, что полученные нами результаты по характеру ассоциаций (рисковое или протективное значение) отдельных аллелей в составе гаплотипа с глаукомой (гаплотип GGG rs1063192–rs7865618–rs2157719 гена CDKN2B-AS1 является протективным фактором развития ПОУГ у женщин, ОШ = 0,66) согласуются с имеющимися литературными данными по этой теме. Согласно данным полногеномного исследования [25], у европейского населения минорный аллель G rs1063192 ассоциирован с меньшим вертикальным размером диска зрительного нерва (β = –0,014 мм2; p = 6 x 10–11) (увеличение вертикального размера диска зрительного нерва является одним из признаков глаукоматозной нейропатии [26]), а, согласно данным GWAS [9] (получены в популяции Японии), минорный аллель G rs1063192 также имеет протективное значение в отношении развития ПОУГ (ОШ = 0,75, p = 5 x 10–11). Низкий риск развития открытоугольной глаукомы у индивидуумов (население Европы), имеющих в генотипе аллель G rs1063192 (как гомозиготы, ОШ = 0,76, так и гетерозиготы, ОШ = 0,85), обнаружен и в исследовании [7]. Ассоциации аллеля G rs1063192 с меньшим вертикальным размером диска зрительного нерва и его протективное значение в отношении развития ПОУГ в европейской популяции (ОШ = 0,73) показаны в работе [26]. Протективный характер ассоциации аллеля G rs1063192 как в отношении развития ПОУГ, так и в отношении формирования других разновидностей глаукомы в европейских и азиатских популяциях, также подтвержден результатами метаанализа [28]. Таким образом, наши результаты, свидетельствующие в пользу протективной роли аллеля G rs1063192 гена CDKN2BAS1 (в составе гаплотипа GGG гаплоблока rs1063192– rs7865618–rs2157719) при формировании заболевания у женщин Центрального Черноземья России (ОШ = 0,66), согласуются с данными проведенных ранее исследований.
Для аллеля G rs7865618 гена CDKN2B-AS1, который, по данным настоящего исследования, в составе гаплотипа GGG гаплоблока rs1063192–rs7865618– rs2157719 является протективным фактором в отношении развития ПОУГ у женщин европейской части России (ОШ = 0,66), в более ранних исследованиях были получены следующие результаты. Согласно данным GWAS [8], аллель А rs7865618 повышает риск развития ПОУГ в японской популяции (ОШ = 1,56; p = 2 x 10–9); по данным полногеномных исследований [29, 30], аллель G rs7865618 гена CDKN2B-AS1 ассоциирован с меньшим вертикальным размером диска зрительного нерва (β = –0,013; p = 3 x 10–20 для европейского населения) [29] и меньшей площадью экскавации (β = –0,023; p = 1 x 10–21 суммарно для европейской и азиатской популяции) [30]. Таким образом, следует отметить, что наши результаты и полученные ранее литературные данные о протективной роли аллеля G rs7865618 гена CDKN2B-AS1 в отношении формирования ПОУГ и патогенетически значимых для ПОУГ признаков (вертикальный размер диска зрительного нерва, площадь экскавации) согласуются между собой.
Согласно литературным данным, аллель G rs2157719 гена CDKN2B-AS1 ассоциирован с низким риском развития ПОУГ в популяциях различного этнического состава (в азиатской популяции, у европейцев, афроамериканцев) [11, 12] и связан с меньшим вертикальным размером диска зрительного нерва (β = –0,013; p = 4 x 10–35 суммарно для европейской и азиатской популяции) [30]. Эти данные согласуются с полученными нами результатами — аллель G rs2157719 в составе гаплотипа GGG гаплоблока rs1063192–rs7865618–rs2157719 является протективным фактором в отношении развития ПОУГ у женщин европейской части России (ОШ = 0,66).
Несмотря на то что в ряде GWAS были показаны значимые ассоциации SNP гена CDKN2B с глаукомой и связанными с глаукомой эндофенотипами (вертикальный размер диска зрительного нерва, площадь экскавации) [7–12, 25–30], результаты проведенных в различных популяциях репликативных исследований нередко неоднозначны и в ряде случаев, как указано в метаанализе [28] (в работе рассмотрен полиморфизм CDKN2B-AS1 rs1063192), противоречивы. В ряде работ подтверждены ассоциации локусов гена CDKN2B-AS1 с глаукомой/эндофенотипами, связанными с глаукомой (вертикальный размер диска зрительного нерва) [26, 28, 31, 32], в других работах связей отдельных SNP CDKN2B-AS1 с заболеванием выявлено не было (например, rs1063192 и rs4977756 не ассоциированы с ПОУГ в популяции индийцев [33], афроамериканцев [34], а также у населения Пакистана [35]). О неоднозначности результатов ассоциативных исследований локусов CDKN2B-AS1 с глаукомой наглядно свидетельствуют материалы, представленные в 2021 г. в работе [33], посвященной метаанализу нескольких SNP данного гена, в том числе рассматриваемых в нашей работе rs1063192, rs2157719 и rs4977756: так, для rs1063192 из рассмотренных в метаанализе материалов 18 ассоциативных исследований (в том числе шесть исследований ПОУГ у европеоидов) на значимые связи с ПОУГ указывают лишь в 10 работах; для rs2157719 значимые ассоциации с ПОУГ показаны в трех из пяти рассмотренных работ; для rs4977756 лишь в четырех из 12 работ есть указания на значимые ассоциации с заболеванием. Еще одним наглядным примером неоднозначности данных о связи SNP гена CDKN2B-AS1 с глаукомой являются результаты работы [34], в которой из 24 изученных локусов данного гена значимые ассоциации с ПОУГ показал только один локус у афроамериканцев (рассмотрена выборка из 1150 больных и 999 индивидуумов из контрольной группы), ассоциации какого-либо из этих 24-х SNP с заболеванием у населения западной Африки не выявлены (выборка представлена 483 больными и 593 индивидуумами из контрольной группы). Значимые самостоятельные ассоциации пяти SNP гена CDKN2B-AS1 с ПОУГ у женщин европейской части России не выявлены и в нашей работе.
Причинами таких неоднозначных результатов могут быть клиническая гетерогенность исследуемых выборок больных и различия в этническом составе изучаемых популяций. Другие возможные причины неоднозначности результатов различных ассоциативных исследований — это «своеобразие» внешнесредовых факторов (экологических факторов, образа жизни и др.) в отдельных этнотерриториальных группах населения, особенности распространенности в них различных влияющих на развитие глаукомы мультифакторных заболеваний (атеросклероз, сахарный диабет, ишемическая болезнь сердца и др.) [1], а также связанный с указанными причинами «спектр» средовых факторов риска глаукомы, учитываемый или не учитываемый исследователями в их работах.
Несмотря на то что в настоящем исследовании не были установлены самостоятельные «главные» эффекты изучаемых локусов гена CDKN2B-AS1 в отношении формирования ПОУГ у женщин, было показано, что сочетание в гаплотипе определенных аллелей трех рассмотренных SNP гена CDKN2B-AS1 (GGG rs1063192– rs7865618–rs2157719) определяет подверженность ПОУГ у женщин Центрального Черноземья России. Значимая роль гаплотипов гена CDKN2B-AS1 в формировании предрасположенности к ПОУГ показана и в популяции индийцев [33]: CATA гаплотип rs3217992–rs1063192– rs2157719–rs4977756 в 1,61 раза повышает риск развития заболевания (p ≤ 0,0001), при этом самостоятельные эффекты этих локусов с учетом поправки Бонферрони не были статистически значимыми. Можно предположить, что при одновременном присутствии в генотипе нескольких «рисковых» аллелей гена CDKN2B-AS1 регуляторные эффекты, которыми они обладают [8, 12], суммируются и преодолевают некое «пороговое» значение, необходимое для формирования подверженности глаукоме в изученной нами популяции.
ВЫВОДЫ
Полученные данные указывают на различия в блоках сцепления по пяти исследуемым SNP гена CDKN2B-AS1 между больными ПОУГ (блоки сцепления отсутствовали) и контролем (установлен блок сцепления, состоящий из трех SNP — rs1063192, rs7865618 и rs2157719) при использовании алгоритма «Solid Spine» (заданный порог D’ > 0,8). Установлена связь гаплотипа GGG (rs1063192– rs7865618–rs2157719) гена CDKN2B-AS1 с формированием ПОУГ у женщин Центрального Черноземья России. Данный гаплотип имеет протективное значение в отношении развития заболевания (ОШ = 0,66; p = 0,006, рperm = 0,037).
- Grzybowski A, Och M, Kanclerz P, Leffler C, Moraes CG. Primary open angle glaucoma and vascular risk factors: a review of population based studies from 1990 to 2019. J Clin Med. 2020; 9 (3): 761.
- Kreft D, Doblhammer G, Guthoff RF, Frech S. Prevalence. incidence and risk factors of primary open-angle glaucoma — a cohort study based on longitudinal data from a German public health in surname. BMC Public Health. 2019; 19: 851.
- Tham YC, Li X, Wong TY, Quigley HA, Aung T, Cheng CY. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology. 2014; 121: 2081–90.
- Liu Y, Allingham RR. Molecular genetics in glaucoma. Exp Eye Res. 2011; 93: 331–9.
- Свинарева Д. И. Вклад ген-генных взаимодействий полиморфных локусов матриксных металлопротеиназ в подверженность к первичной открытоугольной глаукоме у мужчин. Научные результаты биомедицинских исследований. 2020; 6 (1): 63–77.
- Tikunova E, Ovtcharova V, Reshetnikov E, Dvornyk V, Polonikov A, Bushueva O, et al. Genes of tumor necrosis factors and their receptors and the primary open angle glaucoma in the population of Central Russia. Int J Ophthalmol. 2017; 10: 1490–4.
- Gharahkhani P, Burdon KP, Fogarty R, Sharma S, Hewitt AW, Martin S, et al. Common variants near ABCA1. AFAP1 and GMDS confer risk of primary open-angle glaucoma. Nat Genet. 2014; (10): 1120–5.
- Nakano M, Ikeda Y, Tokuda Y, Fuwa M, Omi N, Ueno M, et al. Common variants in CDKN2B-AS1 associated with optic-nerve vulnerability of glaucoma identified by genome-wide association studies in Japanese. PLoS One. 2012; 7 (3): e33389.
- Osman W, Low SK, Takahashi A, Kubo M, Nakamura Y. A genome-wide association study in the Japanese population confirms 9p21 and 14q23 as susceptibility loci for primary open angle glaucoma. Hum Mol Genet. 2012; 21(12): 2836–42.
- Shiga Y, Akiyama M, Nishiguchi KM, Sato K, Shimozawa N, Takahashi A, et al. Genome-wide association study identifies seven novel susceptibility loci for primary open-angle glaucoma. Hum Mol Genet. 2018; 27 (8): 1486–96.
- Li Z, Allingham RR, Nakano M, Jia L, Chen Y, Ikeda Y, et al. A common variant near TGFBR3 is associated with primary open angle glaucoma. Hum Mol Genet. 2015; 24 (13): 3880–92.
- Wiggs JL, Yaspan BL, Hauser MA, Kang JH, Allingham RR, Olson LM, et al. Common variants at 9p21 and 8q22 are associated with increased susceptibility to optic nerve degeneration in glaucoma. PLoS Genet. 2012; 8 (4): e1002654.
- GeneCards: The human gene database. Available from: https:// www.genecards.org/.
- Ponomarenko I, Reshetnikov E, Polonikov A, Sorokina I, Yermachenko A, Dvornyk V, et al. Candidate genes for age at menarche are associated with endometrial hyperplasia. Gene. 2020; 757: 144933.
- Litovkina O, Nekipelova E, Dvornyk V, Polonikov A, Efremova O, Zhernakova N, et al. Genes involved in the regulation of vascular homeostasis determine renal survival rate in patients with chronic glomerulonephritis. Gene. 2014; 546 (1): 112–6.
- Golovchenko O, Abramova M, Ponomarenko I, Reshetnikov E, Aristova I, Polonikov A, et al. Functionally significant polymorphisms of ESR1 and PGR and risk of intrauterine growth restriction in population of Central Russia. Eur J Obstet Gynecol Reprod Biol. 2020; 253: 52–7.
- GWAS Catalog. Available from: http://www.genome.gov/gwastudies/.
- HaploReg v4.1. Available from: https://pubs.broadinstitute.org/ mammals/haploreg/haploreg.php.
- PLINK. Available from: http://zzz.bwh.harvard.edu/plink/.
- Haploview. Available from: http://www.broad.mit.edu/mpg/haploview/.
- Moskalenko M, Ponomarenko I, Reshetnikov E, Dvornyk V, Churnosov M. Polymorphisms of the matrix metalloproteinase genes are associated with essential hypertension in a Caucasian population of Central Russia. Sci Rep. 2021; 11 (1): 5224.
- Трифонова Е. А., Спиридонова М. Г., Степанов В. А. Генетическое разнообразие и неравновесие по сцеплению в локусе метилентетрагидрофолатредуктазы. Генетика. 2008; 44 (10): 1410–19.
- Schaid DJ. Linkage disequilibrium testing when link age phase is unknown. Genetics. 2004; 166: 505–12.
- Трифонова Е. А., Спиридонова М. Г., Габидулина Т. В., Урнов Ф. Д., Пузырев В. П., Степанов В. А. Анализ структуры неравновесия по сцеплению и ассоциации полиморфных вариантов гена MTHFR с коронарным атеросклерозом. Генетика. 2012; 48 (10):1207–20.
- Ramdas WD, van Koolwijk LM, Ikram MK, Jansonius NM, de Jong PT, Bergen AA, et al. A genome-wide association study of optic disc parameters. PLoS Genet. 2010; 6 (6): e1000978.
- Fan BJ, Wang DY, Pasquale LR, Haines JL, Wiggs JL. Genetic variants associated with optic nerve vertical cup-to-disc ratio are risk factors for primary open angle glaucoma in a US Caucasian population. Invest Ophthalmol Vis Sci. 2011; 52 (3): 1788–92.
- Ramdas WD, van Koolwijk LM, Lemij HG, Pasutto F, Cree AJ, Thorleifsson G, et al. Common genetic variants associated with open-angle glaucoma. Hum Mol Genet. 2011; 20: 2464–71.
- Hu Z, He C. CDKN2B gene rs1063192 polymorphism decreases the risk of glaucoma. Oncotarget. 2017; 8 (13): 21167–76.
- Springelkamp H, Höhn R, Mishra A, Hysi PG, Khor CC, Loomis SJ. et al. Meta-analysis of genome-wide association studies identifies novel loci that influence cupping and the glaucomatous process. Nat Commun. 2014; 5: 4883.
- Springelkamp H, Mishra A, Hysi PG, Gharahkhani P, Höhn R, Khor CC, et al. Meta-analysis of genome-wide association studies identifies novel loci associated with optic disc morphology. Genet Epidemiol. 2015; 39 (3): 207–16.
- Chen Y, Hughes G, Chen X, Qian S, Cao W, Wang L, et al. Genetic variants associated with different risks for high tension glaucoma and normal tension glaucoma in a Chinese population. Invest Ophthalmol Vis Sci. 2015; 56 (4): 2595–600.
- Nunes HF, Ananina G, Costa VP, Zanchin NIT, de Vasconcellos JPC, de Melo MB. Investigation of CAV1/CAV2 rs4236601 and CDKN2B-AS1 rs2157719 in primary open-angle glaucoma patients from Brazil. Ophthalmic Genet. 2018; 39: 194–9.
- Thakur N, Kupani M, Mannan R, Pruthi A, Mehrotra S. Genetic association between CDKN2B/CDKN2B-AS1 gene polymorphisms with primary glaucoma in a North Indian cohort: an original study and an updated meta-analysis. BMC Med Genomics. 2021; 14 (1): 1.
- Liu Y, Hauser MA, Akafo SK, Qin X, Miura S, Gibson JR, et al. Investigation of known genetic risk factors for primary open angle glaucoma in two populations of African ancestry. Invest Ophthalmol Vis Sci. 2013; 54 (9): 6248–54.
- Micheal S, Ayub H, Khan MI, Bakker B, Schoenmaker-Koller FE, Ali M, et al. Association of known common genetic variants with primary open angle, primary angle closure, and pseudoexfoliation glaucoma in Pakistani cohorts. Mol Vis. 2014; 20: 1471–9.