ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Изменения микробиоты кишечника и их связь с тяжестью заболевания и некоторыми показателями цитокинового профиля у пациентов с COVID-19
Крымский федеральный университет имени В. И. Вернадского, Симферополь, Россия
Важной составляющей поддержания иммунного гомеостаза в том числе при COVID-19 является микробиота кишечника. Целью работы было изучить изменения таксономического состава микробиоты кишечника и характер их взаимосвязи с тяжестью заболевания, содержанием IL6, IL10, IL17 и TNFα у пациентов с COVID-19. В одномоментном сравнительном исследовании приняли участие 110 пациентов с COVID-19 (основная группа) и 98 лиц, не инфицированных COVID-19 (контрольная группа). Оценку состава микробиоты кишечника проводили методом шотган-секвенирования. Уровень IL6, IL10, IL17 и TNFα в сыворотке крови определяли с помощью твердофазного иммуноферментного анализа. Обнаружены статистически значимые изменения в составе кишечной микробиоты у пациентов с COVID-19 в отличие от контрольной группы: снижение численности B. adolescentis (p = 0,048), E. rectale (p = 0,036), F. prausnitzi (p = 0,0002), B. dorei (p < 0,001) и повышение численности R. gnavus (p = 0,012), Сl. hathewayi (p = 0,003), E. faecium (p = 0,0003). Установлена корреляция численности B. dorei с показателем IL6 (r = 0,49; p = 0,034), численности F. prausnitzii и показателей IL10, IL17 (r = 0,44; p = 0,001 и r = –0,52; p < 0,001 соответственно). Численность R. gnavus коррелировала с показателем TNFα, а численность E. faecium — с IL6 (r = 0,47; p = 0,002) и TNFα (r = 0,56; p = 0,001). Также выявлена сопряженность численности B. dorei, F. prausnitzii и E. faecium с более высокими баллами по шкале оценки клинического состояния ШОКС-КОВИД (r = –0,54; p = 0,001, r = –0,60; p < 0,001 и r = 0,67; p = 0,005 соответственно). Направленная коррекция кишечной микробиоты может улучшить эффективность лечения COVID-19.
Ключевые слова: микробиота кишечника, SARS-CoV-2, COVID-19, цитокиновый статус
Вклад авторов: Л. Н. Гуменюк, Л. Е. Сорокина — существенный вклад в замысел и дизайн исследования; М. В. Голод, Н. В. Силаева, Н. А. Андрощук — сбор, анализ и интерпретация данных; С. С. Ильясов — статистическая обработка данных; О. Р. Кривошапко, А. М. Велиляев, Л. Н. Асанова — подготовка рукописи.
Соблюдение этических стандартов: исследование одобрено этическим комитетом Крымской медицинской академии им. С. И. Георгиевского» ФГАОУ ВО «Крымский федеральный университет им. В. И. Вернадского» (протокол № 11 от 23 ноября 2021 г.), спланировано и проведено в соответствии с Хельсинской декларацией. Все лица, включенные в исследование, подписали добровольное информированное согласие.
Для корреспонденции: Лея Евгеньевна Сорокина
бул. Ленина, 5/7, г. Симферополь, 295006, Республика Крым; ur.liam@anikoros.ayel
В связи с новой коронавирусной инфекцией, вызванной вирусом SARS-CoV-2 и получившей название COVID-19, Всемирной организацией здравоохранения была объявлена пандемия [1]. Тяжелые формы течения этого заболевания сопровождаются развитием прогрессирующей вирусной пневмонии и острого респираторного дистресс-синдрома (ОРДС). В патофизиологии COVID-19 значимую роль играет нарастающее системное воспаление. С тяжестью заболевания тесно связано избыточное продуцирование цитокинов, вызванное вирусом SARS-CoV-2, известное как «цитокиновый шторм» [2]. У пациентов с COVID-19 обнаруживают высокие уровни интерлейкинов IL1β, IL1RA, IL6, IL8, IL9, IL10, IL17, С-рективного белка (СRP), фактора некроза опухоли (TNFα) [3–5].
Накопленные данные в исследованиях in vitro и in vivo свидетельствуют о том, что желудочно-кишечный тракт (ЖКТ) тоже восприимчив к инфекции COVID-19. Например, на модели in vitro, имитирующей клеточные и пространственные структуры кишечника, была продемонстрирована способность вируса SARS-CoV-2 инфицировать энтероциты [6]. Частота возникновения гастроинтестинальных симптомов у пациентов с COVID-19 достигает 20% [7]. Причина этого в сбособности SARS-CoV-2 проникать в клетки путем связывания с рецептором ангиотензинпревращающего фермента 2 (АСЕ2), который активно экспрессируется на поверхности энтероцитов подвздошной и толстой кишки, что и приводит к гастроинтестинальным симптомам путем вызванного вирусом иммуноопосредованного повреждения [8]. Кроме того, вирусная РНК SARS-CoV-2 может быть обнаружена в образцах кала спустя более 30 дней после начала заболевания [9]. В данном аспекте в литературе активно обсуждают роль микробиоты кишечника. Как известно, микробиота кишечника является важной составляющей поддержания иммунного гомеостаза. В свою очередь дисбиотические нарушения микробиоты кишечника напрямую связаны с многочисленными воспалительными заболеваниями [10]. Представлены убедительные данные о качественных изменениях микробиоты кишечника у пациентов, инфицированных COVID-19 [11]. В целом, у пациентов с COVID-19 отмечена тенденция к уменьшению видового разнообразия бактерий, истощению полезных комменсалов и обогащению патобионтами [12], однако сведения о видовом составе микробиоты кишечника фрагментарны и противоречивы. Учитывая, что взаимодействия, реализуемые посредством оси «кишечник–легкие», потенциально могут повышать восприимчивость организма хозяина к вирусной инфекции и снижать функциональную активность иммунных клеток, что способствует развитию системного гипервоспаления с синдромом «цитокинового шторма», является актуальным дальнейшее изучение изменений микробиоты кишечника и характера их взаимосвязи с показателями цитокинового статуса у пациентов с COVID-19.
Цель исследования — изучение изменений таксономического состава микробиоты кишечника и характера их взаимосвязи с тяжестью заболевания, IL6, IL10, IL17 и TNFα у пациентов с COVID-19.
ПАЦИЕНТЫ И МЕТОДЫ
Методом сплошной выборки в сравнительное одномоментное исследование было включено 110 пациентов с COVID-19 (женщины — 66 (60,0%), мужчины — 44 (40,0%); средний возраст — 28,6 ± 8,4 лет), поступивших на стационарное лечение в больницы, работающие в системе обязательного медицинского страхования г. Симферополя (основная группа, ОГ) и 98 здоровых добровольцев, не инфицированных COVID-19 (женщины — 61 (62,2%), мужчины — 37 (37,8%); средний возраст — 29,2 ± 7,6 лет), проходивших ежегодный профилактический медицинский осмотр на базе медицинского центра «Гемокод» г. Симферополя (контрольная группа, КГ).
Критерии включения пациентов в ОГ: возраст 18–45 лет; подтвержденная COVID-19 на основании положительной полимеразой цепной реакции (ПЦР) на РНК вируса SARSCoV-2 и/или типичной картины вирусной пневмонии при мультиспиральной компьютерной томографии (КТ); легкое, среднетяжелое и тяжелое течение COVID-19.
Критерии невключения в ОГ: крайне тяжелое течение COVID-19; сахарный диабет I и II типа; ожирение; инфаркт миокарда, тяжелые нарушения ритма сердца, сердечная недостаточность; гипертоническая болезнь, инсульт, транзиторная ишемическая атака в анамнезе; острое нарушение мозгового кровообращения (за предшествующие шесть месяцев до начала исследования); тяжелые или декомпенсированные сопутствующие соматические заболевания, которые могут затруднять участие больного в исследовании и влиять на его результаты; синдром раздраженного кишечника; хронические заболевания ЖКТ, печени; гематологические и онкологические заболевания; психические расстройства, алкоголизм или наркомания в анамнезе; прием антибиотиков, пробиотиков, пребиотиков, противовирусных, симбиотических или кислотоподавляющих препаратов в предшествующие три месяца до начала исследования; прием препаратов, влияющих на стул в предшествующий месяц до начала исследования; отказ от участия в исследовании.
Критерии включения здоровых добровольцев: возраст 18–45 лет; не подтвержденная COVID-19 на основании проведенной ПЦР на РНК вируса SARS-Co; отсутствие хронических заболеваний и аллергических реакций; отсутствие инфекционных и острых заболеваний в течение двух месяцев перед исследованием; отсутствие психических расстройств, алкоголизма или наркомании в анамнезе; отсутствие нарушений стула (запоров/диареи) в предшествующий месяц до начала исследования; не принимавшие антибиотики, пробиотики, пребиотики, противовирусные и симбиотические препараты в предшествующие три месяца до начала исследования; не принимавшие препараты, влияющие на стул в предшествующий месяц до начала исследования.
Критерии невключения здоровых добровольцев: температура тела выше 36,9 °С; отказ от участия в исследовании.
Характеристика пациентов с COVID-19 и здоровых добровольцев представлена в табл. 1. Группы были сопоставимы по полу (р = 0,96; χ2), возрасту (р = 0,92; χ2) и индексу массы тела (р = 0,054; χ2).
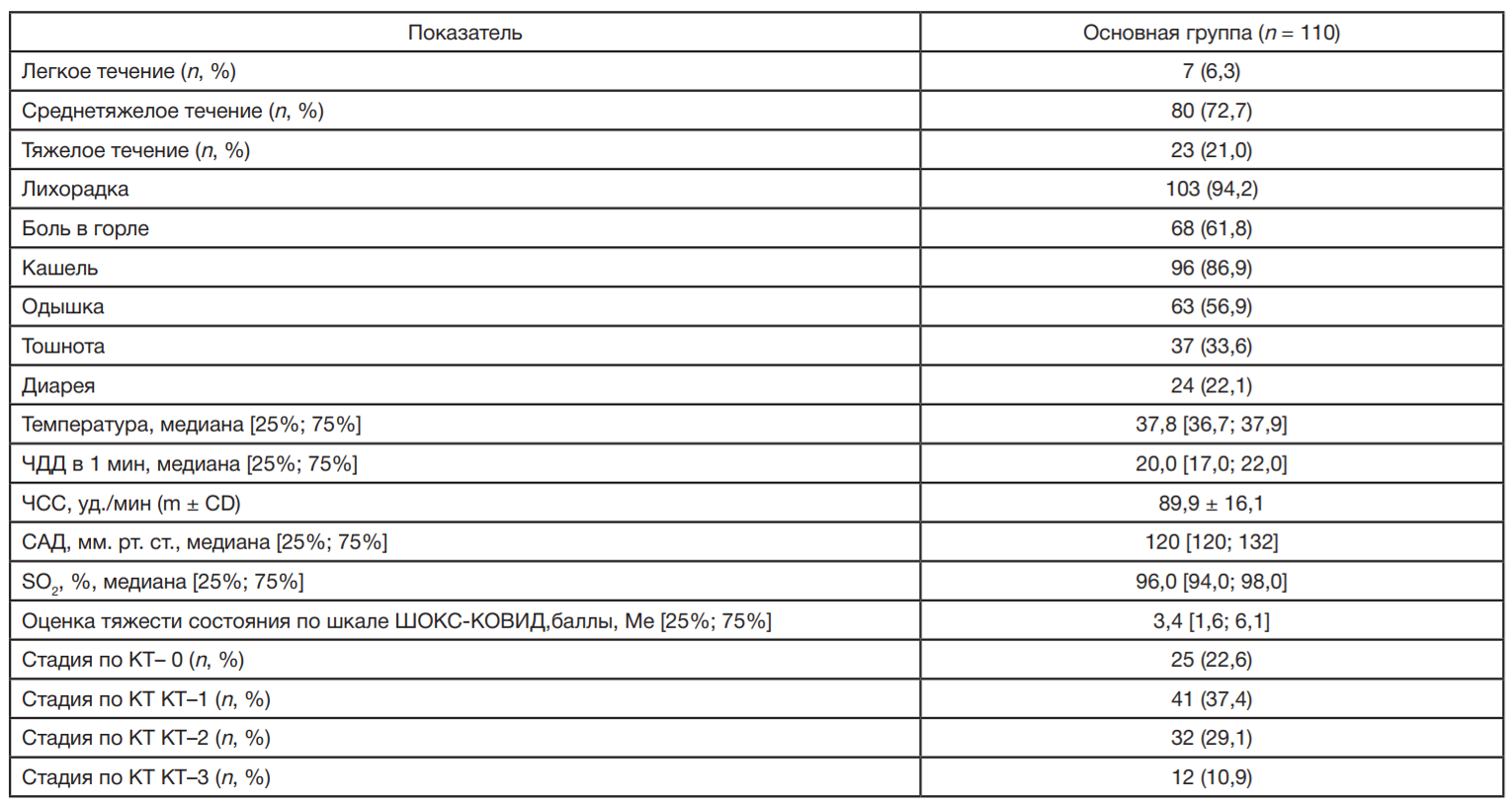
Клиническая характеристика пациентов с COVID-19 представлена в табл. 2. Среди пациентов преобладали лица со среднетяжелым течением COVID-19 — 80 (72,7 ± 0,68%). Наиболее частыми симптомами заболевания были лихорадка — 103 (94,2%) и кашель — 96 (86,9 ± 0,61%). По данным КТ вирусная пневмония диагностирована у 95 (67,1 ± 0,38%) пациентов.
Диагноз COVID-19 у всех пациентов был подтвержден с помощью ПЦР на вирус SARS-CoV-2 (материал получен с помощью мазка из носоглотки и ротоглотки) и/или типичной вирусной пневмонии при мультиспиральной КТ. Диагностику и степень тяжести COVID-19, распространенность пневмонии по результатам КТ оценивали согласно Временным методическим рекомендациям по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19) Минздрава РФ 6–9-й версий.
С целью объективизации тяжести клинического состояния мы использовали оригинальную шкалу оценки клинического состояния больных с коронавирусной инфекцией (ШОКС-КОВИД) [13].
Для анализа таксономического состава микробиоты кишечника у пациентов в первый день госпитализации (в утреннее время с 8.00 до 10.00) были взяты образцы кала, которые замораживали и хранили в одноразовых пластиковых контейнерах при температуре –80 °C до проведения метагеномного анализа. Выделение тотальной ДНК проводили методом фенольной экстракции. Нуклеотидная последовательность выделенной ДНК была установлена методом шотган-секвенирования с использованием высокопроизводительного секвенатора SOLiD5500 Wildfire (AppliedBiosystems; США) [14].
Фильтрацию прочтений по качеству и их таксономическую классификацию проводили с помощью программного обеспечения QIIME версии 1.9.1 [15]. Для определения таксономической принадлежности прочтений применяли подход, включающий в себя использование двух таксономических баз данных. На первом этапе осуществляли подбор референсного набора операционных таксономических единиц (ОТЕ) бактерий на основании сравнения полученных прочтений генов 16S рРНК с базой данных GreenGenes версии 13.5 [16]. На втором этапе с использованием алгоритма RDP определение таксономической принадлежности данных ОТЕ проводили на основе специализированной базы данных кишечной микробиоты человека HITdb [17].
Изучение качественного и количественного состава микробиоты кишечника осуществляли на основании определения видов, родов и фил микроорганизмов. Оценку α-разнообразия сообщества путем расчета индекса Chao1, показателя числа обнаруженных таксонов (Sobs), показателя, оценивающего реальное количество таксонов (ACE), проводили с помощью программы Mothur v.1.22.0 (http:// www.mothur.org).
В качестве маркеров цитокинового профиля нами выбраны IL6, IL10, IL17 и TNFα, что обусловлено их значимой ролью в патогенезе «цитокинового шторма» и ОРДС [3–5].
Забор крови из периферической вены выполняли в первый день госпитализации натощак в утренние часы (7.00–9.00) в состоянии покоя (не менее 15 мин). Пробирки с сывороткой крови хранили в замороженном состоянии при температуре –20 °С. Уровень IL6, IL10, IL17 и TNFα в сыворотке крови изучали с помощью тест-системы твердофазного иммуноферментного анализа (ИФА) (Вектор-Бест; Новосибирск, Россия) на автоматическом ИФА-анализаторе «Elisys Quattro» (Human GmbH; Германия).
Статистическую обработку полученных данных выполняли с помощью пакета прикладных программ STATISTICA 8.0 (StatSoft. Inc.; США). При нормальном распределении показателей определяли среднее значение и стандартное отклонение, при распределении, отличном от нормального, — медиану, 25-й и 75-й процентили. Нормальность распределения проверяли при помощи распределения Гаусса. Для качественных признаков определяли долю и абсолютное число значений. Сравнительный анализ для нормально распределенных количественных признаков проводили c помощью параметрического t-критерия Стьюдента, при распределении, отличном от нормального, — с помощью U-критерия Манна–Уитни, для количественных признаков — с помощью критерия χ2 (хи-квадрат). Для оценки взаимосвязи признаков рассчитывали коэффициент корреляции Спирмена. Различия считали статистически значимыми при р < 0,05. Применяли также корреляционный анализ и множественную ранговую корреляцию, достоверность корреляционных связей проверяли при помощи таблиц сопряженности.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
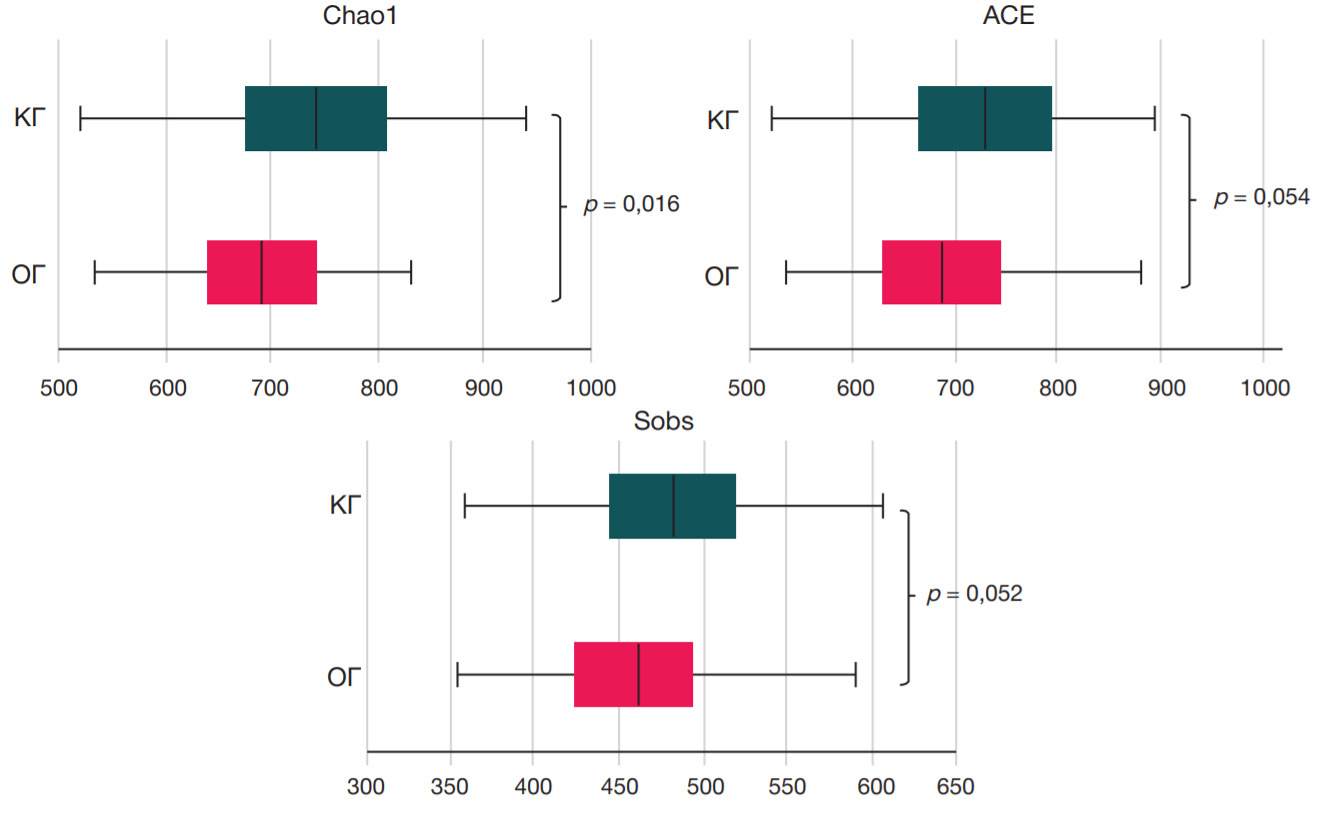
При изучении таксономического состава микробиоты кишечника у пациентов с COVID-19 по сравнению с лицами КГ обнаружено статистически значимое снижение α-разнообразия бактериального сообщества (индекс Chao1; p = 0,016). Индексы ACE и Sobs в группе пациентов с COVID-19 по сравнению с КГ также были несколько снижены, при этом статистически значимых различий не найдено (р = 0,054; р = 0,052 соответственно) (рис. 1).
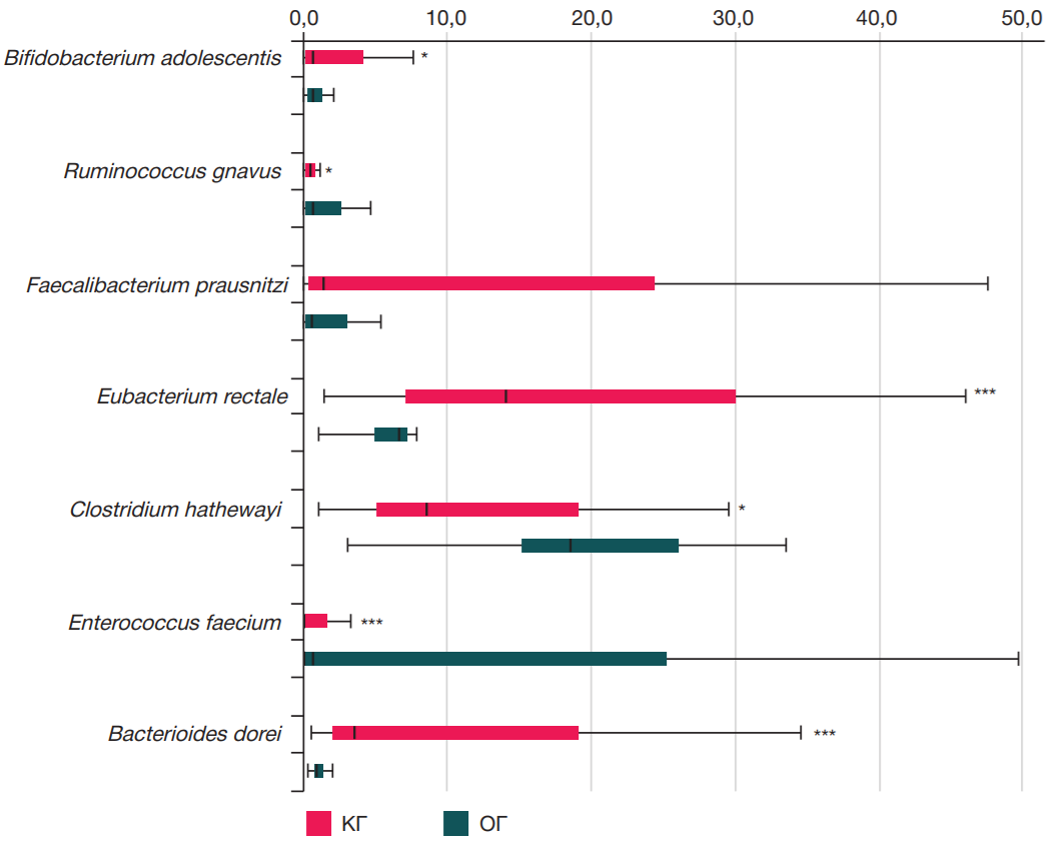
При сравнении видового состава кишечной микробиоты в группах обследованных у пациентов с COVID-19 по сравнению с КГ установлено статистически значимое cнижение численности Bifidobacterium adolescentis SPM1005-A (p = 0,048), Eubacterium rectale ATCC 33656 (p = 0,036), Faecalibacterium prausnitzi A2-165 (p = 0,0002), Bacterioides dorei DSM 17855 (p = 0,001) и выявлено повышение численности Ruminococcus gnavus ATCC 29149 (p = 0,012), Сlostridium hathewayi DSM-13479 (p = 0,003) и Enterococcus faecium W54 (p = 0,0003) (рис. 2).
Показатели IL6, IL10, IL17 и TNFα в сыворотке крови у пациентов с COVID-19 по сравнению с показателями КГ статистически значимо выше (табл. 3).
В ходе уточнения взаимосвязи изменений микробиоты кишечника с некоторыми показателями цитокинового профиля у пациентов с COVID-19 получены статистически значимые корреляционные связи численности бактерий B. dorei с показателем IL6 (r = –0,49; p = 0,034), численности бактерий F. prausnitzi и показателей IL10, IL17 (r = –0,44; p = 0,001 и r = –0,52; p < 0,001 соответственно). Численность бактерий R. gnavus коррелировала с показателем TNFα (r = 0,51; p = 0,036), а численность E. faecium — с IL6 (r = 0,47; p = 0,002) и TNFα (r = 0,56; p = 0,001). В ходе корреляционного анализа выявлена также сопряженность численности бактерий B. dorei, F. prausnitzi и E. faecium с более высокими баллами по ШОКС-КОВИД (r = –0,54 и p = 0,001; r = –0,60 и p < 0,001; r = 0,67 и p = 0,005 соответственно).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ряде ранее выполненных работ сообщается об изменении состава микробиоты кишечника у пациентов с COVID-19 [7, 11, 12]. Результаты настоящего исследования тоже показали, что состав микробиоты кишечника у пациентов с COVID-19 значительно отличается от такового у лиц, не инфицированных COVID-19. По нашим данным, у пациентов с COVID-19 по сравнению с лицами, не инфицированными COVID-19, более низкое бактериальное α-разнообразие, что подтверждается статистически более низким индексом Chao1 и согласуется с результатами ранее выполненных исследований [11]. У пациентов с COVID-19 дисбиотические изменения кишечника характеризовались снижением численности бактерий с иммуномодулирующим потенциалом — представителей типа B. adolescentis, E. rectale, F. prausnitzi, B. dorei, которые, как известно, являются основными продуцентами бутирата (мощного противовоспалительного метаболита). В то же время мы обнаружили повышенную численность потенциальных патобионтов — бактерий R. gnavus, Сl. hathewayi и E. faecium. Среди них стоит отметить наличие E. faecium, которые ранее были обнаружены в образцах фекалий пациентов с COVID-19 итальянскими исследователями [18]. Высокое содержание E. faecium в микробиоте кишечника у пациентов в критическом состоянии может иметь клиническое значение, в связи с ее патогенным потенциалом, резистентностью ко многим широко используемым противомикробным препаратам и способностью к стремительному приобретению генетического материала или изменению генной экспрессии, позволяющей ей приобретать детерминанты устойчивости практически ко всем антибактериальным средствам [19, 20]. Независимо от штамма рода Enterococcus, кишечная микробиота у пациентов с COVID-19 способна, таким образом, действовать как резервуар условно-патогенных микроорганизмов, потенциально устойчивых к антибиотикам, с возможностью миграции через поврежденные эпителиальные барьеры в системный кровоток, как уже было продемонстрировано в контексте других заболеваний [20]. Полученные нами результаты частично соотносятся с данными ряда других ранее выполненных работ. Например, в одной из работ, для пациентов с COVID-19 были характерны снижение численности B. dorei и повышение численности E. faecium [18]. В другом исследовании для пациентов с COVID-19 были характерны снижение численности B. adolescentis, E. rectale, F. prausnitzi и повышение численности бактерий R. gnavus [21]. Контрастирование полученных данных может быть обусловлено тем, что наблюдения выполняли в различных географических регионах и использовали различные критерии включения в исследование. Группы значительно различались по возрасту: 28,6 ± 8,4 года в нашем исследовании против 73,0 [59,0; 85,0] в ранее описанном [18] и 36,4 ± 18,7 года — в исследовании [21]. Кроме того, в отличие от вышеуказанных авторов мы не включали в наблюдение пациентов, имеющих коморбидные соматические заболевания и принимающих антибактериальные и/или противовирусные препараты с целью нивелирования их влияния на результаты исследования.
Несмотря на то что некоторые идентифицированные нами бактерии могут быть общими для ряда других заболеваний, как кишечных, так и системных, установленная в нашей работе сопряженность сниженного содержания бактерий B. dorei, F. prausnitzi и повышенного содержания бактерий E. faecium с более высокими баллами по ШОКС-КОВИД позволяет предположить, что изменения численности этих бактерий могут быть характерными для данной когорты пациентов с COVID-19. Обнаруженные ассоциации мы сопоставили с результатами ранее выполненных исследований. Так, у пациентов, поступивших в отделение интенсивной терапии, наблюдалось истощение представителей рода Bacteroides [18]. Интересно, что в дугой работе [7] представленность B. dorei обратно коррелировала с фекальной нагрузкой SARS-CoV-2 у пациентов с COVID-19. Авторы отметили, что с учетом ассоциированности этой бактерии с пониженной экспрессией рецепторов АПФ2 в ободочной кишке мышей, B. dorei может быть потенциально протективной в отношении вируса SARS-CoV-2. Представлены данные об обратной корреляции бактерий F. prausnitzii, известной своими противовоспалительными эффектами, и степенью тяжести инфекции COVID-19 [7]. В то же время у пациентов с COVID-19 из отделения интенсивной терапии по сравнению с пациентами из отделения общей терапии отмечена более высокая численность штаммов рода Enterococcus (p = 0,0001) [18]. Можно предположить, что терапевтическое повышение численности B. dorei, F. prausnitzii и снижение численности E. faecium эффективны в отношении смягчения тяжести заболевания, однако для подтверждения данной гипотезы необходимо проведение дополнительных исследований с соответствующим дизайном. Ряд авторов отмечает, что пребиотические и/ или пробиотические препараты могут быть использованы в качестве потенциального (дополнительного) вектора терапии COVID-19 с целью снижения тяжести инфекции и минимизации риска вторичных бактериальных осложнений [22, 23].
В ряде исследований доказано влияние микробиоты кишечника на восприимчивость к инфекционным и неинфекционным заболеваниям [24]. Отмечено, что иммуномодулирующее действие кишечной микрофлоры реализуется посредством активации генов ряда цитокинов в иммунных и эпителиальных клетках, что определяет гетерогенность их иммуномодулирующих свойств [25]. Сообщалось, что как для доминантных микросимбионтов, так и для ассоциантов характерна гетерогенность в проявлении иммунорегуляторных эффектов [26]. Так, суммарные эффекты воздействия представителей нормофлоры на секрецию цитокинов иммунными клетками человека в условиях эубиоза обеспечивают цитокиновый баланс, характеризующийся умеренным уровнем провоспалительных цитокинов (IL6, TNFα) и контролируемый супрессивным воздействием антифлогогенных цитокинов. В условиях нарастания антигенной нагрузки при дисбиозе через активацию toll-like-рецепторов усиливается продукция целого спектра провоспалительных цитокинов, которые способствуют развитию как локального воспаления, так и эффекторных иммунных реакций в лимфоидных образованиях кишечника, защищающих организм от патогенов [27].
Как указывалось ранее, при инфекции COVID-19 содержание цитокинов IL6, IL10, IL17 и TNFα повышается [4]. В настоящем исследовании у пациентов с COVID-19 по сравнению со здоровыми добровольцами также установлены статистически значимые различия в уровне IL6, IL10, IL17 и TNFβ.
Предполагается, что тяжесть COVID-19 является следствием «цитокинового шторма» [4]. Примечательно, что некоторые из вышеперечисленных цитокинов коррелируют с паттерном микробиоты кишечника, специфический профиль которой способен инициировать «цитокиновый шторм». В настоящем исследовании у пациентов с COVID-19 установлена корреляция между численностью бактерий B. dorei и уровнем IL6.
Выявлена сопряженность численности бактерий F. prausnitzi и показателей IL10, что может быть опосредовано снижением секреции метаболитов, блокирующих активацию транскрипционного фактора NF-kB и продуцирование IL8. Например, в исследовании in vivo показано, что активация мононуклеарных клеток периферической крови посредством F. prausnitzi вызывала значительное снижение секреции IL12 и TNFα и увеличение секреции IL10 [28]. Кроме того, численность бактерий F. prausnitzi обратно коррелировала с уровнем IL17. В ходе анализа литературных данных мы не встретили работ, посвященных изучению связи между микробиотой кишечника и IL17 у пациентов с COVID-19. Вместе с тем, показано, что F. prausnitzi подавляет продукцию IL17 у крыс [29]. На модели экспериментального колита было продемонстрировано, что бактерии F. prausnitzi, проявляют свой противовоспалительный эффект за счет продукции бутирата, поддерживающего баланс между противовоспалительными Т-хелперными клетками 17 типа (Th17) и иммунорегуляторными (Treg) Т-клетками посредством ингибирования гистондеацетилазы 1. В свою очередь, нарушение баланса между Th17 и Treg способствует развитию аутоиммунного воспаления [30].
Нами также выявлена сопряженность численности бактерий Ruminococcus gnavus и показателей TNFα. Эти данные согласуются с результатами ранее опубликованной работы [31], в которой установлено, что более высокое содержание бактерий R. gnavus у пациентов с COVID-19 коррелирует с всплеском провоспалительных цитокинов IFNγ и TNFα, что обусловливает цитокиновый шторм и активацию Т-хелперных клеток 1-го типа.
Мы обнаружили, что численность бактерий E. faecium коррелировала с уровнем IL6 и TNFα. В литературе нами были найдены подобные корреляции у пациентов с язвенным колитом [32] и у пациентов со СПИДОМ/ВИЧ [33].
Таким образом, в условиях кишечного дисбиоза на фоне COVID-19 у представителей нормофлоры ограничивается направленность иммунорегуляторных эффектов на противовоспалительные цитокины, что способствует нарушению гомеостаза и развитию воспалительных и аутоиммунных реакций.
ВЫВОДЫ
У пациентов с COVID-19 установлена сопряженность сниженного содержания бактерий B. dorei, F. prausnitzi и повышенного содержания бактерий E. faecium с более высокими баллами по ШОКС-КОВИД, что свидетельствует о патогномоничности данных таксономических изменений микрофлоры кишечника для лиц, инфицированных SARS-CoV-2. У пациентов с SARS-CoV-2-инфекцией обнаружены статистически значимые корреляционные связи численности кишечных бактерий B. dorei, F. prausnitzi, R. gnavus, E. faecium с показателем IL6, IL10, IL17, TNFα, что подтверждает способность микробиоты кишечника участвовать в системных воспалительных реакциях и поддерживать толерантность иммунного ответа при COVID-19. Полученные данные в совокупности с имеющимися в мировой литературе указывают на значимую роль микробиоты в патогенезе COVID-19. Более системное и детальное исследование в этом направлении позволит разработать новые подходы, препараты селективных пробиотиков для коррекции микробиоты при протекании СOVID-19 и лечении постковидных последствий.
- Statement on the second meeting of the International Health Regulations Emergency Committee regarding the outbreak of novel coronavirus (2019-nCoV). World Health Organization (WHO), 2020. Available from: https://www.who.int/news-room/detail/3001-2020-statement-on-the-second-meeting-of-the-internationalhealth-regulations-(2005)-emergency-committee-regarding-theoutbreak-of-novel-coronavirus-(2019-ncov) (assessed Dec 15, 2021).
- Tao W, Zhang G, Wang X, et al. Analysis of the intestinal microbiota in COVID-19 patients and its correlation with the inflammatory factor IL18. Med Microecol. 2020; 5: 100023. DOI:10.1016/j. medmic.2020.100023.
- Tay MZ, Poh CM, Rénia L, MacAry PA, Ng LFP. The trinity of COVID-19: immunity, inflammation and intervention. Nat Rev Immunol. 2020; 20 (6): 363–74. DOI: 10.1038/s41577-0200311-8.
- Costela-Ruiz VJ, Illescas-Montes R, Puerta-Puerta JM, Ruiz C, Melguizo-Rodríguez L. SARS-CoV-2 infection: The role of cytokines in COVID-19 disease. Cytokine Growth Factor Rev. 2020; 54: 62–75. DOI: 10.1016/j.cytogfr.2020.06.001.
- Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020; 395: 1054–62. DOI: 10.1016/S0140-6736(20)30566-3.
- Lamers MM, Beumer J, van der Vaart J, et al. SARS-CoV-2 productively infects human gut enterocytes. Science. 2020; 369 (6499): 50–54. DOI: 10.1126/science.abc1669.
- Zuo T, Zhang F, Lui GCY, et al. Alterations in Gut Microbiota of Patients With COVID-19 During Time of Hospitalization. Gastroenterology. 2020; 159 (3): 944–55.e8. DOI:10.1053/j. gastro.2020.05.048.
- Guan WJ, Ni ZY, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020; 382 (18): 1708–20. DOI: 10.1056/NEJMoa2002032.
- Chan KH, Poon LL, Cheng VC, et al. Detection of SARS coronavirus in patients with suspected SARS. Emerg Infect Dis. 2004; 10 (2): 294–9. DOI: 10.3201/eid1002.030610.
- Wu HJ, Wu E. The role of gut microbiota in immune homeostasis and autoimmunity. Gut Microbes. 2012; 3 (1): 4–14. DOI: 10.4161/ gmic.19320.
- Gu S, Chen Y, Wu Z, et al. Alterations of the Gut Microbiota in Patients With Coronavirus Disease 2019 or H1N1 Influenza. Clin Infect Dis. 2020; 71 (10): 2669–78. DOI: 10.1093/cid/ciaa709.
- Zuo T, Liu Q, Zhang F, et al. Depicting SARS-CoV-2 faecal viral activity in association with gut microbiota composition in patients with COVID-19. Gut. 2021; 70 (2): 276–84. DOI: 10.1136/ gutjnl-2020-322294.
- Мареев В. Ю., Беграмбекова Ю. Л., Мареев Ю. В. Как оценивать результаты лечения больных с новой коронавирусной инфекцией (COVID-19)? Шкала Оценки Клинического Состояния (ШОКС–КОВИД). Кардиология. 2020; 60 (11): 35–41.
- Mitra S, Forster-Fromme K, Damms-Machado A, et al. Analysis of the intestinal microbiota using SOLiD16S rRNA gene sequencing and SOLiD shotgun sequencing. BMC Genomics. 2013; 14 (5): 16.
- Caporaso JG, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data. Nat Methods. 2010; 7 (5): 335–6. DOI: 10.1038/ nmeth.f.303.
- DeSantis, TZ, Hugenholtz P, Larsen N. Greengenes, a chimerachecked 16S rRNA gene database and workbench compatible with ARB. Appl Environ Microbiol. 2006; 72: 5069–72.
- Ritari J, Salojärvi J, Lahti L, de Vos WM. Improved taxonomic assignment of human intestinal 16S rRNA sequences by a dedicated reference database. BMC Genomics. 2015; 16 (1): 1056. DOI: 10.1186/s12864-015-2265-y.
- Gaibani P, D'Amico F, Bartoletti M, et al. The Gut Microbiota of Critically Ill Patients With COVID-19. Front Cell Infect Microbiol. 2021; 11: 670424. DOI: 10.3389/fcimb.2021.670424.
- Gilmore MS, Clewell DB, Ike Y, Shankar N, eds. Enterococci: From Commensals to Leading Causes of Drug Resistant Infection. Boston: Massachusetts Eye and Ear Infirmary, 2014.
- Tamburini FB, Andermann TM, Tkachenko E, Senchyna F, Banaei N, Bhatt AS. Precision identification of diverse bloodstream pathogens in the gut microbiome. Nat Med. 2018; 24 (12): 1809– 14. DOI: 10.1038/s41591-018-0202-8.
- Yeoh YK, Zuo T, Lui GC, et al. Gut microbiota composition reflects disease severity and dysfunctional immune responses in patients with COVID-19. Gut. 2021; 70 (4): 698–06. DOI: 10.1136/ gutjnl-2020-323020.
- Danilenko VN, Devyatkin AV, Marsova MV, et al Common in– ammatory mechanisms in COVID-19 and Parkinson’s diseases: the role of microbiome, pharmabiotics and postbiotics in their prevention. Journal of Inflammation Research. 2021; 14, 6349–81. DOI: 10.2147/JIR.S333887.
- Poluektova E, Yunes R, Danilenko V. The Putative Antidepressant Mechanisms of Probiotic Bacteria: Relevant Genes and Proteins. Nutrients. 2021; 13 (5): 1591. DOI: 10.3390/nu13051591.
- West CE, Renz H, Jenmalm MC, et al. The gut microbiota and inflammatory noncommunicable diseases: associations and potentials for gut microbiota therapies. J Allergy Clin Immunol. 2015; 135 (1): 3–14. DOI: 10.1016/j.jaci.2014.11.012.
- Sun Z, Song ZG, Liu C, et al. Gut microbiome alterations and gut barrier dysfunction are associated with host immune homeostasis in COVID-19 patients. BMC Med. 2022; 24: 20. DOI: 10.1186/ s12916-021-02212-0.
- Бухарин О. В., Чайникова И. Н., Иванова Е. В. и др. Иммунорегуляторный профиль микросимбионтов кишечного биотопа человека. Журнал микробиологии, эпидемиологии и иммунобиологии. 2018; 4: 42–51.
- Hursitoglu M, Isıksacan N, Erismis B, et al. In-vitro cytokine production and nasopharyngeal microbiota composition in the early stage of COVID-19 infection. Cytokine. 2022; 149: 155757. DOI: 10.1016/j.cyto.2021.155757.
- Sokol H, Pigneur B, Watterlot L, et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc Natl Acad Sci USA. 2008; 105 (43): 16731–6. DOI: 10.1073/pnas.0804812105.
- Zhang M, Qiu X, Zhang H, et al. Faecalibacterium prausnitzii inhibits interleukin-17 to ameliorate colorectal colitis in rats. PLoS One. 2014; 9 (10): e109146. DOI: 10.1371/journal.pone.0109146.
- Zhou L, Zhang M, Wang Y, et al. Faecalibacterium prausnitzii Produces Butyrate to Maintain Th17/Treg Balance and to Ameliorate Colorectal Colitis by Inhibiting Histone Deacetylase 1. Inflamm Bowel Dis. 2018; 24 (9): 1926–40. DOI: 10.1093/ibd/ izy182.
- van der Lelie D, Taghavi S. COVID-19 and the Gut Microbiome: More than a Gut Feeling. mSystems. 2020; 5 (4): e00453-20. DOI: 10.1128/mSystems.00453-20.
- Li L, Zhong Q. Correlation of intestinal microflora with cytokines and Toll-like receptors expression in patients with ulcerative colitis. Infect Dis Inf. 2017; 30 (6): 361–4. DOI: 10.3969/j.issn.10078134.2017.06.012.
- Lu J, Ma SS, Zhang WY, Duan JP. Changes in peripheral blood inflammatory factors (TNFα and IL6) and intestinal flora in AIDS and HIV-positive individuals. J Zhejiang Univ Sci B. 2019; 20 (10): 793–802. DOI: 10.1631/jzus.B1900075.