МЕТОД
Сенсоры для анализа лекарственных препаратов, межлекарственных взаимодействий и каталитической активности ферментов
1 Научно-исследовательский институт биомедицинской химии имени В. Н. Ореховича, Москва, Россия
2 Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва
Разработка высокочувствительных методов анализа лекарственных препаратов является актуальной задачей современной биоаналитической и фармакологической химии. Анализ лекарственных препаратов необходим для мониторинга качества и чистоты, для исследования средств доставки терапевтических средств и определения эффективности включения субстанций в системы доставки, для исследования кинетических параметров реакций, катализируемых ферментами метаболизма ксенобиотиков, для исследования механизма взаимодействия лекарств с ДНК с позиций фармакогеномики. Целью работы было разработать электрохимический метод регистрации ряда лекарственных препаратов. Метод основан на реакции электроокисления органических молекул при положительных значениях потенциалов в диапазоне +(0÷1,6) В. Для анализа использовали коммерчески доступные трехконтактные электроды, получаемые методом трафаретной печати с немодифицированным графитовым рабочим электродом. Показано, что электрохимический метод позволяет одновременно детектировать несколько соединений при разных значениях рабочих потенциалов и регистрировать препараты в широком диапазоне определяемых терапевтически значимых концентраций (50 мкМ – 10 мМ), что может быть применено при работе с биологическими жидкостями (плазмой, сывороткой, кровью, мочой), для лекарственного мониторинга и анализа межлекарственных взаимодействий.
Ключевые слова: электроанализ, лекарственные препараты, вольтарен, нурофен, парацетамол, немодифицированные печатные графитовые электроды
Финансирование: работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021–2030 гг.).
Вклад авторов: Л. Е. Агафонова — проведение экспериментов, обработка результатов, написание статьи, подготовка графиков; Т. В. Булко — подготовка образцов, проведение экспериментов; А. В. Кузиков — статистическая обработка результатов, написание статьи; Р. А. Масамрех — подготовка образцов, проведение экспериментов; В. В. Шумянцева — концепция, написание статьи, анализ результатов.
Для корреспонденции: Любовь Евгеньевна Агафонова
Погодинская ул., д. 10, стр. 8, г. Москва, 119121, Россия; ur.liam@abulavonofaga
Электрохимический метод анализа — это мощный инструмент для оценки содержания, чистоты лекарства и концентрации лекарственных средств, как в фармацевтических, так и в биологических жидкостях или тканях (моче, сыворотке, плазме, крови, клеточных лизатах). Несмотря на применение различных методов оценки лекарств (таких как спектрофотометрия, колориметрия, спектрофлуориметрия, газовая хроматография-массспектрометрия, высокоэффективная жидкостная хроматография (ВЭЖХ), тонкослойная хроматография, титриметрия, капиллярный электрофорез, ВЭЖХтандемная масс-спектрометрия и термогравиметрический анализ, радиометрия, иммуноанализ) [1], электрохимические методы также востребованы вследствие их высокой чувствительности, уникальной электрохимической сигнатуры соответствующего соединения, умеренной стоимости, быстроты электрохимического метода анализа, небольшого объема пробы (2–60 мкл) и портативности оборудования. Электроанализ позволяет регистрировать несколько лекарств одновременно и исследовать их различными электрохимическими методами для повышения чувствительности анализа (циклическая и инверсионная вольтамперометрии, квадратно-волновая вольтамперометрия, дифференциально-импульсная вольтамперометрия, хроноамперометрия и спектроскопия электрохимического импеданса) [2–6].
Цитохромы Р450 — суперсемейство гем-тиолатных монооксигеназ, вовлеченных в метаболизм ксенобиотиков и эндогенных соединений [7]. Метод анализа каталитической активности этого класса гемопротеинов с помощью метода электроокисления лекарств-субстратов хорошо зарекомендовал себя в ранее опубликованной работе [4] по регистрации каталитической активности цитохрома Р450 3А4. Цитохром Р450 19A1 (CYP19A1, ароматаза) — ключевой фермент биосинтеза эстрогенов [8]. Для количественного определения продуктов CYP19A1зависимой электрокаталитической реакции ранее были разработаны методы электрохимического определения эстрона или β-эстрадиола с помощью электродов, модифицированных различными нанокомпозитными материалами [9–12]. Электрохимическое окисление эстрона или β-эстрадиола как метаболитов ароматазы может быть зарегистрировано и на коммерчески доступных трехконтактных ПГЭ [13]. Электроокисление (S)-7-гидроксиварфарина как метаболита цитохрома Р450 2С9 было применено для определения кинетических параметров этого гемопротеина [5].
Целью работы было разработать безреагентный электрохимический метод идентификации и количественного определения лекарственных средств в физиологических условиях для возможности анализировать препараты в сыворотке крови с помощью коммерчески доступных трехконтактных электродов, получаемых методом трафаретной печати с графитовым рабочим электродом.
МАТЕРИАЛЫ И МЕТОДЫ
Электрохимические измерения проводили с использованием потенциостатов PGSTAT 12 Autolab и PGSTAT 312N Autolab, (Metrohm Autolab Ins.; Нидерланды) с программным обеспечением GPES и NOVA версии 4.9.7 и 2.0 соответственно (Нидерланды). Использовали трехконтактные печатные графитовые электроды (ПГЭ, «КолорЭлектроникс»; Россия); с графитовыми рабочим и вспомогательным электродами, хлорсеребряным электродом сравнения. Диаметр рабочего электрода составлял 0,2 см (площадь 0,0314 см2). Все потенциалы приведены относительно хлоридсеребряного электрода сравнения (Ag/AgCl).
В работе использовали следующие реактивы: однозамещенный фосфат калия («Реахим»; Россия), хлорид натрия («Реахим»; Россия), диклофенак натрия (субстанция, Sigma-Aldrich; Индия), ибупрофен натрия (субстанция, Sigma-Aldrich; Индия), ацетаминофен
(лекарственная форма, «Фармстандарт-Лекарства»; Россия), мексидол (лекарственная форма, «Фармасофт»; Россия), сыворотка крови (S 1005-14, UsBiological; США).
Растворы 10 мМ аналитов готовили в 0,1 М калийфосфатном буфере (рН 7,4), содержащем 0,05 М NaCl, нужную концентрацию получали разведением в буфере и хранили при +4 °С.
Измерения проводили в режиме реального времени методами дифференциально-импульсной вольтамперометрии (ДИВА) в диапазоне потенциалов 0–1,6 В, с шагом потенциала 0,01 В, частотой 25 Гц и циклической вольтамперометрии (ЦВА). Эксперименты выполняли в аэробных условиях при комнатной температуре. В горизонтальном положении на поверхность одноразового ПГЭ, покрывая рабочий электрод, вспомогательный и электрод сравнения, наносили 60 мкл анализируемого раствора лекарства (объем, необходимый для равномерного распределения капли на электродах) [14]. Для оценки повторяемости результатов для каждой концентрации использовали не менее трех электродов.
Для расчета чувствительности и предела обнаружения строили зависимость тока пика окисления аналита от его концентрации. Полученные калибровочные зависимости использовали для расчета чувствительности (формула 1) и предела обнаружения (формула 2) [15]:
формула
где S — чувствительность, I — ток, C — концентрация лекарства, Сlim — предел обнаружения, σ — остаточное стандартное отклонение (стандартное отклонение коэффициента b уравнений регрессии).
Для освобождения сыворотки крови от белковых компонентов 2,5 мл сыворотки помещали в стеклянную пробирку на 10 мл и добавляли 2,5 мл 15% (масс./об.) раствора сульфата цинка в ацетонитриле (50/40, об./об.) или 10%-ю трихлоруксусную кислоту (1 : 10). Пробирку встряхивали в течение 20 мин и выдерживали при 4 °C в течение 15 мин, после чего центрифугировали при 13 500 об./мин в течение 5 мин. Затем супернатанты отбрасывали, и раствор использовали для последующих анализов [16]. После осаждения белков сыворотку развели в 10 раз 0,1 М калий-фосфатным буфером, содержащим 50 мМ NaCl, рН 7,4.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ключевым моментом электроанализа является обоснованный выбор типа электродов для наиболее эффективного процесса переноса электронов и регистрации молекулы, биохимического события, каталитического тока как индикатора электрокатализа [17]. Показано, что модификация рабочей поверхности электродов наноматериалами (углеродными нанотрубками, графеном, оксидом графена, наночастицами металлов) способствует повышению аналитической чувствительности сенсора [6]. Однако модифицированные ПГЭ могут приобретать фоновые характеристики, затрудняющие прямую регистрацию электроокисления/электровосстановления [18]. Для немодифицированных ПГЭ фоновые характеристики в электролитном буфере не содержат нежелательных дополнительных сигналов и имеют довольно низкие значения регистрируемого тока [5]. Кроме того, немодифицированные электроды коммерчески доступны, воспроизводимость электрохимического метода анализа высока, что является необходимой составляющей дальнейшего практического использования сенсоров для анализа лекарственных средств и оценки их чистоты, в том числе в клинико-диагностических лабораториях. В связи с этим нами разработаны методы регистрации лекарственных препаратов с использованием именно немодифицированных графитовых рабочих поверхностей электродов.
Электроаналитические характеристики лекарственных препаратов
N-ацетил-пара-аминофенол, или препарат А — жаропонижающее и обезболивающее средство, обычно используемое при слабой и умеренной боли или для снижения температуры, в том числе при вирусных и бактериальных инфекциях [3]. Было показано, что N-ацетил-п-бензохинонимин (NAPQI) является основным продуктом окисления препарата А [3]. Механизм его обезболивающего действия связан с ингибированием синтеза простагландинов в центральной нервной системе [2, 3, 19].
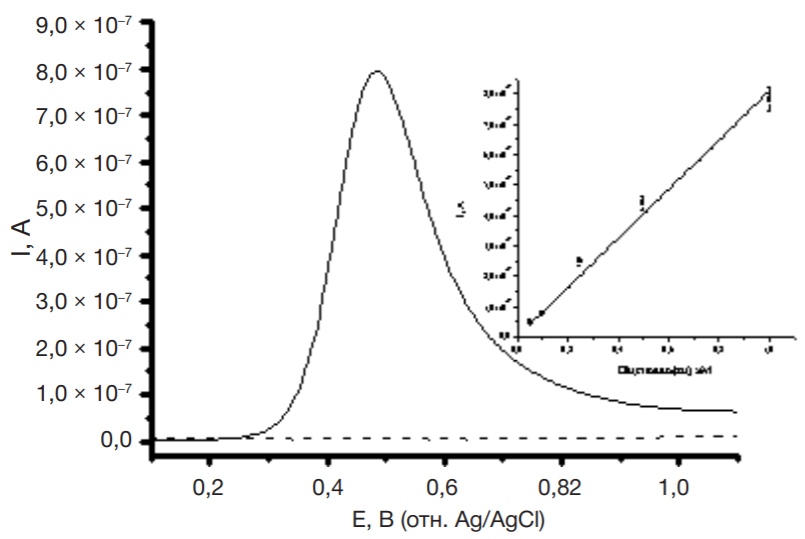
На рис. 1 представлена дифференциально-импульсная вольтамперограмма 1 мМ препарата А, полученная в диапазоне потенциалов 0–1,2 В на немодифицированных ПГЭ. В аэробных условиях окисление препарата А происходит при потенциале Eок, равном 0,50 ± 0,03 В (отн. Ag/AgCl). На вставке рисунка показан линейный рост величины тока пика окисления препарата А с ростом концентрации от 0,05 мМ до 1,00 мМ. Потенциал окисления препарата А был стабилен в пределах погрешности определения.
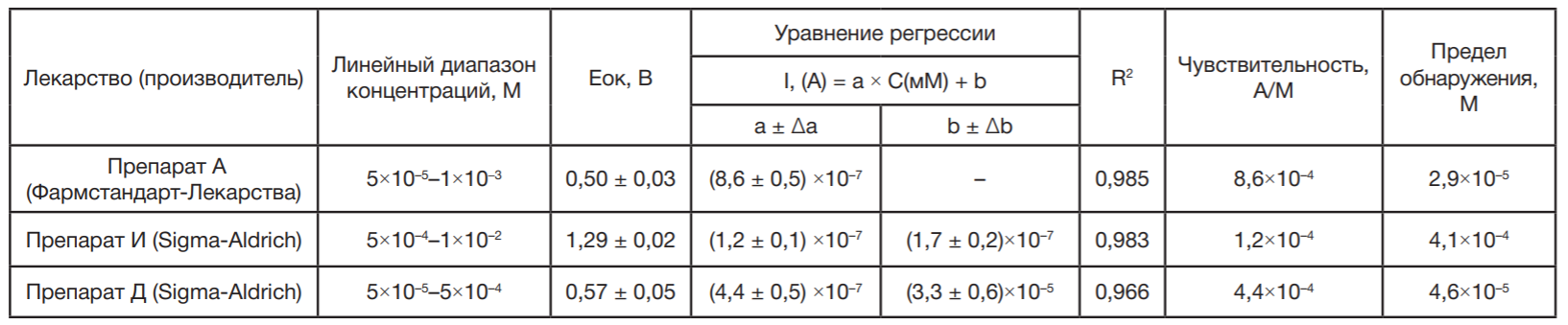
В таблице (таблица) представлены электроаналитические характеристики (диапазон концентраций, потенциал окисления, уравнение зависимости тока пика окисления от концентрации, коэффициент достоверности аппроксимации R2, а также чувствительность электрохимической системы, рассчитанная по уравнению 1, и предел обнаружения препарата А, рассчитанный по уравнению 2.
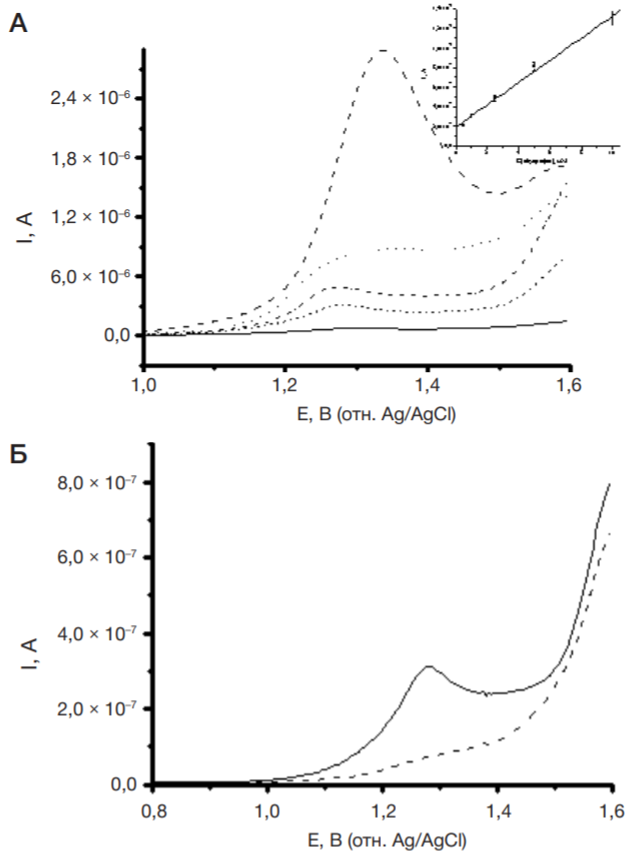
(RS)-2-(4-изобутилфенил)-пропионовая кислота, или препарат И — нестероидный противовоспалительный препарат из группы производных пропионовой кислоты, обладает болеутоляющим и жаропонижающим действием [12, 13]. На рис. 2 представлены дифференциальноимпульсные вольтамперограммы препарата И, полученные в диапазоне потенциалов 0,6–1,6 В и концентраций 0,5–10 мМ на ПГЭ. Реакция электроокисления 1 мМ препарата И происходит при высоких значениях потенциала (1,29 ± 0,02) В (таблица).
(2-(2,6-дихлоранилин)-фенилуксусная кислота, или препарат Д — нестероидный противовоспалительный препарат из группы производных фенилуксусной кислоты, в лекарственных формах ее используют в виде натриевой соли. Имеет различные торговые названия, ее назначают при многих заболеваниях, таких как ревматоидный артрит, остеоартрит, различные воспалительные процессы [20, 21]. Проявляет анальгетические, противовоспалительные, а также противораковые свойства [21]. Препарат Д подвергается активному метаболизму под воздействием глюкурозилтрансферазы с образованием ацилглюкуронида диклофенака. Под воздействием цитохромов Р450 подвергается окислительному метаболизму с образованием 4′-гидроксидиклофенака (катализируется цитохромом Р450 2С9) и 5-гидроксидиклофенака (катализируется цитохромом Р450 3А4) [22, 23].
В некоторых случаях этот препарат может вызывать нежелательные побочные реакции: желудочные кровотечения, повышение артериального давления у пациентов с синдромом Шая–Дрейджера и сахарным диабетом. При длительном приеме может развиться инфаркт или инсульт [20]. В связи с этим анализ препарата Д остается актуальной задачей биоаналитической и фармакологической химии.
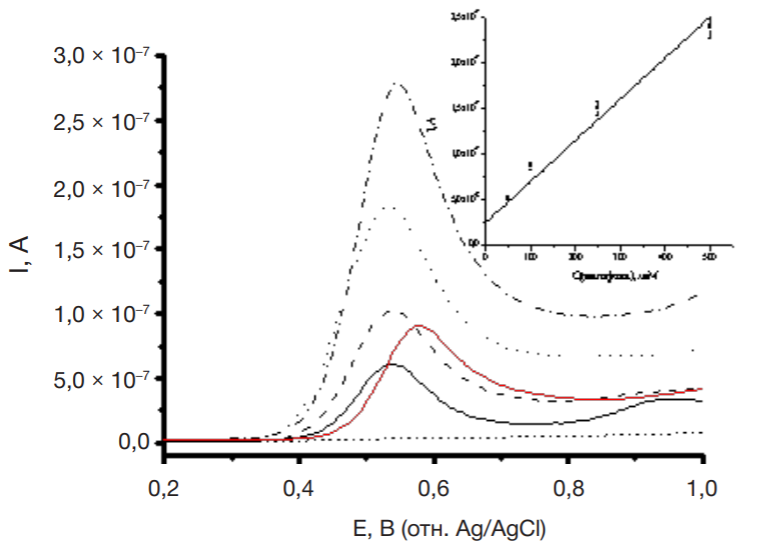
На рис. 3 представлены дифференциально-импульсные вольтамперограммы препарата Д, полученные на ПГЭ в диапазоне потенциалов 0,2–1,0 В и концентраций 50 мкМ – 500 мкМ. Потенциал окисления, равный 0,57 ± 0,05 В, был стабилен в пределах погрешности определения в исследованном диапазоне концентраций. Наблюдается линейная зависимость величины пика окисления от концентрации препарата Д (см. таблица).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для характеристики процессов электроокисления лекарств были использованы ЦВА в диапазоне скоростей сканирования 0,05–0,18 В/с. Результаты ЦВА продемонстрировали линейную зависимость токов пика окисления 1 мМ препарата А, 100 мкМ препарата Д и 5 мМ препарата И от корня квадратного скорости сканирования ν1/2 (рис. 2 (а), 4 (а), 6 (а) приложения), что свидетельствует о диффузионно-контролируемом процессе электроокисления лекарственных препаратов на немодифицированных ПГЭ в изученном диапазоне скоростей сканирования потенциала [24]. Наблюдается также линейная зависимость потенциалов пика окисления от логарифма скорости сканирования log ν (рис. 2 (б), 4(б), 6(б) приложения), что характерно для необратимых электрохимических процессов. Это подтверждено методом ЦВА: наблюдается только пик окисления 1 мМ препарата А, 100 мкМ препарата Д и 5 мМ препарата И на немодифицированных ПГЭ (рис. 1, 3 и 5 приложения), что позволяет предположить необратимость электрохимических реакций. Эти результаты согласуются с механизмами электроокисления проанализированных препаратов [2, 3, 6, 19–22, 25–30].
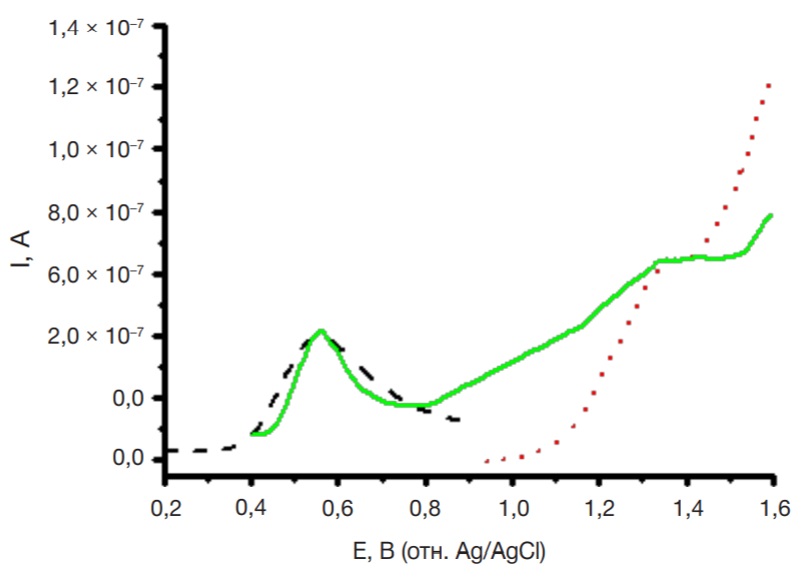
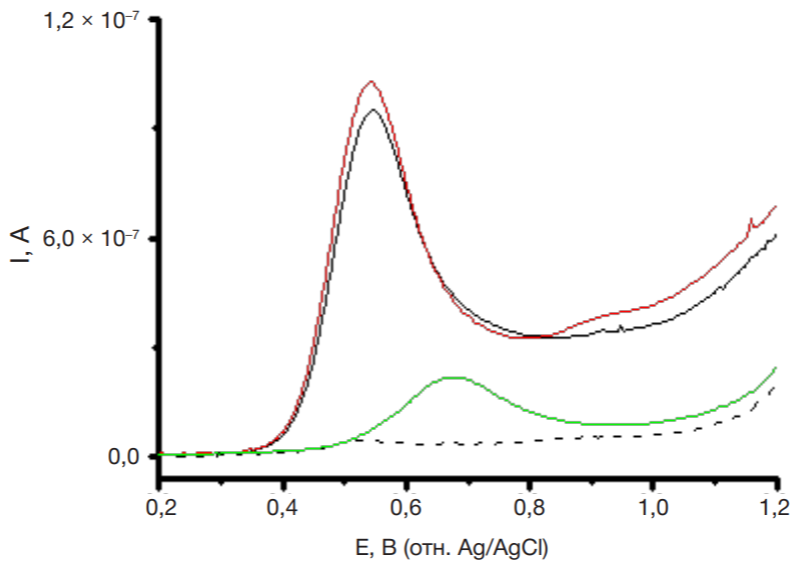
В клинической фармакологии и терапии широко используют назначение больному одновременно несколько лекарственных препаратов (полипрагмазия). При полиморбидности (назначение двух и более препаратов) необходим контроль фармакокинетических и фармакодинамических параметров. Электроанализ на основе регистрации реакции электроокисления лекарственных средств позволяет одновременно детектировать несколько соединений. Такой подход применим для определения взаимного влияния лекарственных средств. Так, антиоксидантный метаболический препарат мексидол (2-этил-6-метил-3-гидроксипиридин сукцинат, или препарат М), назначаемый для улучшения мозгового кровообращения, часто используют для различных групп пациентов с наличием сопутствующих заболеваний. С помощью ПГЭ были проанализированы комбинации препаратов Д + М (рис. 4), Д + И (рис. 5). Электроокисление препарата М регистрируется при потенциале +0,67 ± 0,06 В (рис. 4). Однако препарат М (98 мкМ) практически не влияет на реакцию электроокисления препарата Д (100 мкМ). В смеси происходит незначительное смещение потенциала окисления препарата Д в анодную область на 5 ± 2 мВ, что свидетельствует о более затрудненной реакции электроокисления. Ток пика электроокисления снижается несущественно (± 6%), что позволяет количественно определять препарат Д в присутствии препарата М (рис. 4). На рис. 5 представлена ДИВА смеси 25 мкМ препарата Д и 200 мкМ препарата И на ПГЭ. Измерения проводили в диапазоне потенциалов 0–1,6 В. Четко регистрируется разделение пиков электроокисления препаратов Д (Еок = +0,54 ± 0,02 В) и И (Еок = +1,29 ± 0,02 В), при этом сохраняется концентрационная зависимость.
Препарат Д был определен методом электрохимического окисления и в образцах сыворотки крови. Концентрация препарата Д, добавленного в сыворотку крови, составляла 100 мкМ, зарегистрированная величина тока пика окисления — 7,5 × 10–8 А (рис. 3). Как видно из вставки рис. 3 и калибровочной зависимости (см. таблица), найденная по уравнению регрессии концентрация препарата Д составила 95 ± 5 мкМ.
ВЫВОДЫ
Разработан метод анализа лекарств с использованием коммерчески доступных взаимозаменяемых немодифицированных электродов, получаемых методом трафаретной печати. Чувствительность метода соответствует терапевтически значимым диапазонам концентраций. Электроокисление лекарственных препаратов с использованием электрода как измерительного инструмента является эффективным аналитическим подходом для регистрации чистоты лекарственного средства, определения его концентрации, в том числе и в биологических жидкостях для терапевтического мониторинга. Методы количественного определения лекарственных препаратов на основе электроокисления могут быть применены для исследования каталитической активности ферментов, осуществляющих метаболические превращения I фазы, таких как цитохром Р450, флавинсодержащие монооксигеназы, альдегид оксидазы, альдегид дегидрогеназы, алкогольдегидрогеназы, карбоксилэстеразы, и для анализа активности ферментов II фазы метаболических превращений: глюкоронозилтрансферазы, сульфотрансферазы, глютатионтрансферазы. Метод применим также для регистрации сравнительных кинетических параметров полиморфных вариантов, а также генно-инженерных форм ферментов с целью разработки технологически важных изоформ биокатализаторов.
- Ahuja S, Dong MW. Handbook of pharmaceutical analysis by HPLC. Elsevier, Amsterdam, 2005; 679 p.
- Akbari M, Shayani-Jam H, Yaftian MR, Parinejad M. Electrochemical oxidation of acetaminophen in the presence of diclofenac and piroxicam — Synthesis of new derivatives and kinetic investigation of toxic quinone imine/drugs interactions. Journal of Electroanalytical Chemistry. 2018; 827: 160–6. DOI: 10.1016/J.JELECHEM.2018.09.021.
- Cernat A, Tertis M, Sandulescu R, Bedioui F, Cristea A, Cristea C. Electrochemical sensors based on carbon nanomaterials for acetaminophen detection: A review. Analytica Chimica Acta. 2015; 886: 16–28. DOI: 10.1016/j.aca.2015.05.044.
- Shumyantseva VV, Bulko TV, Kuzikov AV, Masamrekh RA, Konyakhina AYu, Romanenko I, et al. All-electrochemical nanocomposite two-electrode setup for quantification of drugs and study of their electrocatalytical conversion by cytochromes P450. Electrochimica Acta. 2020; 336: 135579. DOI: 10.1016/j.electacta.2019.135579.
- Kuzikov AV, Filippova TA, Masamrekh RA, Shumyantseva VV. Electrochemical determination of (S)-7-hydroxywarfarin for analysis of CYP2C9 catalytic activity. Journal of Electroanalytical Chemistry. 2022; 904: 115937. DOI: 10.1016/j.jelechem.2021.115937.
- Qian L, Durairaj S, Prins S, Chen A. Nanomaterial-based electrochemical sensors and biosensors for the detection of pharmaceutical compounds. Biosensors and Bioelectronics. 2021; 175: 112836. DOI: 10.1016/j.bios.2020.112836.
- Manikandan P, Nagini S. Cytochrome P450 Structure, Function and Clinical Significance: A Review. Current Drug Targets. 2018; 19 (1): 38–54. DOI: 10.2174/1389450118666170125144557.
- Hamadeh IS, Patel JN, Rusin S, Tan AR. Personalizing aromatase inhibitor therapy in patients with breast cancer. Cancer Treatment Reviews. 2018; 70: 47–55. DOI: 10.1016/j.ctrv.2018.07.014.
- Zhu Y, Liu X, Jia J. Electrochemical detection of natural estrogens using a graphene/ordered mesoporous carbon modified carbon paste electrode. Analytical Methods. 2015; 7: 8626–31. DOI: 10.1039/C5AY01833A.
- Moraes FC, Rossi B, Donatoni MC, de Oliveira KT, Pereira EC. Sensitive determination of 17β-estradiol in river water using a graphene based electrochemical sensor. Analytica Chimica Acta. 2015; 881: 37–43. DOI: 10.1016/j.aca.2015.04.043.
- Lin X, Li Y. A sensitive determination of estrogens with a Pt nanoclusters/multi-walled carbon nanotubes modified glassy carbon electrode. Biosensors and Bioelectronics. 2006; 22 (2): 253–9. DOI: 10.1016/j.bios.2006.01.005.
- Hu S, Wu K, Yi H, Cui D. Voltammetric behavior and determination of estrogens at Nafion-modified glassy carbon electrode in the presence of cetyltrimethylammonium bromide. Analytica Chimica Acta. 2002; 464 (2): 209–16. DOI: 10.1016/S0003-2670(02)00496-8.
- Kuzikov AV, Masamrekh RA, Filippova TA, Haurychenka YI, Gilep AA, Shkel TV, et al. Electrochemical oxidation of estrogens as a method for CYP19A1 (aromatase) electrocatalytic activity determination. Electrochimica Acta. 2020; 333: 135539. DOI: 10.1016/j.electacta.2019.135539.
- Kulys J, D’Costa EJ. Printed amperometric sensor based on TCNQ and cholinesterase. Biosensors and Bioelectronics. 1991; 6 (2): 109. DOI: 10.1016/0956-5663(91)87034-9.
- Patel M, Patel DA, Gajra B. Validation of Analytical Procedures: Methodology ICH-Q2B. International journal of review article pharmaceutical innovations. 2011; 1 (2): 45.
- Jalalvand AR. A study originated from combination of electrochemistry and chemometrics for investigation of the inhibitory effects of ciprofloxacin as a potent inhibitor on cytochrome P450. Microchemical Journal. 2020; 157: 105104. DOI: 10.1016/j.microc.2020.105104.
- Shumyantseva VV, Agafonova LE, Bulko TV, Kuzikov AV, Masamrekh RA, Yuan J, et al. Electroanalysis of Biomolecules: Rational Selection of Sensor Construction. Biochemistry (Moscow). 2021; 86: 140–51. DOI: 10.1134/S0006297921140108.
- Hasoň S, Fojta M, Ostatná V. Label-free electrochemical analysis of purine nucleotides and nucleobases at disposable carbon electrodes in microliter volumes. Journal of Electroanalytical Chemistry. 2019; 847 (15): 113252. DOI: 10.1016/J. JELECHEM.2019.113252.
- Fan Y, Liu JH, Lu HT, Zhang Q. Electrochemical behavior and voltammetric determination of paracetamol on Nafion/TiO2graphene modified glassy carbon electrode. Colloids and surfaces. B: Biointerfaces. 2011; 85 (2): 289–92. DOI: 10.1016/j.colsurfb.2011.02.041.
- Pandey SK, Yadav S, Goel Y, Temre MK, Singh VK, Singh SM. Molecular docking of anti-inflammatory drug diclofenac with metabolic targets: Potential applications in cancer therapeutics. Journal of Theoretical Biology. 2019; 465 (21): 117–25. DOI: 10.1016/j.jtbi.2019.01.020.
- Arisan ED, Akar RO, Rencuzogullari O, Yerlikaya OP, Gurkan AC, Akın B, et al. The molecular targets of diclofenac differs from ibuprofen to induce apoptosis and epithelial mesenchymal transition due to alternation on oxidative stress management p53 independently in PC3 prostate cancer cells. Prostate Internationa. 2019; 7 (4): 156–65. DOI: 10.1016/j.prnil.2019.09.003.
- Lazarska KE, Dekker SJ, Vermeulen NPE, Commandeur JNM. Effect of UGT2B7*2 and CYP2C8*4 polymorphisms on diclofenac metabolism. Toxicology Letters. 2018; 284: 70–8. DOI: 10.1016/j. toxlet.2017.11.038.
- Nakanishi K, Uehara S, Kusama T, Inoue T, Shimura K, Kamiya Y, et al. In vivo and in vitro diclofenac 5-hydroxylation mediated primarily by cytochrome P450 3A enzymes in common marmoset livers genotyped for P450 2C19 variants. Biochemical Pharmacology. 2018; 152: 272–8. DOI: 10.1016/j.bcp.2018.04.002.
- Mohammadi A, Moghaddam A, Alikhani E, Eilkhanizadeh K, Mozaffari S. Electrochemical quantification of fluoxetine in pharmaceutical formulation using carbon nanoparticles. Micro & Nano Letters. 2013; 8 (12): 853–7. DOI: 10.1049/MNL.2013.0671.
- Goodarzian M, Khalilzade M, Karimi F, Gupta V, Keyvanfard M, Bagheri H, et al. Square wave voltammetric determination of diclofenac in liquid phase using a novel ionic liquid multiwall carbon nanotubes paste electrode. Journal of Molecular Liquids. 2014; 197: 114–9. DOI: 10.1016/J.MOLLIQ.2014.04.037.
- Sarhangzadeh K, Khatami AA, Jabbari M, Bahari S. Simultaneous determination of diclofenac and indomethacin using a sensitive electrochemical sensor based on multiwalled carbon nanotube and ionic liquid nanocomposite. Journal of Applied Electrochemistry. 2013; 43: 1217–24. DOI: 10.1007/s10800-013-0609-3.
- Karuppiah C, Cheemalapati S, Chen S, Palanisamy S. Carboxylfunctionalized graphene oxide-modified electrode for the electrochemical determination of nonsteroidal anti-inflammatory drug diclofenac. Ionics. 2015; 21: 231–8. DOI: 10.1007/s11581014-1161-9.
- Shalauddin M, Akhter S, Basirun WJ, Bagheri S, Anuar NS, Johan MR. Hybrid nanocellulose/f-MWCNTs nanocomposite for the electrochemical sensing of diclofenac sodium in pharmaceutical drugs and biological fluids. Electrochimica Acta. 2019; 304: 32333. DOI: 10.1016/J.ELECTACTA.2019.03.003.
- Jiokeng SLZ, Tonle IK, Walcarius A. Amino-attapulgite/mesoporous silica composite films generated by electroassisted self-assembly for the voltammetric determination of diclofenac. Sensors and Actuators B Chemical. 2019; 287: 296–305. DOI: 10.1016/j.snb.2019.02.038.
- Karikalan N, Karthik R, Chen Sh-M, Velmurugan M, Karuppiah Ch. Electrochemical properties of the acetaminophen on the screen printed carbon electrode towards the high performance practical sensor applications. Journal of Colloid and Interface Science. 2016; 483: 109–17. DOI:10.1016/j.jcis.2016.08.028.