ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Активность ядерного фактора транскрипции κB в популяциях лимфоцитов у детей c псориазом
1 Национальный медицинский исследовательский центр здоровья детей, Москва, Россия
2 Центральная государственная медицинская академия Управления делами Президента РФ, Москва, Россия
3 Первый Московский государственный медицинский университет имени И. М. Сеченова, Москва, Россия
Изменения в путях передачи внутриклеточных сигналов, влияющих на активацию иммунных клеток, пролиферацию и дифференцировку кератиноцитов при псориазе, могут объяснить сложный патогенез заболевания. Одним из путей передачи внутриклеточных сигналов является NF-κB, участвующий в регуляции большого количества провоспалительных генов и влияющий на продукцию провоспалительных цитокинов, непосредственно участвующих в развитии псориаза. Целью исследования было оценить число клеток с транслокацией NF-κB в популяциях лимфоцитов у детей c псориазом в зависимости от тяжести заболевания и проводимой терапии. Обследовано 130 детей с вульгарным псориазом. В группу сравнения вошли 30 здоровых детей. Исследование проводили методом проточной цитометрии с визуализацией Amnis ImageStreamX. Показано, что число клеток с транслокацией NF-κB достоверно различалось в популяциях лимфоцитов как у детей с псориазом, так и в группе сравнения. У детей с псориазом выявлено повышение числа клеток с транслокацией NF-κB в популяциях Т-хелперов, Tact, Treg и Th17 по сравнению со здоровыми детьми (p < 0,05). Число клеток с транслокацией NF-κB у детей с псориазом соотносится с тяжестью состояния по PASI (Rмн = 0,32), BSA (Rмн = 0,31) и длительностью заболевания (p < 0,05). Определение NF-κB может быть рассмотрено как дополнительный критерий оценки тяжести состояния у детей с псориазом. Показаны различия в степени снижения числа клеток с транслокацией NF-κB через сутки после введения биологической терапии (адалимумаб, этанерцепт, устекинумаб). Исследование активации NF-κB в популяциях клеток открывает перспективы понимания патогенетических механизмов воспаления и разработки новых методов лечения псориаза.
Ключевые слова: дети, лимфоциты, вульгарный псориаз, PASI, BSA, NF-κB, биологические препараты
Финансирование: исследование выполнено в рамках государственного задания Минздрава России, № темы АААА-А19-119013090093-2.
Благодарности: авторы выражают благодарность за активное сотрудничество всем участвовавшим пациентам и выражают признательность научным сотрудникам лаборатории иммунологии и вирусологии, а также врачам-дерматологам и медицинским сестрам отделения дерматологии ФГБУ «Национального медицинского исследовательского центра здоровья детей» г. Москва, Россия, принимавших участие в этом исследовании.
Вклад авторов: Д. Г. Купцова, С. В. Петричук — концепция и дизайн исследования, набор экспериментальных данных и анализ результатов, статистическая обработка данных, написание и редактирование рукописи; О. В. Курбатова, Т. В. Радыгина — набор экспериментальных данных, редактирование рукописи; Н. Н. Мурашкин, А. А. Хотко, Р. А. Иванов — анализ результатов, редактирование рукописи.
Соблюдение этических стандартов: исследование одобрено этическим комитетом ФГАУ «НМИЦ здоровья детей» (протокол № 2 от 14 февраля 2020 г.), проведено в соответствии с этическими принципами Хельсинкской декларации, зарегистрировано в ClinicalTrials.gov ID: NCT04989296. Родители всех детей и подростков, участвовавших в исследовании, подписали добровольное информированное согласие на медицинское вмешательство в стационаре, обработку персональных данных и использование данных в научных целях.
Для корреспонденции: Дарья Геннадьевна Купцова
Ломоносовский проспект, д. 2, стр. 1, г. Москва, 119296, Россия; moc.liamg@avostpuk.gd
Псориаз является иммуноопосредованным воспалительным многофакторным заболеванием кожи со сложным патогенезом [1–3], обусловленным взаимодействием иммунной системы, локусов восприимчивости к псориазу, аутоантигенов псориаза и множества факторов окружающей среды [4]. Псориаз имеет различные клинические кожные проявления, по которым выделяют несколько форм заболевания. Самую распространенную форму — псориаз обыкновенный или вульгарный — выявляют в 90% случаев [5, 6]. Для псориаза характерны гиперпролиферация кератиноцитов, расширение кровеносных сосудов и воспалительная инфильтрация лейкоцитов в дерме, образование на коже бляшек [7].
Считается, что центральную роль в развитии воспаления кожи при псориазе играет синтез активированными Т-лимфоцитами провоспалительных цитокинов, запускающих патогенетический каскад [8]. Заболевание начинается с активации Т-лимфоцитов неизвестным антигеном или продуктом гена. После активации Т-клеток секретируется ряд провоспалительных цитокинов и хемокинов [9]. Действие цитокинов обусловливает пролиферацию кератиноцитов, гиперплазию эпидермиса, миграцию нейтрофилов, усиление реакции по пути Т-хелперов 1-го типа (Th1) [10]. Показано увеличение Т-хелперов 17-го типа (Th17) в крови и коже пациентов с псориазом во время прогрессирования кожного патологического процесса [11–13]. Также выявлено, что увеличение числа регуляторных Т-лимфоцитов (Тreg) в крови у пациентов с псориазом не приводит к подавлению воспалительной реакции из-за их функциональной несостоятельности [14, 15].
Сложный патогенез псориаза может быть объяснен изменением путей передачи внутриклеточных сигналов. Нарушение регуляции в путях передачи влияет на активацию иммунных клеток, пролиферацию и дифференцировку кератиноцитов при псориазе [16, 17]. Одним из путей передачи внутриклеточных сигналов является ядерный фактор κB (NF-κB), который впервые был открыт R. Sen и D. Baltimor в зрелых В-лимфоцитах [18]. NF-κB обладает свойством связываться с геном-промотером, кодирующим легкую цепь иммуноглобулинов kappa. Ядерный фактор κB представляет собой семейство структурно связанных транскрипционных факторов, включая RelA (р65), NF-κB1 (р50/р105), NF-κB2 (р52/р100), c-Rel и RelB. Члены семейства NF-κB функционируют как различные гетеро- и гомодимеры (p50-p65; RelB-p100), за исключением RelB. NF-κB в основной активной форме представляет собой комплекс субъединицы р65 и субъединицы р50 или р52, которые связаны с белком-ингибитором I-κB [19]. Современный метод проточной цитометрии с визуализацией Amnis ImageStreamX позволяет оценить процент клеток с транслокацией NF-κB (% активированных клеток, в которых NF-κB локализуется в ядре) в различных популяциях [20, 21].
В физиологических условиях комплекс NF-κB/I-κB является саморегулирующейся системой [22]. Активация NF-κB наступает под влиянием широкого спектра стимулов [23]. Стимулирующий агент активизирует сигнальный путь NF-κB, что приводит к высвобождению NF-κB от ингибирующего комплекса и транслокации его из цитоплазмы в ядро клетки. NF-κB участвует в регуляции большого количества провоспалительных генов и влияет на продукцию провоспалительных цитокинов, таких как IL1β, IL6, IL8, TNFα, непосредственно участвующих в развитии псориаза [24–26].
Многочисленные исследования подтвердили нарушение регуляции путей передачи сигнала NFκB при псориазе в экспериментальных моделях in vitro, моделях на животных, а также при изучении образцов биопсии кожи у больных псориазом [10, 25, 26]. Помимо этого, действие анти-TNF и гормональной терапии глюкокортикостероидами снижает уровень активного NF-κB и связанных с ним элементов пути передачи сигнала [27, 30]. Влияние других таргетных биологических препаратов на изменение числа клеток с транслокацией NF-κB в настоящее время находится на стадии изучения, однако хроническое ингибирование пути NF-κB может приводить к снижению эффективности терапии иммунозависимых заболеваний [28]. Таким образом, определение числа клеток с транслокацией NF-κB может быть перспективным инструментом в оценке тяжести состояния и эффективности проводимого лечения у пациентов с иммуноопосредованными заболеваниями. Целью данного исследования была оценка количества клеток с транслокацией NF-κB в популяциях лимфоцитов у детей c псориазом в зависимости от тяжести заболевания и проводимой терапии.
ПАЦИЕНТЫ И МЕТОДЫ
Клинические характеристики пациентов
В исследование включено 130 детей и подростков с вульгарным псориазом, из которых 42 пациента были обследованы в динамике. В группу сравнения вошли 30 здоровых детей. Возраст обследованных детей составил 1–18 лет: псориаз — Me 12,5 [8,3; 15,5], группа сравнения — Me 12,4 [7,4; 16,1]. В группе детей с псориазом было 62 девочки и 68 мальчиков, в группе сравнения — 18 девочек и 12 мальчиков, все дети европейского происхождения. Критерии включения: установленный диагноз «вульгарный псориаз». Критерии исключения: другие формы псориаза, возраст старше 18 лет и невозможность получения образца крови.
Всем пациентам была проведена оценка тяжести псориаза по индексам PASI (Psoriasis Area and Severity Index) и BSA (Body Surface Area, %). Дети с псориазом получали разную патогенетическую терапию, согласно клиническим рекомендациям и степени тяжести псориаза. Детям назначали наружные кортикостероиды и эмоленты с кератолитическим действием (n = 41), системную терапию метотрексатом (n = 28), генно-инженерные биологические препараты (ГИБП; n = 61). Влияние ГИБП оценивали у 42 пациентов с псориазом до и через сутки после введения препаратов: адалимумаба (n = 24), этанерцепта (n = 8), устекинумаба (n = 10).
Выделение мононуклеарных клеток периферической крови
Для выделения мононуклеарных клеток периферической крови (PBMC) использовали 5 мл цельной крови, взятой утром натощак в пробирки с ЭДТА и обрабатывали в тот же день. Цельную кровь разбавляли теплой средой RPMI1640 без глутамата («ПанЭко»; Россия) в соотношении
1 : 3 и осторожно наслаивали на 2 мл среды Histopaque1,077 г/см3 (Sigma-Aldricg; США), далее центрифугировали 20 мин при 2000 об./мин при комнатной температуре. Лейкоцитарное кольцо собирали в 15-миллиметровые пробирки Falcon (BD; США) и проводили отмывку средой RPMI в течение 8 мин при тех же условиях. Затем аккуратно сливали надосадочную жидкость и разбавляли клетки средой RPMI-1640 до необходимого объема.
Иммунофенотипирование лимфоцитов и оценка транслокации NF-κB из цитоплазмы в ядро
Для выделения клеточных популяций методом пошагового гейтирования использовали моноклональные антитела (МАТ), меченные флуорохромами (Beckman Coulter; США): CD19-PE, CD4-PE, CD8-PE, CD (16/56)-PE, CD127-PE, CD161-PE, CD3-ECD, CD4-PB, CD25 PE-Cy7. Оценку количества клеток с транслокацией NF-κB в популяциях лимфоцитов проводили методом проточной цитометрии с визуализацией «Amnis ImageStreamX Mk II» (Luminex; США), с применением набора «Amnis NF-κB Translocation Kit» (Luminex; США), включающего конъюгированные антитела Anti-Hu NF-κB (p50) Alexa Fluor 488 для обнаружения NF-κB и ядерный краситель 7-AAD. В пробирки со 100 мкл PBMC добавляли по 10 мкл МАТ и инкубировали 20 мин в темном месте, далее проводили анализ транслокации NF-κB согласно инструкции производителя. Исследовали следующие популяции клеток: CD3+ (Т-лимфоциты); CD3+CD4+ (Т-хелперы); CD3+CD8+ (цитотоксические Т-лимфоциты); CD3–CD19+ (В-лимфоциты); CD3–CD16+/CD56+ (NK-клетки); CD3+CD16+/CD56+ (NKT-клетки); CD3+CD4–CD8– (незрелые Т-лимфоциты); CD4+CD25+CD127high (активированные Т-хелперы, или Tact); CD4+CD25+CD127low (Treg); CD4+CD161+CD3+ (Th17).
Запись и анализ данных на проточном цитофлуориметре ImageStream Mk II
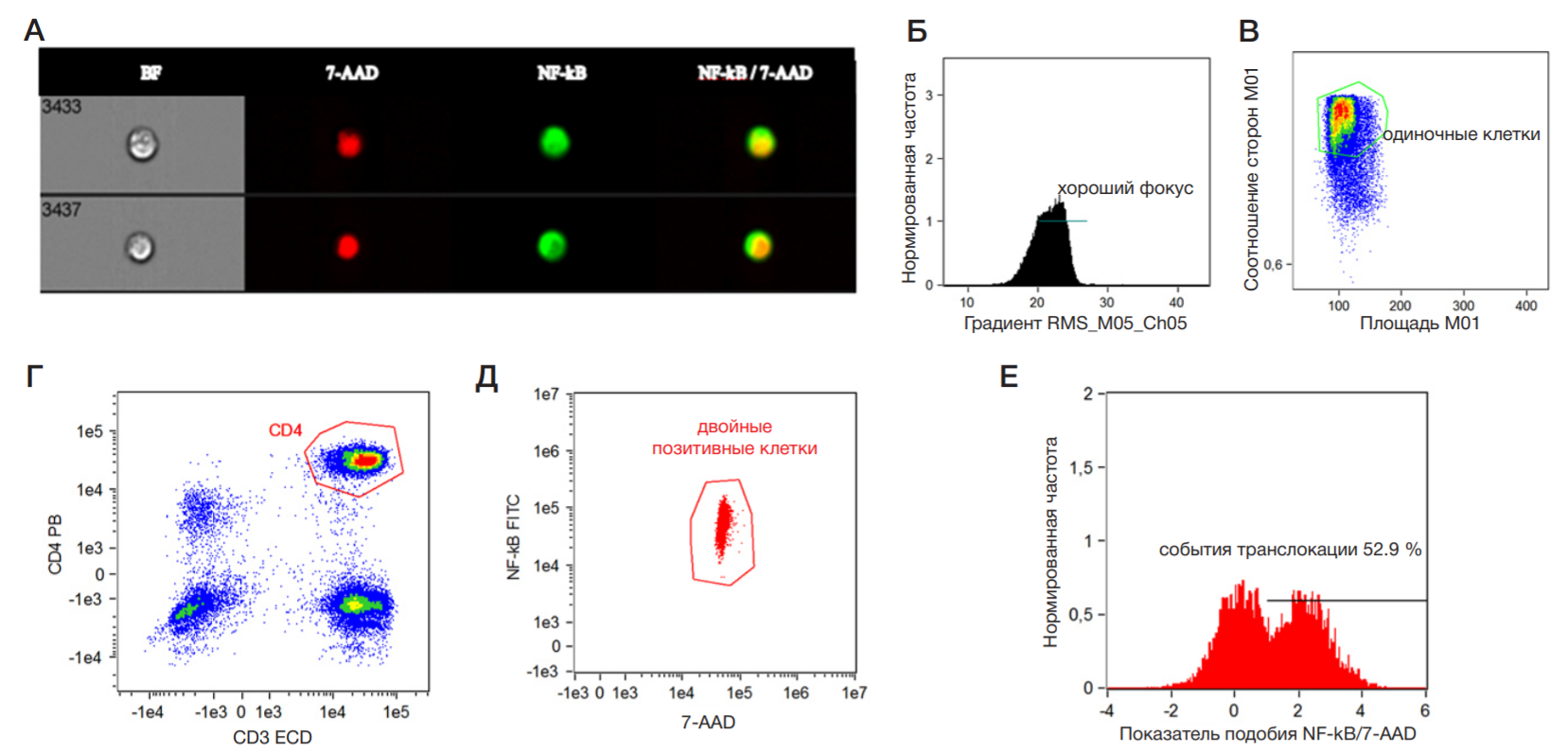
Визуализацию и запись клеток выполняли на проточном цитофлуориметре ImageStream Mk II с использованием программного обеспечения INSPIRE™ (Luminex; США) при 40-кратном увеличении и низкой скорости потока. Запись изображений для каждого образца включала не менее 20 000 событий в лимфоидном регионе для основных популяций лимфоцитов и не менее 40 000 событий для популяций Treg, Tact и Th17.
Собранные изображения анализировали с использованием программного обеспечения IDEAS® ImageStreamХ (Luminex; США) по алгоритму, представленному на рис. 1. Анализ данных начинали со спектральной компенсации в цифровом виде попиксельно для каждого изображения клеток. После компенсации проводили анализ одиночных клеток в хорошем фокусе и выделение одиночных событий (рис. 1Б, В). В исследуемой популяции лимфоцитов определяли процент двойных-позитивных клеток по интенсивности свечения NF-κB+/7-AAD+ (рис. 1Г, Д). На следующем этапе проводили оценку показателя подобия (Similarity), отражающего степень совместной локализации NF-κB и 7-AAD в исследуемой популяции клеток, независимо от морфологии (рис. 1Е). Показатель Similarity рассчитывали из коэффициента корреляции Пирсона, как описано ранее [20, 21].
Статистический анализ
Статистическую обработку полученных данных проводили при помощи пакета программы Statistica 10.0 (StatSoft; США). Описательная статистика количественных показателей представлена следующим образом: медиана
(нижний и верхний квартили) — Me (Q0,25; Q0,75). Для оценки значимости различий между группами использовали непараметрический критерий Манна–Уитни. Для построения уравнений регрессии использовали метод множественной пошаговой регрессии с исключениями. Статистически значимыми считали различия при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Оценка популяций лимфоцитов с транслокацией NF-κB у детей с псориазом и в группе сравнения
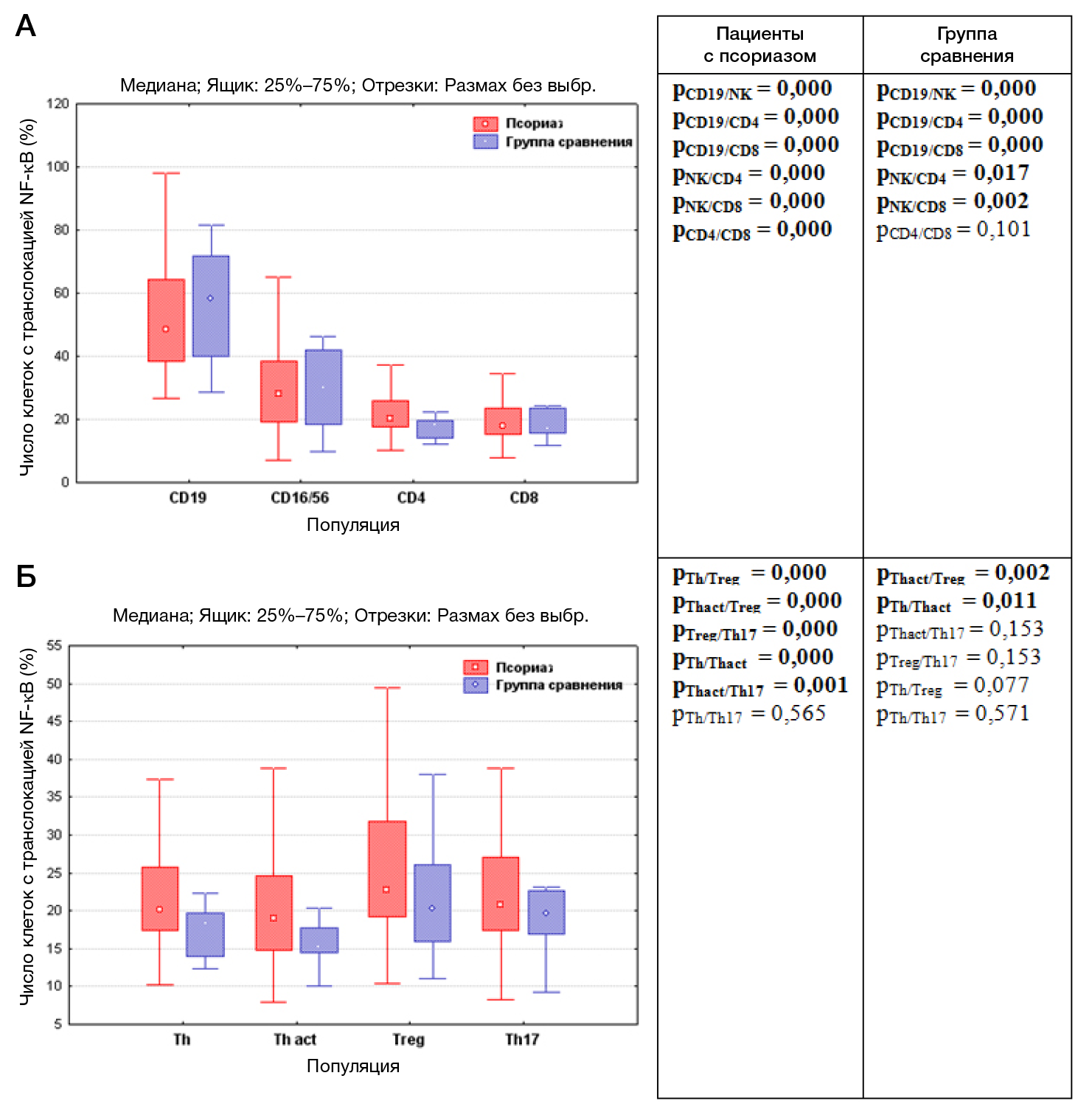
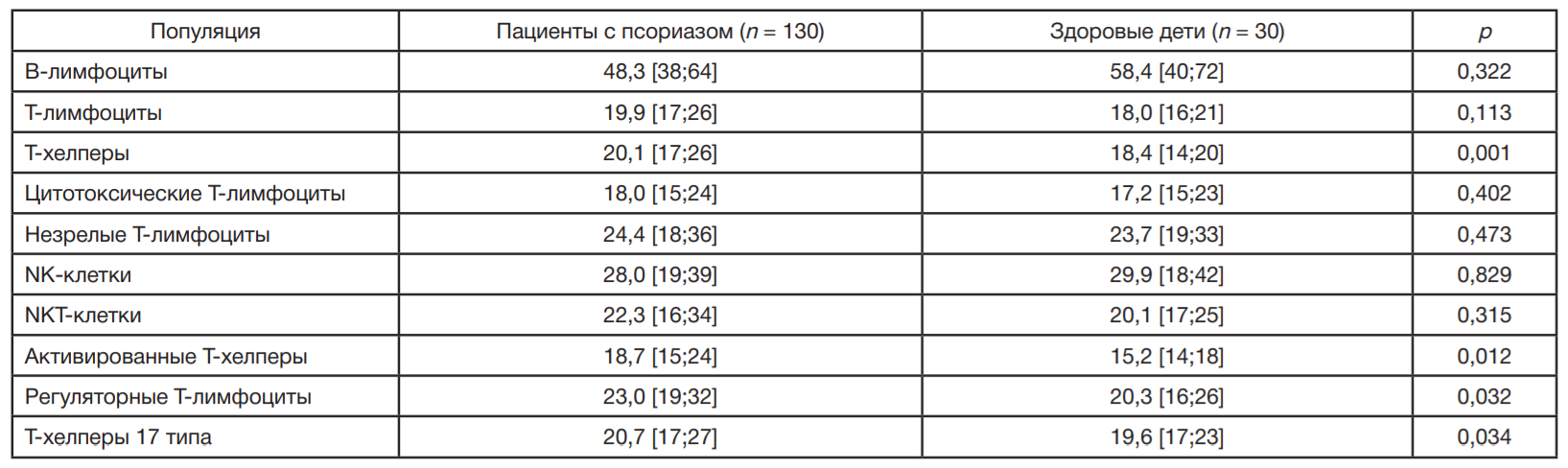
Получено достоверное увеличение процента клеток с транслокацией NF-κB в популяциях Т-хелперов (р = 0,001), Tact (р = 0,012), Treg (р = 0,032) и Th17 (р = 0,034) у детей с псориазом по сравнению со здоровыми детьми (табл. 1). У детей с псориазом в популяциях Т-лимфоцитов, цитотоксических Т-лимфоцитов, незрелых Т-лимфоцитов и NKT-клеток наблюдалась тенденция к увеличению процента клеток с транслокацией NF-κB, тогда как в популяциях В-лимфоцитов и NK-клеток — к снижению. Наибольшее число клеток с транслокацией NF-κB было выявлено в популяции B-лимфоцитов как в группе детей с псориазом, так и в группе сравнения (табл. 1).
Проведенный анализ выявил различия в содержании клеток с транслокацией NF-κB в исследуемых популяциях у обследованных детей. Число клеток с транслокацией NF-κB в популяции В-лимфоцитов было достоверно выше (р = 0,000), чем в NK-клетках, Т-хелперах и цитотоксических Т-лимфоцитах, а в популяции NK-клеток достоверно выше (р = 0,000), чем в популяции Т-хелперов и цитотоксических Т-лимфоцитов как у детей с псориазом, так и в группе сравнения, причем в 2,5 раза выше, чем в других популяциях клеток (табл. 1; рис. 2А). В группе здоровых детей число клеток с транслокацией NF-κB в популяциях Т-хелперов и цитотоксических Т-лимфоцитов одинаково (р = 0,101). В отличие от здоровых детей, у пациентов с псориазом выявлено увеличение процента клеток с транслокацией NF-κB в популяциях Т-хелперов по сравнению с цитотоксическими Т-лимфоцитами (р = 0,000; рис. 2А).
В группе здоровых детей выявлено, что число клеток с транслокацией NF-κB в популяциях Т-лимфоцитов, включая Treg, Th17 и Tact в среднем составило 15–20%. Наибольший процент клеток с транслокацией NF-κB отмечен в популяции Treg (20% клеток, а наименьший — в популяции Tact (15% клеток; р = 0,011), разница между ними была достоверна (р = 0,002; рис. 2Б).
У детей с псориазом число клеток с транслокацией NF-κB в популяциях Treg, Th17 и Tact достоверно выше, чем в группе сравнения (табл. 1). Так же как и у здоровых детей, наибольший процент клеток с транслокацией NF-κB отмечен в популяции Treg (23% клеток) и был достоверно выше, чем в популяциях Т-хелперов, Th17 и Tact (р = 0,000; рис. 2Б). Число Tact с транслокацией NF-κB, так же как в группе здоровых детей, достоверно ниже, чем в популяции Т-хелперов (р = 0,000; рис. 2Б). В отличие от здоровых детей, число Th17 с транслокацией NF-κB было достоверно выше, чем в популяции Tact (р = 0,001).
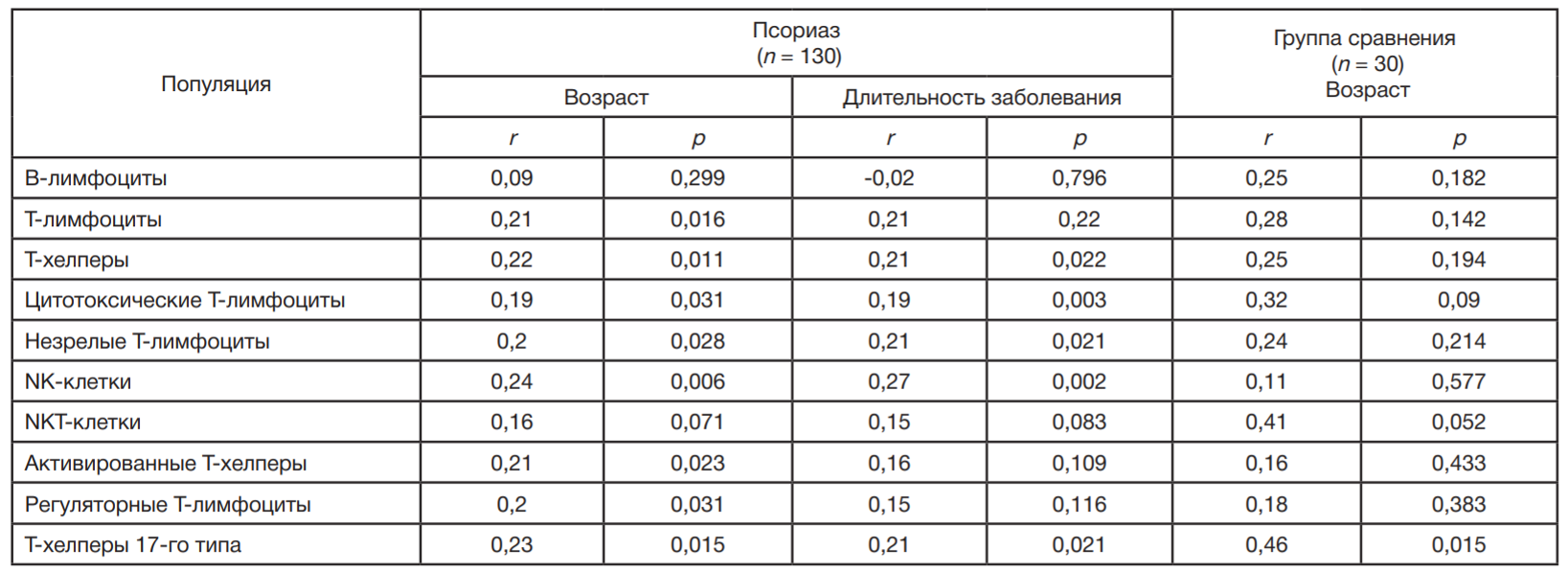
Зависимость числа клеток с транслокацией NF-κB от возраста пациентов и длительности заболевания псориазом
Анализ зависимости количества клеток с транслокацией NF-κB от возраста у здоровых детей не выявил корреляции во всех популяциях клеток, кроме Т-хелперов 17-го типа, содержание которых увеличивалось с возрастом (табл. 2). У детей с псориазом при увеличении возраста пациентов увеличивается содержание клеток с транслокацией NF-κB во всех популяциях, за исключением В-лимфоцитов и NKT-клеток. При увеличении длительности заболевания достоверно увеличивается число клеток с транслокацией NF-κB в популяциях Т-хелперов, цитотоксических Т-лимфоцитах, незрелых Т-лимфоцитах, NK-клетках и Th17 (табл. 2). У детей с псориазом выявлена корреляционная зависимость длительности заболевания и возраста пациентов (р = 0,000): чем старше ребенок, тем дольше он болеет.
Зависимость содержания клеток с транслокацией NF-κB от тяжести псориаза у детей
У обследованных детей с псориазом проводили оценку индексов PASI и BSA. Тяжесть поражения кожного покрова псориазом у детей по PASI изменялась от 0 до 70% (Me 13,3 [5; 22]), а по BSA — от 0 до 100% (Me 20 [4; 40]).
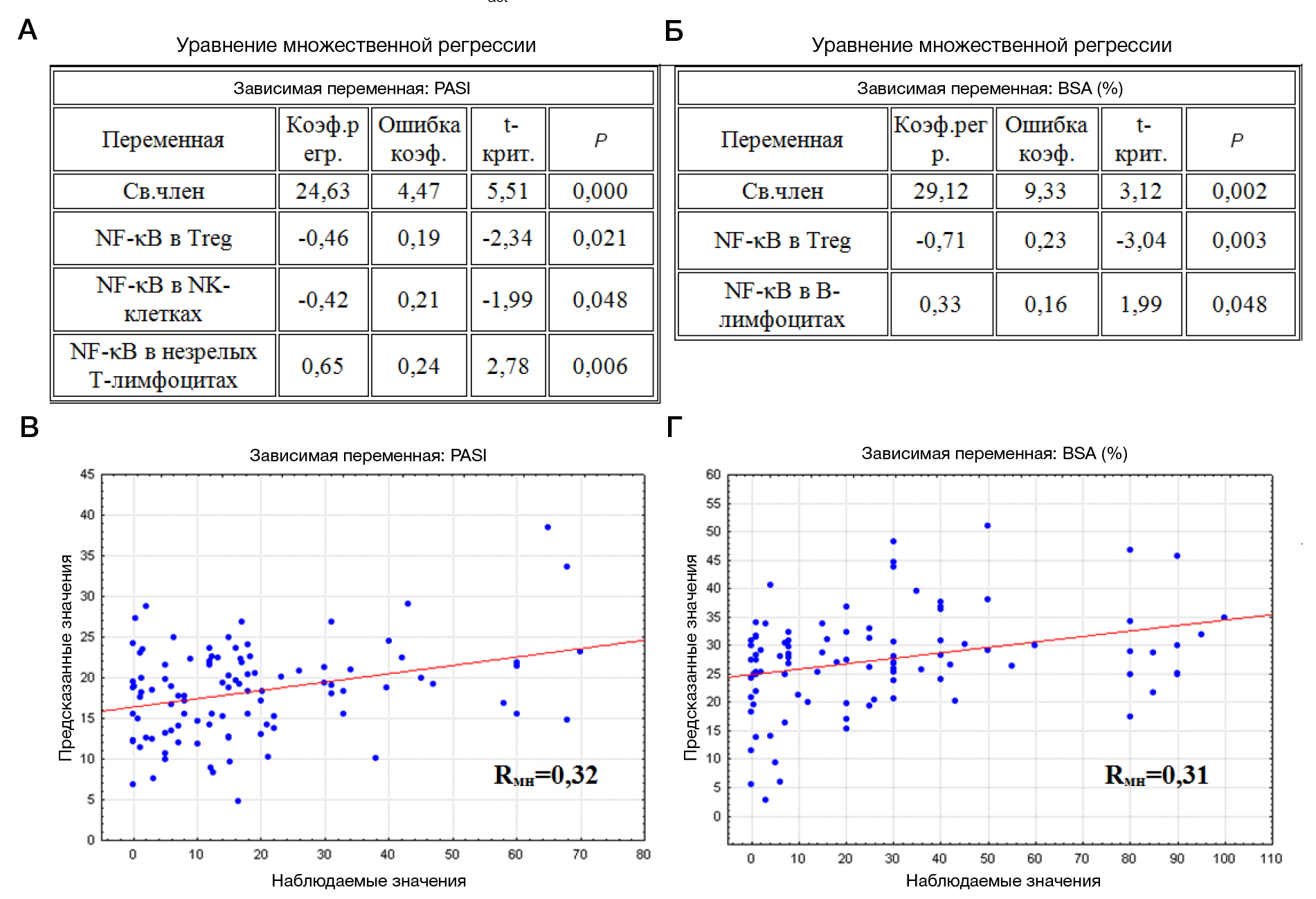
Множественный корреляционный анализ зависимости тяжести псориаза от содержания клеток с транслокацией NF-κB показал увеличение индекса PASI при снижении количества Treg и NK-клеток c транслокацией NF-κB и увеличении содержания незрелых Т-лимфоцитов с транслокацией (Rмн = 0,32; рис. 3А). Увеличение BSA наблюдается при снижении числа клеток с транслокацией NF-κB в популяции Treg и увеличении в популяции В-лимфоцитов (Rмн = 0,31; рис. 3Б).
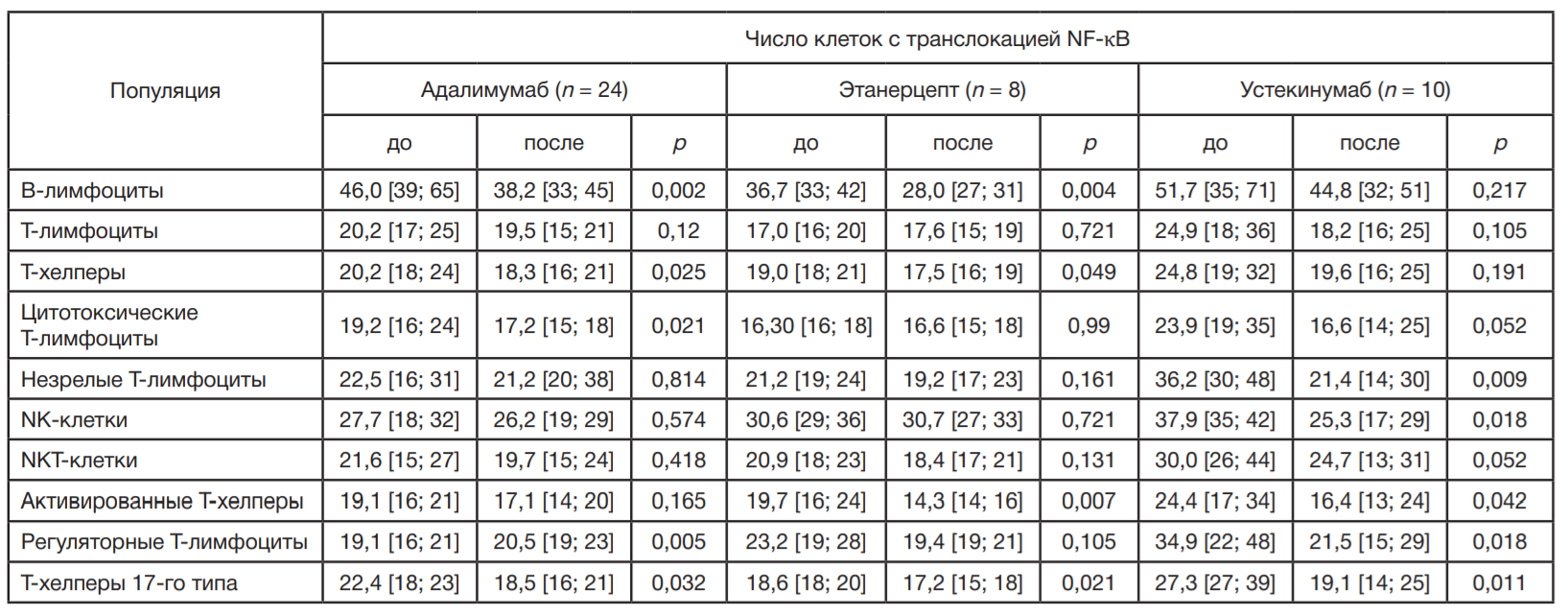
Оценка количества клеток с транслокацией NF-κB у детей с псориазом при разных видах терапии
Сравнение содержания клеток с транслокацией NF-κB в популяциях лимфоцитов у детей с псориазом при разных видах терапии не выявило достоверных различий между группами детей, проходивших разные виды терапии. Однако отклонения показателей от здоровых детей были наибольшими в группе детей на биологической терапии. Число клеток с транслокацией NF-κB в популяции Т-хелперов у детей, получавших наружную терапию, повысилось на 6%, в группе детей на метотрексате — на 10%, а в группе детей на биологической терапии — на 11,5% от уровня показателя здоровых детей. Число клеток с транслокацией NF-κB в популяции В-лимфоцитов у пациентов на наружной терапии снизилось на 17%, на метотрексате — на 4%, а у детей на биологической терапии — на 29% относительно здоровых детей.
Для оценки влияния ГИБП на число клеток с транслокацией NF-κB обследовано 42 ребенка с псориазом до введения и через сутки после введения препаратов адалимумаб, этанерцепт, устекинумаб. Через сутки после введения адалимумаба получено достоверное снижение числа клеток с транслокацией NF-κB в популяциях В-лимфоцитов, Т-хелперов, цитотоксических Т-лимфоцитов, Treg и Th17 (табл. 3).
При введении этанерцепта выявлено достоверное снижение числа клеток с транслокацией NF-κB в популяциях В-лимфоцитов, Т-хелперов, Tact и Th17. Показано достоверное снижение числа клеток с транслокацией NF-κB после введения устекинумаба в популяциях NK-клеток, незрелых Т-лимфоцитов, Tact, Treg и Th17 (табл. 3).
Интересно отметить, что биологические препараты адалимумаб и этанерцепт через сутки после введения достоверно снижают число В-лимфоцитов с транслокацией NF-κB на 20,4 и 31% соответственно, тогда как введение устикинумаба незначительно снижает их число (табл. 3). Аналогичное снижение получено в популяции Т-хелперов при введении адалимумаба (на 10,4%) и этанерцепта (на 8,6%). Значимое изменение числа цитотоксических Т-лимфоцитов с транслокацией NF-κB наблюдалось после введения адалимумаба
(табл. 3).
Число Tact с транслокацией NF-κB достоверно снижалось через сутки на введение этанерцепта (на 37,8%) и устикинумаба (на 48,7%) (табл. 3). Только введение устикинумаба влияло на снижение числа Treg с транслокацией NF-κB на 62%, тогда как введение адалимумаба показало достоверное увеличение их числа на 6%. При введении всех биологических препаратов выявлено достоверное снижение числа Th17 с транслокацией NF-κB, при этом наибольшее снижение было отмечено при введении устикинумаба (на 42,9%), тогда как на введение адалимумаба и этанерцепта — на 21,1 и 8% соответственно (табл. 3).
Помимо этого, только введение устикинумаба снижало число клеток с транслокацией NF-κB в популяциях NK-клеток на 49,8% и незрелых Т-лимфоцитов на 69%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При псориазе наблюдаются изменения сигнальных путей, включая сигнальный путь NF-κB, JAK-STATсигнальный путь, сигнальные преобразователи янускиназы и сигнальные пути Akt и Wnt [16, 17]. С помощью современной технологии ImageStreamX была проведена оценка числа клеток с транслокацией NF-κB у детей с псориазом. Полученные нами данные о числе клеток с транслокацией NF-κB согласуются с данными других авторов: наибольшее число клеток с транслокацией NF-κB было выявлено в популяции B-лимфоцитов [18].
Наши исследования показали, что у детей с псориазом повышается число клеток с транслокацией NF-κB в популяциях Т-хелперов, Treg, Tact и Th17 по сравнению с показателями здоровых детей. Это может объяснить эффект активации сигнального пути NF-κB в данных клетках, ответственных за выработку провоспалительных цитокинов, непосредственно участвующих в патогенезе псориаза [24–26].
Выявлена прямая корреляционная зависимость числа клеток с транслокацией NF-κB у детей с псориазом от возраста и длительности заболевания, у здоровых детей содержание клеток не изменялось с возрастом. Возможно, полученные нами данные зависимости числа клеток с транслокацией NF-κB у детей с псориазом от возраста обусловлены прямой зависимостью длительности заболевания псориазом от возраста обследованных детей.
С увеличением тяжести псориаза у детей по PASI и BSA снижается количество Treg с транслокацией NF-κB, что согласуется с сообщением других авторов о снижении функциональной активности Treg при псориазе [27]. Данный факт подтверждает важность оценки функциональной активности Treg, а не только их числа [14, 15]. Как один из факторов, регулирующих функциональную активность клеток, определение NF-κB можно рассматривать в качестве дополнительного критерия оценки тяжести состояния у пациентов с псориазом.
Полученные нами результаты согласуются с данными о снижении активации NF-kB под действием антиTNF терапии (адалимумаб) у взрослых пациентов с псориазом [28–30]. Наибольшее снижение числа клеток с транслокацией NF-κB у детей с псориазом в популяциях NK-клеток, незрелых Т-лимфоцитах, Tact, Treg и Th17 выявлено при использовании устекинумаба. Применение блокаторов TNFα и IL12/23 снижает число клеток с транслокацией NF-κB в разной степени в зависимости от популяции клеток и применяемой терапии. С учетом полученных данных и малоинвазивности способа оценки числа клеток с транслокацией NF-κB в цельной крови у детей с псориазом считаем данное направление исследования перспективным для диагностики тяжести заболевания и прогноза эффективности применяемой терапии.
ВЫВОДЫ
Выявлены достоверные различия между популяциями лимфоцитов по числу клеток с транслокацией NF-κB как у детей с псориазом, так и в группе сравнения. Показано повышение числа клеток с транслокацией NF-κB у детей с псориазом в популяциях Т-хелперов, Tact, Treg и Th17 по сравнению со здоровыми детьми. Число клеток с транслокацией NF-κB у детей с псориазом соотносится с тяжестью состояния и длительностью заболевания. Определение NF-κB можно рассматривать как дополнительный критерий оценки тяжести состояния у детей с псориазом. Через сутки после введения ГИБП число клеток с транслокацией NF-κB в популяциях лимфоцитов снижается в разной степени и зависит от мишени антипсориатической терапии. Исследование активации NF-κB в популяциях клеток открывает перспективы понимания патогенетических механизмов воспаления и разработки новых методов лечения псориаза.
- Gisondi P, Bellinato F, Girolomoni G, Albanesi C. Pathogenesis of Chronic Plaque Psoriasis and Its Intersection With CardioMetabolic Comorbidities. Front Pharmacol. 2020; 11: 117. DOI: 10.3389/fphar.2020.00117.
- Hugh JM, Weinberg JM. Update on the pathophysiology of psoriasis. Cutis. 2018; 102 (5S): 6–12.
- Смирнова С. В., Смольникова М. В. Иммунопатогенез псориаза и псориатического артрита. Медицинская иммунология. 2014; 16 (2): 127–38. https://doi.org/10.15789/1563-0625-2014-2-127-138.
- Hawkes JE, Chan TC, Krueger JG. Psoriasis pathogenesis and the development of novel targeted immune therapies. J Allergy Clin Immunol. 2017; 140 (3): 645–53. DOI: 10.1016/j. jaci.2017.07.004.
- Relvas M, Torres T. Pediatric Psoriasis. Am J Clin Dermatol. 2017; 18 (6): 797–811. DOI: 10.1007/s40257-017-0294-9.
- Tangtatco JAA, Lara-Corrales I. Update in the management of pediatric psoriasis. Curr Opin Pediatr. 2017; 29 (4): 434–42. DOI: 10.1097/MOP.0000000000000517.
- Deng Y, Chang C, Lu Q. The Inflammatory Response in Psoriasis: a Comprehensive Review. Clin Rev Allergy Immunol. 2016; 50 (3): 377–89. DOI: 10.1007/s12016-016-8535-x.
- Georgescu SR, Tampa M, Caruntu C, Sarbu MI, Mitran CI, Mitran MI, et al. Advances in Understanding the Immunological Pathways in Psoriasis. Int J Mol Sci. 2019; 20 (3): 739. DOI: 10.3390/ijms20030739.
- Chiricozzi A, Romanelli P, Volpe E, Borsellino G, Romanelli M. Scanning the Immunopathogenesis of Psoriasis. Int J Mol Sci. 2018; 19 (1): 179. DOI: 10.3390/ijms19010179.
- Frischknecht L, Vecellio M, Selmi C. The role of epigenetics and immunological imbalance in the etiopathogenesis of psoriasis and psoriatic arthritis. Ther AdvMusculoskelet Dis. 2019; 11: 1759720X19886505. DOI: 10.1177/1759720X19886505.
- Diani M, Altomare G, Reali E. T Helper Cell Subsets in Clinical Manifestations of Psoriasis. J Immunol Res. 2016; 2016: 7692024. DOI: 10.1155/2016/7692024.
- Solberg SM, Aarebrot AK, Sarkar I, Petrovic A, Sandvik LF, Bergum B, et al. Mass cytometry analysis of blood immune cells from psoriasis patients on biological therapy. Eur J Immunol. 2020. DOI: 10.1002/eji.202048857.
- Купцова Д. Г., Радыгина Т. В., Мурашкин Н. Н., Петричук С. В. Показатели клеточного иммунитета и клетки-супрессоры миелоидного происхождения у детей с псориазом. Иммунопатология, аллергология, инфектология. 2020; (3): 55–65. DOI: 10.14427/jipai.2020.3.55.
- Uttarkar S, Brembilla NC, Boehncke WH. Regulatory cells in the skin: Pathophysiologic role and potential targets for antiinflammatory therapies. J Allergy Clin Immunol. 2019; 143 (4): 1302–10. DOI: 10.1016/j.jaci.2018.12.1011.
- Zhang L, Li Y, Yang X, Wei J, Zhou S, Zhao Z, et al. Characterization of Th17 and FoxP3(+) Treg Cells in PaediatricPsoriasis Patients. Scand J Immunol. 2016; 83 (3): 174–80. DOI: 10.1111/sji.12404.
- Lizzul PF, Aphale A, Malaviya R, Sun Y, Masud S, Dombrovskiy V, et al. Differential expression of phosphorylated NF-kappaB/RelA in normal and psoriatic epidermis and downregulation of NF-kappaB in response to treatment with etanercept. J Invest Dermatol. 2005; 124 (6): 1275–83. DOI: 10.1111/j.0022-202X.2005.23735.x.
- Woo YR, Cho DH, Park HJ. Molecular Mechanisms and Management of a Cutaneous Inflammatory Disorder: Psoriasis. Int J Mol Sci. 2017; 18 (12): 2684. DOI: 10.3390/ijms18122684.
- Lawrence T. The nuclear factor NF-kappaB pathway in inflammation. Cold Spring HarbPerspect Biol. 2009; 1 (6): a001651. DOI: 10.1101/cshperspect.a001651.
- Sun SC, Chang JH, Jin J. Regulation of nuclear factor-κB in autoimmunity. Trends Immunol. 2013; 34 (6): 282–9. DOI: 10.1016/j.it.2013.01.004.
- George TC, Fanning SL, Fitzgerald-Bocarsly P, Medeiros RB, Highfill S, Shimizu Y, et al. Quantitative measurement of nuclear translocation events using similarity analysis of multispectral cellular images obtained in flow. J Immunol Methods. 2006; 311 (1–2): 117–29. DOI: 10.1016/j.jim.2006.01.018.
- Barteneva NS, Vorobjev IA. Imaging Flow Cytometry Methods and protocols. Methods Mol Biol. 2017; 178–88.
- Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitination: the control of NF-[kappa]B activity. Annu Rev Immunol. 2000; 18: 621–63. DOI: 10.1146/annurev.immunol.18.1.621.
- Liao G, Zhang M, Harhaj EW, Sun SC. Regulation of the NFkappaB-inducing kinase by tumor necrosis factor receptorassociated factor 3-induced degradation. J Biol Chem. 2004; 279 (25): 26243–50. DOI: 10.1074/jbc.M403286200.
- Bhatt D, Ghosh S. Regulation of the NF-κB-Mediated Transcription of Inflammatory Genes. Front Immunol. 2014; 5: 71. DOI: 10.3389/fimmu.2014.00071.
- Moorchung N, Kulaar JS, Chatterjee M, Vasudevan B, Tripathi T, Dutta V. Role of NF-κB in the pathogenesis of psoriasis elucidated by its staining in skin biopsy specimens. Int J Dermatol. 2014; 53 (5): 570–4. DOI: 10.1111/ijd.12050.
- Goldminz AM, Au SC, Kim N, Gottlieb AB, Lizzul PF. NF-κB: an essential transcription factor in psoriasis. J Dermatol Sci. 2013; 69 (2): 89–94. DOI: 10.1016/j.jdermsci.2012.11.002.
- Nussbaum L, Chen YL, Ogg GS. Role of regulatory T cells in psoriasis pathogenesis and treatment. Br J Dermatol. 2021; 184 (1): 14–24. DOI: 10.1111/bjd.19380.
- Luan L, Han S, Wang H, Liu X. Down-regulation of the Th1, Th17, and Th22 pathways due to anti-TNF-α treatment in psoriasis. IntImmunopharmacol. 2015; 29 (2): 278–84. DOI: 10.1016/j. intimp.2015.11.005.
- Johansen C, Riis JL, Gedebjerg A, Kragballe K, Iversen L. Tumor necrosis factor α-mediated induction of interleukin 17C in human keratinocytes is controlled by nuclear factor κB. J Biol Chem. 2011; 286 (29): 25487–94. DOI: 10.1074/jbc.M111.240671.
- Andres-Ejarque R, Ale HB, Grys K, et al. Enhanced NF-κB signaling in type-2 dendritic cells at baseline predicts non-response to adalimumab in psoriasis. Nat Commun. 2021; 1: 4741. Available from: https://doi.org/10.1038/s41467-021-25066-9.