ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Оценка метастатических характеристик клеток с гибридным фенотипом при раке молочной железы
1 Сибирский государственный медицинский университет, Томск, Россия
2 Научно-исследовательский институт онкологии, Томский национальный исследовательский медицинский центр Российской академии наук, Томск, Россия
3 Санкт-Петербургский государственный педиатрический медицинский университет, Санкт-Петербург, Россия
4 Областная детская клиническая больница, Владимир, Россия
Изучению циркулирующих опухолевых клеток (ЦОК) в последнее время уделяют большое внимание, благодаря их ведущей роли в формировании отдаленных метастазов. В то же время мало данных о свойствах циркулирующих клеток с одновременной экспрессией лейкоцитарных и эпителиальных маркеров и их возможной роли в опухолевой прогрессии и резистентности к химиотерапии. Целью исследования было изучить субпопуляции клеток с гибридным эпителиально-лейкоцитарным фенотипом, а также оценить признаки стволовости, эпителиально-мезенхимальный переход (ЭМП) и интегриновый интерфейс, обусловливающие их возможные метастатические свойства при раке молочной железы (РМЖ). В работу включены данные исследования 128 больных инвазивной карциномой неспецифического типа молочной железы. Для оценки популяционного состава и метастатического потенциала циркулирующих в крови клеток и клеток первичной опухоли с гибридным фенотипом использовали метод многоцветной проточной цитометрии. Суспензию клеток первичной опухоли готовили методом механической дезагрегации. В популяции клеток с гибридным фенотипом отмечена высокая степень гетерогенности, включая комбинацию признаков стволовости, ЭМП и разнообразный интегриновый интерфейс. Клетки с гибридным фенотипом принимают участие в механизмах лимфогенного и гематогенного метастазирования. При лимфогенном метастазировании метастатический потенциал этих клеток ассоциирован с признаками стволовости (р = 0,0422) и коэкспрессией β3-, β4- и αVβ5-интегринов (р = 0,0338). При гематогенном метастазировании метастатический потенциал гибридных клеток ассоциирован с признаками стволовости (р = 0,015) и не связан с признаками ЭМП и экспрессией интегринов.
Ключевые слова: циркулирующие опухолевые клетки, интегрины, гибридные клетки, метастазы, стволовость, эпителиально-мезенхимальный переход
Финансирование: работа выполнена при финансовой поддержке гранта РНФ 21-15-00140.
Вклад авторов: Р. Х. Мухамеджанов — анализ литературы, получение и статистическая обработка результатов, написание статьи; Е. С. Григорьева — получение и анализ данных, написание статьи; Л. А. Таширева — дизайн исследования, редактирование статьи; В. М. Перельмутер — интерпретация результатов, редактирование статьи; М. В. Завьялова — планирование исследования, редактирование статьи; О. Е. Савельева — планирование и руководство исследованием, анализ и интерпретация результатов, написание статьи.
Соблюдение этических стандартов: исследование одобрено этическим комитетом НИИ онкологии Томского НИМЦ (протокол № 10 от 24 апреля 2015 г.), проведено в соответствии с федеральными законами Российской Федерации (№ 152, 323 и др.) и Хельсинкской декларацией 1964 г. и всеми последующими дополнениями и изменениями, регламентирующими научные исследования на биоматериале, полученном у людей. Все участники подписали информированное добровольное согласие об участии в исследовании.
Для корреспонденции: Ольга Евгеньевна Савельева
ул. Литовская, д. 2, г. Санкт-Петербург, 194100; ur.liam@anihcehc_aglo
Изучению циркулирующих опухолевых клеток (ЦОК) в последнее время уделяют большое внимание. Это обусловлено их ведущей ролью в формировании отдаленных метастазов и, как следствие, в неблагоприятных исходах онкологических заболеваний. В настоящий момент имеются данные об их субпопуляционном составе [1], стволовых свойствах [2], эпителиально-мезенхимальном переходе (ЭМП) [3], резистентности к проводимой химиотерапии [4], а также опубликованы данные их геномного профилирования [5]. Кроме того, показано значение экспрессии интегринов на ЦОК для метастазирования при раке молочной железы (РМЖ), а интегриновый интерфейс ЦОК может быть связан с локализацией отдаленных метастазов [6–7]. Представлены также данные о связи количества этих клеток в периферической крови с выживаемостью и риском развития отдаленных метастазов при РМЖ [8], легкого [9], яичников [10], колоректального рака [11] и др. Так, в 2019 г. было показано, что наличие ЦОК с признаками стволовости и частичного ЭМП ассоциировано с неблагоприятным исходом заболевания и снижением общей выживаемости. Клетки с тем же фенотипом показали себя резистентными к химиотерапии [12].
При изучении различных популяций ЦОК нами были обнаружены необычные клетки с одновременной экспрессией лейкоцитарного маркера CD45 и эпителиального маркера CD326 (EpCAM). Оказалось, что другие исследователи получали схожие результаты. Так, в крови пациенток с РМЖ были обнаружены клетки с фенотипом CD45+CK+EpCAM+, среди которых в 90% случаев была отмечена и экспрессия маркера макрофагов CD68 [13]. Клетки с фенотипом CD45+EpCAM+ были обнаружены в первичной опухоли и плевральном выпоте у всех обследованных пациентов с немелкоклеточным раком легкого, причем большее процентное содержание таких клеток было ассоциировано с плохим прогнозом [14].
Наиболее вероятным механизмом образования клеток с одновременной экспрессией лейкоцитарных и эпителиальных маркеров является гибридизация (межклеточное слияние) опухолевых клеток с макрофагами или лейкоцитами. Образование гибридных клеток отмечено при многих физиологических процессах организма, таких как образование мышечной и костной ткани, заживление ран [15]. Физиологическую роль CD45+EpCAM+-клеток подтверждает их обнаружение в крови у здоровых доноров. Однако биологическое значение этих клеток, а также их роль в физиологических и патологических процессах до сих пор не ясны.
В связи с малоизученностью клеток с одновременной экспрессией лейкоцитарных и эпителиальных маркеров и данных об их возможной роли в опухолевой прогрессии и резистентности к химиотерапии [16] целью нашего исследования было изучить субпопуляции клеток с гибридным эпителиально-лейкоцитарным фенотипом, а также оценить признаки стволовости, ЭМП и интегриновый интерфейс, обусловливающие их возможные метастатические свойства при РМЖ.
ПАЦИЕНТЫ И МЕТОДЫ
Пациенты
В работу включены результаты исследования 128 пациентов. Критерии включения в исследование: наличие инвазивной карциномы неспецифического типа молочной железы; возраст от 29 до 76 лет (средний возраст: 52,56 ± 11,57; T1-4N0-3M0-1), проходивших лечение в клиниках НИИ онкологии Томского НИМЦ в период с 2015 по 2020 гг., включительно. Критерии исключения: наличие других гистологических типов рака молочной железы; наличие первично множественных злокачественных опухолей; наличие хронических воспалительных заболеваний в стадии обострения. Для оценки популяционного состава и метастатических характеристик циркулирующих клеток с гибридным фенотипом венозную кровь забирали у 108 пациентов до проведения неоадъювантной химиотерапии (НАХТ). Оценку ассоциации клеток с гибридным фенотипом с наличием лимфогенных и гематогенных метастазов проводили в группе пациентов, которым не проводили НАХТ (n = 79). Для оценки свойств популяций клеток с гибридным фенотипом первичной опухоли проводили исследование операционного материала, полученного у 35 пациентов в результате хирургического лечения (радикальной мастэктомии или секторальной резекции ткани первичной опухоли молочной железы). Неоадъювантную терапию указанным пациентам не назначали. Основные клиникоморфологические параметры представлены в табл. 1.
Подготовка образцов для проточной цитометрии
Венозную кровь брали у больных до проведения курсов НАХТ и хирургического этапа лечения утром натощак в объеме 12 мл в вакуумные пробирки с ЭДТА. Из всего объема крови готовили клеточный концентрат путем отстаивания при 37 °С в течение 90 мин под углом в 45° с последующим сбором белого кольца с клетками на границе осадка эритроцитов и отделившейся плазмы крови, а также всего надосадка, согласно методике Р. А. Поспеловой [17].
Свежие образцы опухоли подвергали механической дезагрегации с использованием BD Medimachine System (BD; США) для получения клеточных суспензий. Общую клеточность полученных суспензий определяли с помощью счетчика клеток Luna-II (Logos Biosystems; Корея).
Проточная цитометрия образцов и обработка данных
После Fc-блокирования раствором Human TruStain FcX™ Fc Receptor Blocking Solution (Biolegend; США) в клеточный концентрат и/или суспензию клеток первичной опухоли добавляли по 5 мкл моноклональных антител BV570 anti-human CD45 (клон HI30; Sony Biotechnology, США), BV650 anti-human CD326 (EpCAM) (клон 9C4; Sony Biotechnology, США), BV510 anti-human CD44 (клон G44-26; BD Horizon, США), PerCP/Cy5.5 anti-human CD24 (клон ML5; Sony Biotechnology, США), PE/Cy7 anti-human N-Cadherin (клон 8C11; Sony Biotechnology, США) и 7-AAD Viability Staining Solution (Sony Biotechnology; США) и инкубировали в темноте, при комнатной температуре 20 мин. В клеточный концентрат добавляли также по 5 мкл моноклональных антител BV 421-anti-β3 integrin (клон VI-PL2; BD Biosciences, США), Alexa Fluor 488-anti-β4 integrin (клон 422325; R&D Systems, США), BV Alexa Fluor 750-antiαVβ5 integrin (клон P5H9; R&D Systems, США). Параллельно ставили неокрашенный контроль. После инкубации для лизирования эритроцитов к образцам добавляли 500 мкл буфера OptiLyse C (Beckman Coulter; Франция) и отмывали в 2 мл раствора CellWASH (BD Biosciences; США) в течение 10 мин при 300 g с последующим удалением надосадка. На этапе внутриклеточного окрашивания к каждому неокрашенному и окрашенному образцу добавляли 250 мкл раствора BD Cytofix/Cytoperm (BD Biosciences; США) и инкубировали в темноте 30 мин при 4 °С, затем дважды отмывали в 1 мл буфера BD Perm/Wash (BD Biosciences; США), центрифугируя при 300 g 6 мин. К пробам добавляли 50 мкл буфера BD Perm/Wash (BD Biosciences; США), в окрашенную пробу добавляли по 5 мкл антител AF647-anti-human CK7/8 (клон CAM5.2; BD Pharmingen, США) и инкубировали при 4 °С в течение 20 мин. Затем отмывали каждую пробу в 1 мл буфера CellWASH (BD Biosciences; США) центрифугированием при 300 g 6 мин. На заключительном этапе к осадку добавляли 500 мкл Cell Staining Buffer (Sony Biotechnology; США) и ресуспендировали образец.
Контроль неспецифического окрашивания проводили с помощью соответствующих изотипических антител. В качестве положительного контроля для антител к эпителиальным маркерам EpCAM и CK7/8 и отрицательного контроля для CD45 использовали клеточную линию РМЖ MCF-7. В качестве отрицательного контроля антител к вышеуказанным эпителиальным маркерам и положительного контроля для CD45 использовали клеточную линию гистиоцитарной лимфомы U937.
Анализ образцов осуществляли на проточном цитометре Novocyte 3000 (ACEA Biosciences; США) с помощью NovoExpress 1.3.0 (ACEA Biosciences; США). Концентрацию циркулирующих клеток рассчитывали на 1 мл крови, концентрацию клеток первичной опухоли — на 1000 опухолевых клеток. При гейтировании клеток с гибридным фенотипом клетки сначала анализировали в режиме FSC vs SSC, затем выделяли синглеты в режиме FSC-A vs FSC-H, далее выделяли жизнеспособные клетки по негативному окрашиванию 7-AAD, затем анализировали параметры флюоресценции клеток в соответствующих каналах. Стратегия гейтирования клеток с гибридным фенотипом представлена на рис. 1.
Статистический анализ данных
Статистическую обработку данных проводили с помощью программ IBM SPSS Statistics 22 (Armonk; USA) и GraphPad Prism 8.3.1 (GraphPad Software; США). Все исследуемые параметры были проверены на соответствие нормальному закону распределения с помощью критерия Шапиро– Уилка. Параметры описывали с помощью медианы (Ме) и интерквартильного интервала (Q1–Q3). Оценку различий параметров осуществляли при помощи критериев Манна–Уитни и Уилкоксона. Для оценки различий частот встречаемости признаков использовали точный критерий Фишера. Для определения взаимосвязи между признаками рассчитывали коэффициент корреляции Спирмена. Различия считали статистически значимыми при р < 0,05 (5%).
В качестве многофакторного метода для оценки взаимосвязи признаков, а также построения прогностических моделей использовали метод логистической регрессии. Пороговый уровень показателей для построения математических моделей определяли с помощью ROC-анализа. Вероятность развития события рассчитывали по формуле: Р = еY/(1 + еY), где Р — значение вероятности развития признака; Y — значение уравнения регрессии; е — математическая константа, равная 2,72. При вероятности Р ≥ 50% риск развития события считали высоким, при вероятности Р < 50% — низким. Различия считали статистически значимыми при р < 0,05 (5%).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Субпопуляционный состав клеток с гибридным фенотипом
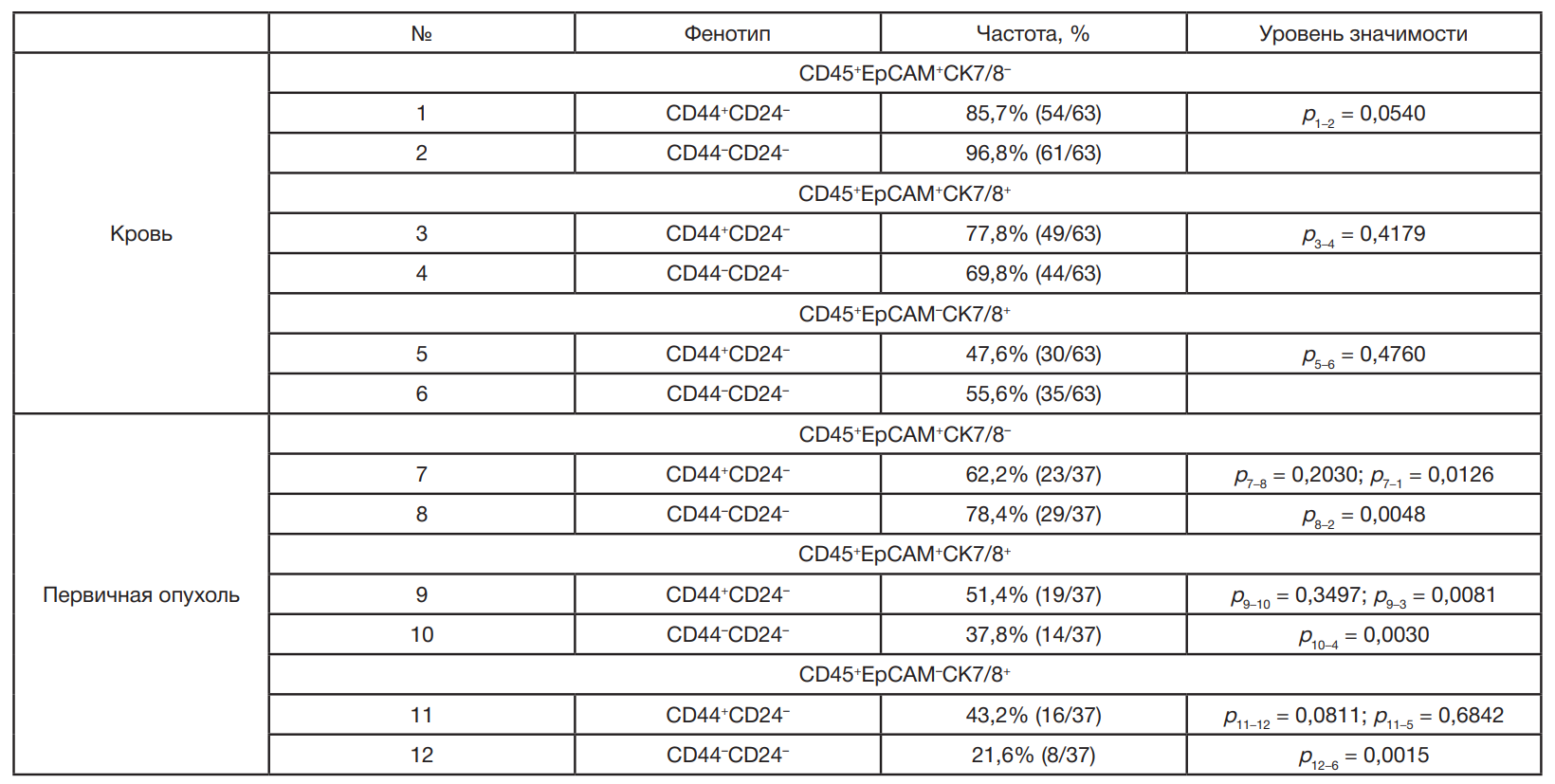
С помощью метода проточной цитометрии была проведена оценка экспрессии лейкоцитарного маркера CD45 и эпителиальных маркеров EpCAM и CK7/8 в циркулирующих клетках и клетках первичной опухоли. Популяции CD45+клеток с коэкспрессией двух эпителиальных маркеров (CD45+EpCAM+CK7/8+) и моноэкспрессией одного из эпителиальных маркеров (CD45+EpCAM+CK7/8–, CD45+EpCAM–CK7/8+) были обнаружены в крови и первичной опухоли большинства пациентов (табл. 2).
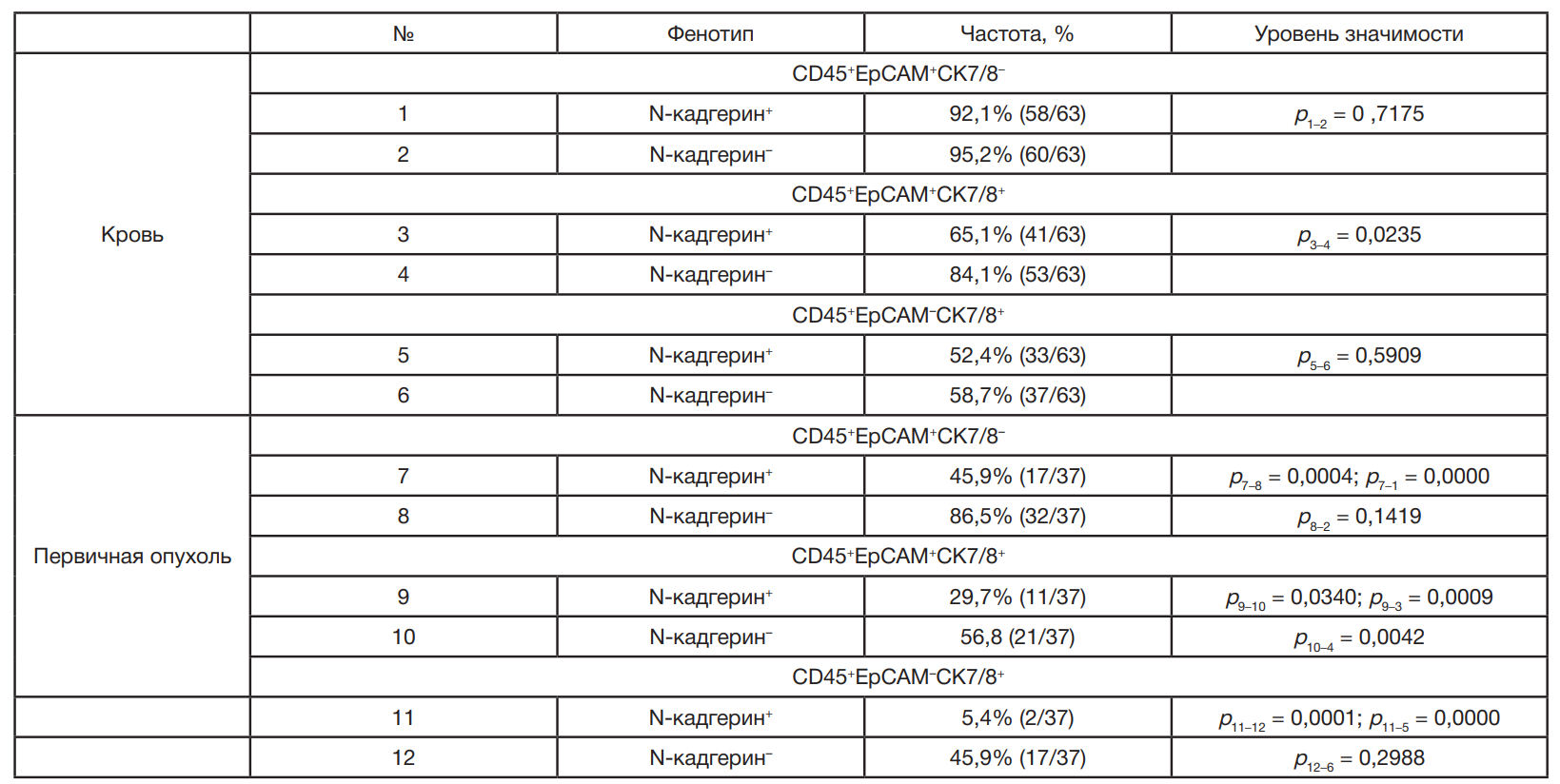
Самая часто встречающаяся и многочисленная популяция и в крови, и в первичной опухоли была представлена клетками с фенотипом CD45+EpCAM+CK7/8– (табл. 2; рис. 2А).
Статистически значимых корреляционных взаимосвязей количества клеток с гибридным фенотипом в крови и первичной опухоли больных РМЖ обнаружено не было.
Оценка метастатических характеристик клеток с гибридным фенотипом
Приобретение опухолевыми клетками, в том числе и ЦОК, признаков стволовости и ЭМП ассоциировано с их способностью к самообновлению, резистентности к противоопухолевой терапии и увеличению их метастатического потенциала [3, 12, 18]. Кроме того, экспрессия интегринов в ЦОК играет значимую роль в метастазировании и, вероятно, способствует нацеливанию этих клеток в отдаленные органы, определяя тем самым локализацию будущих метастазов [6–7]. Аналогичными свойствами могут обладать и ЦОК с гибридным фенотипом. В связи с этим мы провели анализ метастатического потенциала клеток с гибридным фенотипом, циркулирующих в крови, и клеток первичной опухоли путем оценки признаков стволовости, ЭМП и экспрессии интегриновых рецепторов.
Оценка признаков стволовости
Результаты анализа признаков стволовости в популяциях клеток с гибридным фенотипом в крови и первичной опухоли методом проточной цитометрии представлены в табл. 3 и на рис. 2Б. Установлено, что признаки стволовости встречались во всех популяциях клеток с гибридным фенотипом, как в крови, так и в первичной опухоли. Однако достоверных различий в частотах встречаемости клеток со стволовыми свойствами и без таковых обнаружено не было. Клетки с фенотипом CD45+EpCAM+CK7/8–CD44+CD24– и CD45+EpCAM+CK7/8+CD44+CD24– в первичной опухоли встречались реже, чем в крови (р = 0,0126 и р = 0,0081 соответственно) (табл. 3).
При количественной оценке популяций клеток с гибридным фенотипом было установлено, что в крови преобладали клетки с моноэкспрессией эпителиального маркера EpCAM без признаков стволовости CD45+EpCAM+CK7/8–CD44–CD24– (р = 0,0306), в опухоли среди CD45+EpCAM–CK7/8+-клеток было достоверно больше гибридов со стволовыми свойствами (р = 0,0233) (рис. 2Б).
Оценка признаков ЭМП
Оценку признаков ЭМП в популяциях клеток с гибридным фенотипом проводили путем детекции в них N-кадгерина методом проточной цитометрии (табл. 4; рис. 2В).
Экспрессия N-кадгерина встречалась во всех популяциях клеток с гибридным фенотипом и в крови, и в первичной опухоли. Однако частота встречаемости N-кадгерин-позитивных клеток была достоверно ниже, чем N-кадгерин-негативных клеток (табл. 4).
При количественной оценке клеток с признаками ЭМП было установлено, что и в крови, и в первичной опухоли клеток с гибридным фенотипом, экспрессирующих N-кадгерин, было меньше, чем клеток без его экспрессии (рис. 2В).
Оценка интегринового интерфейса
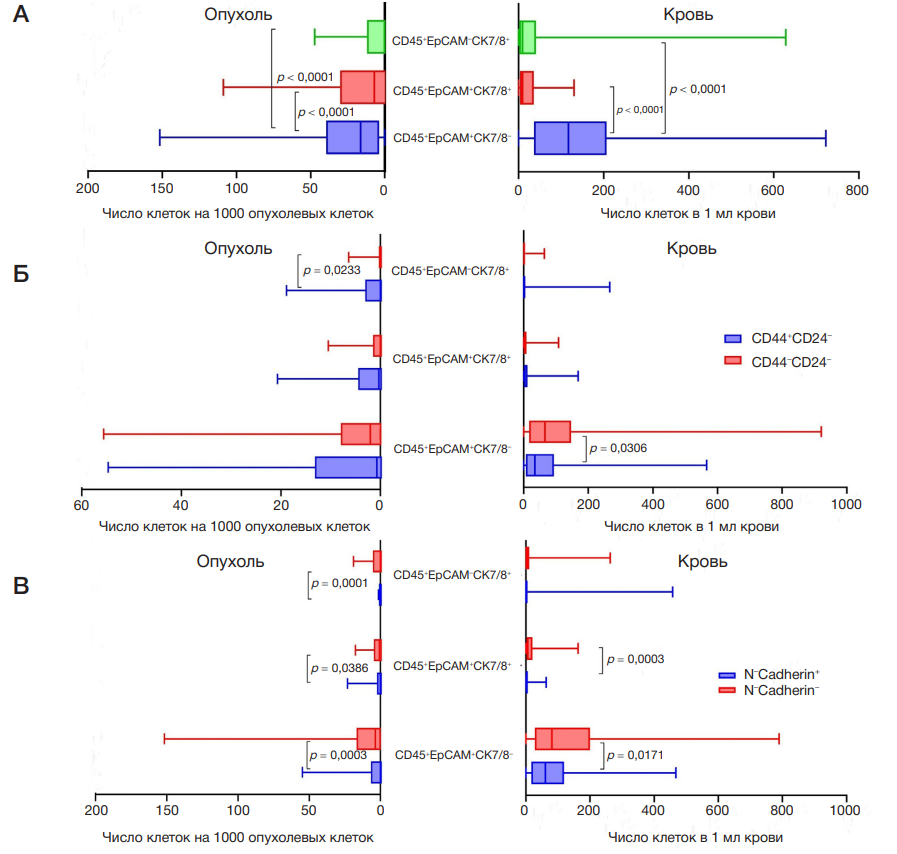
Результаты анализа экспрессии интегриновых молекул β3, β4 и αVβ5 в циркулирующих клетках с гибридным фенотипом методом проточной цитометрии представлены в табл. 5 и на рис. 3. При оценке частоты встречаемости изучаемых клеток было установлено, что реже всего обнаруживаются клетки с фенотипом β3+β4+αVβ5+ (р = 0,0003) (табл. 5).
Количество циркулирующих клеток с гибридным фенотипом и экспрессией β3- и/или β4- и/или αVβ5интегриновых рецепторов (ITG+) было достоверно выше (р = 0,0002), чем клеток без экспрессии указанных молекул (ITG–) (рис. 3).
Ассоциация метастатических характеристик клеток с гибридным фенотипом с наличием лимфогенных метастазов
Сравнительный анализ метастатических характеристик клеток с гибридным фенотипом позволил выявить ассоциацию клеток с признаками стволовости и экспрессией интегриновых молекул с наличием лимфогенных метастазов (ЛМ).
Так, количество «стволовых» CD45+EpCAM+CK7/8– CD44+CD24–-клеток оказалось достоверно выше (р = 0,0422) в крови пациенток с ЛМ, чем у пациенток без такового (рис. 4).
У пациенток без ЛМ количество клеток ITG– и ITG+ с гибридным фенотипом было достоверно выше, чем у пациенток с наличием ЛМ (р = 0,0103 и р = 0,0031 соответственно) (рис. 4). В то же время у больных с ЛМ отмечалось достоверно большее количество ITG+ клеток (р = 0,0002), по сравнению с количеством ITG–-клеток. Также было обнаружено увеличение количества β3+β4+αVβ5+-клеток (р = 0,0338) в крови пациенток с ЛМ по сравнению с пациентками без метастазов (рис. 4).
Математические модели, построенные с помощью метода логистической регрессии, подтверждают роль клеток с гибридным фенотипом в процессах лимфогенного метастазирования.
Так, риск развития ЛМ у больных РМЖ оказался связан с наличием в крови клеток с фенотипом CD45+EpCAM+CK7/8+ и CD45+EpCAM–CK7/8+ с признаками стволовости. Математическая модель имеет следующий вид:
Y = – 2,4 + 2,7X1 – 1,0X2,
где Y — значение уравнения регрессии; –2,4 — значение коэффициента регрессии свободного члена; X1 — значение уровня CD45+EpCAM+CK7/8+-гибридных клеток в крови (X1 = 1 при количестве менее 14,94 клеток в 1 мл крови, X1 = 2 при количестве более 14,94 клеток в 1 мл крови); 2,7 — значение коэффициента регрессии этого признака; X2 — значение уровня CD45+EpCAM–CK7/8+CD44+CD24–клеток в крови (X2 = 1 при количестве более 2,49 клеток в 1 мл крови, Х2 = 2 при количестве менее 2,49 клеток в 1 мл крови); –1,0 — значение коэффициента регрессии этого признака.
Чувствительность модели составляет 79%, специфичность — 85% (χ2 = 18,49; р = 0,0001).
Таким образом, исследование показало наличие у клеток с гибридным фенотипом свойств стволовости и коэкспрессии β3-, β4- и αVβ5-интегринов, которые, вероятно, вносят вклад в механизмы формирования лимфогенных метастазов при РМЖ.
Ассоциация метастатических характеристик клеток с гибридным фенотипом с наличием гематогенных метастазов
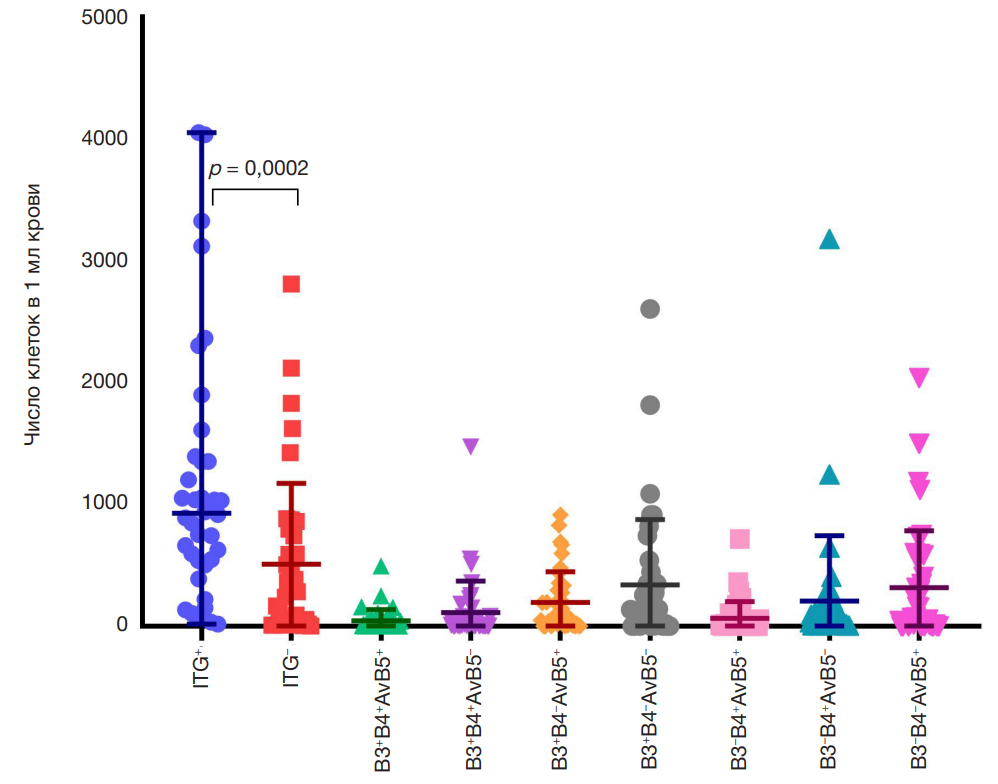
При сравнительном анализе метастатических характеристик клеток с гибридным фенотипом было обнаружено, что с наличием гематогенных метастазов (ГМ) у больных ассоциированы клетки без признаков ЭМП и стволовости.
Так, у пациенток с ГМ отмечено достоверное увеличение количества клеток CD45+EpCAM+CK7/8–Ncadh– и CD45+EpCAM+CK7/8+N-cadh– (р = 0,021 и р = 0,033 соответственно) по сравнению с больными без ГМ и снижение количества клеток CD45+EpCAM+CK7/8–N-cadh+ и CD45+EpCAM+CK7/8+N-cadh+ (р = 0,0079 и р = 0,0079 соответственно) по сравнению с N-кадгерин-негативными клетками (рис. 5).
Количество CD45+EpCAM–CK7/8+CD44+CD24–-клеток при ГМ было достоверно ниже, чем CD45+EpCAM–CK7/8+CD44–CD24–-клеток (р = 0,015) (рис. 5).
Достоверных различий между количеством клеток с гибридным фенотипом, имеющих и не имеющих признаки стволовости и ЭМП, в первичной опухоли при ГМ обнаружено не было.
Сравнительный анализ свойств циркулирующих клеток с гибридным фенотипом при ГМ показал изменение количества клеток с экспрессией интегриновых молекул (рис. 6).
У пациенток без ГМ и с наличием такового количество ITG–-клеток с гибридным фенотипом было достоверно ниже, чем количество ITG+-клеток (р = 0,0100 и р = 0,0009 соответственно) (рис. 6). Было также обнаружено снижение количества β3–β4+αVβ5–-циркулирующих клеток (р = 0,0394) при ГМ по сравнению с его отсутствием (рис. 6).
Риск развития ГМ у больных РМЖ оказался связан с наличием в крови CD45+EpCAM+CK7/8+-клеток независимо от наличия признаков стволовости и ЭМП и CD45+EpCAM–CK7/8+-клеток с признаками стволовости. Математическая модель имеет вид:
Y = 63,5 – 31,8X1 – 30,0X2,
где Y — значение уравнения регрессии; 63,5 — значение коэффициента регрессии свободного члена; X1 — значение количества CD45+EpCAM+CK7/8+-гибридных клеток в крови (X1 = 1 при количестве менее 14,94 клеток в 1 мл крови, X1 = 2 при количестве более 14,53 клеток в 1 мл крови); –31,8 — значение коэффициента регрессии этого признака; X2 — количество CD45+EpCAM–CK7/8+CD44+CD24–-клеток в крови (X2 = 1 при количестве более 2,49 клеток в 1 мл крови, X2 = 2 при количестве менее 2,49 клеток в 1 мл крови); –30,0 — значение коэффициента регрессии этого признака.
Чувствительность модели составляет 100,0%, специфичность — 98,3% (χ2 = 29,52; р = 0,0000004).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Биологический феномен гибридизации при опухолевых процессах по-прежнему является причиной для дискуссий и споров. Несмотря на многочисленные исследования in vitro и in vivo за последние десятилетия, все еще не получены твердые доказательства того, что опухолевые гибридные клетки могут приводить к прогрессии опухоли.
Одним из наиболее вероятных механизмов образования гибридных клеток считают межклеточное слияние нормальных клеток с опухолевыми. Так, в ходе исследований in vitro было отмечено спонтанное слияние между клетками нормального эпителия молочной железы и опухолевыми клетками, между самими опухолевыми клетками, между опухолевыми эпителиальными клетками и эндотелиальными клетками, между опухолевыми эпителиальными клетками и стромальными клетками [19]. Замечено также, что процессы межклеточного слияния и образования гибридных клеток усиливаются после применения радио- и химиотерапии, что вызвано формированием локального воспаления в опухолевом микроокружении и процессами тканевой регенерации [20–21]. В настоящее время выяснение биологической природы клеток с гибридным фенотипом остается актуальной задачей.
Субпопуляционный анализ клеток с гибридным фенотипом показал, что эти клетки могут экспрессировать как один из эпителиальных маркеров EpCAM или CK7/8, так и оба. Согласно современным представлениям, маркеры EpCAM и CK7/8 экспрессируются преимущественно эпителиальными клетками [22]. Однако имеются данные о наличии экспрессии EpCAM в клетках-предшественниках костномозгового происхождения, например, в ранних эритроидных предшественниках [23]. В физиологических условиях клетки-предшественники рекрутируются из костного мозга в процессе репаративной регенерации по мере необходимости [24]. При опухолевом процессе они участвуют в формировании и поддержании опухолевой и преметастатических ниш и, следовательно, способствуют возникновению метастатического очага в отдаленных органах [25].
Таким образом, вероятнее всего, клетки с экспрессией CK7/8 и CD45 (CD45+EpCAM+CK7/8+ и CD45+EpCAM– CK7/8+) являются гибридами лейкоцитов или макрофагов и эпителиальных опухолевых клеток, в то время как популяция CD45+EpCAM+CK7/8–-клеток может быть представлена как лейкоцитарно-эпителиальными гибридами, так и гемопоэтическими клеткамипредшественниками костномозгового происхождения.
При оценке метастатических характеристик клеток с гибридным фенотипом установлено, что эти клетки принимают участие в механизмах ЛМ и ГМ. Так, по данным метода логистической регрессии при обоих видах метастазирования имеют место одни и те же закономерности: увеличение количества циркулирующих CD45+EpCAM+CK7/8+-клеток и снижение количества CD45+EpCAM–CK7/8+-клеток с признаками стволовости. Кроме того, при ЛМ в крови увеличивается количество CD45+EpCAM+CK7/8‒-клеток с признаками стволовости и CD45+EpCAM+-клеток с коэкспрессией β3-, β4- и αVβ5- интегринов. При ГМ повышается количество CD45+EpCAM+CK7/8‒- и CD45+EpCAM+CK7/8+-клеток без признаков ЭМП и снижается количество этих же клеток с признаками ЭМП, а также CD45+EpCAM+-клеток с моноэкспрессией интегрина β4.
Приобретение гибридными клетками стволовых свойств может, по аналогии с ЦОК, способствовать их резистентности к противоопухолевой терапии и усилению метастатического потенциала. Увеличение количества β3-, β4- и αVβ5-экспрессирующих клеток с гибридным фенотипом при ЛМ тоже свидетельствует об усилении их метастатического потенциала. Интегрин β3 экспрессируется преимущественно тромбоцитами, гемопоэтическими клетками и ангиогенными эндотелиальными клетками и выполняет адгезивные функции при гемостазе, заживлении ран и ангиогенезе. Показана ассоциация интегрина β3 с опухолевым ростом, инвазией, возникновением метастазов в лимфоузлах и костном мозге и снижением выживаемости пациентов [26]. Интегрин β4 экспрессируют преимущественно эпителиальные клетки. При РМЖ интегрин β4 способствует опухолевой инвазии, повышает жизнеспособность опухолевых клеток и способствует ангиогенезу [27]. Интегрин αvβ5 является позитивным регулятором стволовости опухолевых клеток, способствует их росту и инвазии [28]. Ранее нами было установлено, что ЦОК экспрессируют промиграторный маркер CXCR4 [29]. Повышенный уровень экспрессии CXCR4 и интегриновых молекул в гибридных клетках может обеспечивать их высокий миграционный потенциал и способствовать диссеминации в различные органы, в результате гибридные клетки могут приобретать необходимые свойства для формирования метастазов [30].
На данный момент не известно, могут ли гибриды лейкоцитов и эпителиальных опухолевых клеток неограниченно делиться, формируя опухоль в дистантном органе, т. е. выполнять роль опухолевых клеток-семян. Не известно, способны ли гибридные циркулирующие клетки выполнять нишеобразующую роль. Однако уже сейчас можно утверждать, что гибридные клетки опухоли и периферической крови ассоциированы как с ЛМ, так и ГМ.
ВЫВОДЫ
Таким образом, в популяции клеток с гибридным фенотипом, так же, как и ЦОК, отмечается высокая степень гетерогенности, включая комбинацию признаков стволовости, ЭМП и разнообразный интегриновый интерфейс. Клетки с гибридным фенотипом принимают участие в процессах лимфогенного и гематогенного метастазирования. Наличие ЛМ ассоциировано с такими метастатическими характеристиками циркулирующих клеток с гибридным фенотипом, как признаки стволовости и коэкспрессия β3-, β4- и αVβ5-интегринов. При наличии ГМ метастатические характеристики клеток с гибридным фенотипом обусловлены признаками стволовости, но не признаками ЭМП и экспрессией интегринов. Понимание механизма участия клеток с гибридным фенотипом в метастазировании может быть полезным для совершенствования противометастатической терапии.



- Ruiz-Rodríguez AJ, Molina-Vallejo MP, Aznar-Peralta I, González Puga C, Cañas García I, González E, et al. Deep Phenotypic Characterisation of CTCs by Combination of Microfluidic Isolation (IsoFlux) and Imaging Flow Cytometry (ImageStream). Cancers (Basel). 2021; 13 (24): 6386.
- Zhang Q, Kong D, Yang Z, Li G, Cheng S, Feng L, et al. Prognostic value of stem-like circulating tumor cells in patients with cancer: a systematic review and meta-analysis. Clin Exp Med. 2023. DOI: 10.1007/s10238-023-01009-0.
- Orrapin S, Udomruk S, Lapisatepun W, Moonmuang S, Phanphaisarn A, Phinyo P, et al. Clinical Implication of Circulating Tumor Cells Expressing Epithelial Mesenchymal Transition (EMT) and Cancer Stem Cell (CSC) Markers and Their Perspective in HCC: A Systematic Review. Cancers (Basel). 2022; 14 (14): 3373.
- Grigoryeva ES, Tashireva LA, Alifanov VV, Savelieva OE, Vtorushin SV, Zavyalova MV, et al. Molecular subtype conversion in CTCs as indicator of treatment adequacy associated with metastasis-free survival in breast cancer. Sci Rep. 2022; 12 (1): 20949.
- Fina E, Cleris L, Dugo M, Lecchi M, Ciniselli CM, Lecis D, et al. Gene signatures of circulating breast cancer cell models are a source of novel molecular determinants of metastasis and improve circulating tumor cell detection in patients. J Exp Clin Cancer Res. 2022; 41 (1): 78.
- Grigoryeva ES, Tashireva LA, Savelieva OE, Zavyalova MV, Popova NO, Kuznetsov GA, et al. The Association of Integrins β3, β4, and αVβ5 on Exosomes, CTCs and Tumor Cells with Localization of Distant Metastasis in Breast Cancer Patients. Int J Mol Sci. 2023; 24 (3): 2929.
- Hoshino A, Costa-Silva B, Shen TL, Rodrigues G, Hashimoto A, Tesic Mark M, et al. Tumour exosome integrins determine organotropic metastasis. Nature. 2015; 527 (7578): 329–35.
- Guan X, Ma F, Li C, Wu S, Hu S, Huang J, et al. The prognostic and therapeutic implications of circulating tumor cell phenotype detection based on epithelial-mesenchymal transition markers in the first-line chemotherapy of HER2-negative metastatic breast cancer. Cancer Commun (Lond). 2019; 39 (1): 1.
- Wankhede D, Grover S, Hofman P. Circulating Tumor Cells as a Predictive Biomarker in Resectable Lung Cancer: A Systematic Review and Meta-Analysis. Cancers (Basel). 2022; 14 (24): 6112.
- Jou HJ, Ling PY, Hsu HT. Circulating tumor cells as a "real-time liquid biopsy": Recent advances and the application in ovarian cancer. Taiwan J Obstet Gynecol. 2022; 61 (1): 34–39.
- Li H, Liu Q, Liang S, Yao P, Lv J, Wang G, et al. Circulating tumor cells and neutrophil-lymphocyte ratio are predictive markers for metastatic colorectal cancer patients. Transl Cancer Res. 2021; 10 (1): 288–97.
- Papadaki MA, Stoupis G, Theodoropoulos PA, Mavroudis D, Georgoulias V, Agelaki S. Circulating Tumor Cells with Stemness and Epithelial-to-Mesenchymal Transition Features Are Chemoresistant and Predictive of Poor Outcome in Metastatic Breast Cancer. Mol Cancer Ther. 2019; 18 (2): 437–47.
- Lustberg MB, Balasubramanian P, Miller B, Garcia-Villa A, Deighan C, Wu Y, et al. Heterogeneous atypical cell populations are present in blood of metastatic breast cancer patients. Breast Cancer Res. 2014; 16 (2): R23.
- Ishizawa K, Yamanaka M, Saiki Y, Miyauchi E, Fukushige S, Akaishi T, et al. CD45+CD326+ Cells are Predictive of Poor Prognosis in NonSmall Cell Lung Cancer Patients. Clin Cancer Res. 2019; 25 (22): 6756–63.
- Dittmar T, Zänker KS. Introduction. In: Dittmar T, Zänker KS. Cell Fusion in Health and Disease. Advances in Experimental Medicine and Biology, vol 950. Dordrecht: Springer, 2011; p. 1–3.
- Laberge GS, Duvall E, Haedicke K, Pawelek J. Leukocyte-Cancer Cell Fusion-Genesis of a Deadly Journey. Cells. 2019; 8 (2): 170.
- Поспелова Р. А. Лейкоконцентрация в клинической практике: диагностическое значение. М.: Медицина, 1973; 88 с.
- Agnoletto C, Corrà F, Minotti L, Baldassari F, Crudele F, Cook WJJ, et al. Heterogeneity in Circulating Tumor Cells: The Relevance of the Stem-Cell Subset. Cancers (Basel). 2019; 11 (4): 483.
- Noubissi FK, Ogle BM. Cancer Cell Fusion: Mechanisms Slowly Unravel. Int J Mol Sci. 2016; 17 (9): 1587.
- Kaur E, Rajendra J, Jadhav S, Shridhar E, Goda JS, Moiyadi A, et al. Radiation-induced homotypic cell fusions of innately resistant glioblastoma cells mediate their sustained survival and recurrence. Carcinogenesis. 2015; 36 (6): 685–95.
- Yan B, Wang J, Liu L. Chemotherapy promotes tumour cell hybridization in vivo. Tumour Biol. 2016; 37 (4): 5025–30.
- Gires O, Pan M, Schinke H, Canis M, Baeuerle PA. Expression and function of epithelial cell adhesion molecule EpCAM: where are we after 40 years? Cancer Metastasis Rev. 2020; 39 (3): 969–87.
- Fidanza A, Stumpf PS, Ramachandran P, Tamagno S, Babtie A, Lopez-Yrigoyen M et al. Single-cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 2020; 136 (25): 2893–904.
- Rodrigues M, Kosaric N, Bonham CA, Gurtner GC. Wound Healing: A Cellular Perspective. Physiol Rev. 2019; 99 (1): 665– 706.
- Psaila B, Lyden D. The metastatic niche: adapting the foreign soil. Nat Rev Cancer. 2009; 9 (4): 285–93.
- Pan B, Guo J, Liao Q, Zhao Y. β1 and β3 integrins in breast, prostate and pancreatic cancer: A novel implication. Oncol Lett. 2018; 15 (4): 5412–6.
- Abdel-Ghany M, Cheng HC, Elble RC, Pauli BU. The breast cancer beta 4 integrin and endothelial human CLCA2 mediate lung metastasis. J Biol Chem. 2001; 276 (27): 25438–46.
- Liu F, Wu Q, Dong Z, Liu K. Integrins in cancer: Emerging mechanisms and therapeutic opportunities. Pharmacol Ther. 2023; 247: 108458.
- Savelieva OE, Tashireva LA, Buldakov MA, Mukhamedzhanov RK, Kaigorodova EV, Denisov EV, et al. CXCR4 expression in different subsets of CTCs and single (detached) breast cancer cells. Siberian journal of oncology. 2018; 17 (4): 75–80.
- Ramakrishnan M, Mathur SR, Mukhopadhyay A. Fusion-derived epithelial cancer cells express hematopoietic markers and contribute to stem cell and migratory phenotype in ovarian carcinoma. Cancer Res. 2013; 73 (17): 5360–70.