ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Исследование антибактериальной, антиадгезивной и антибиопленкообразующей активности растительных комплексов в отношении пародонтопатогенных бактерий in vitro
1 Самарский государственный медицинский университет, Самара, Россия
2 Военно-медицинская академия имени С. М. Кирова, Санкт-Петербург, Россия
3 Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера, Санкт-Петербург, Россия
4 Стоматологический магазин «РОМАШКА», отдел научных исследований, Санкт-Петербург, Россия
5 Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва, Россия
6 Самарский национальный исследовательский университет имени С. П. Королева, Самара, Россия
Пародонтит — актуальная проблема в России и в мире, требующая регулярной адаптации схем лечения и реабилитации из-за динамично меняющейся пародонтопатогенной флоры. Классическая терапия купирования острого процесса включает использование химического антисептика хлоргексидин 0,2–0,12%, эффективного только до трех недель применения ввиду адаптации патогенной флоры. Растительные комплексы с антисептическим действием в последние годы зарекомендовали себя как способные заместить классическую терапию. Очевидно, что разные формы выпуска имеют разную эффективность. Staphylococcus aureus в полости рта служит маркером пародонтита. Klebsiella pneumoniae, Pseudomonas aeruginosa, Acinetobacter baumannii обладают маркерами вирулентности в качестве копатогенов при пародонтите. Целью исследования было выявить растительные препараты для борьбы с перечисленными микробами, а также с Streptococcus mitis, Streptococcus oralis, Streptococcus salivarius, Enterococcus faecalis. Проводили сравнительную оценку антибактериальной, антиадгезивной и антибиопленкообразующей активности отечественных средств «Фитодент» из растительного сырья: водных, водно-спиртовых и масляных растворов; гелевых форм. Наибольшая антибактериальная, антиадгезивная и антибиопленочная эффективность обнаружена у форм с длительной экспозицией — гелей, сопоставимая — у средств с синтетическими и с растительными антисептиками, а также у форм с максимальной концентрацией растительных антисептиков — эликсира. Водные и масляные формы за счет меньшей концентрации и сравнительно короткого времени контакта имеют меньшую эффективность. Полученные результаты подтверждают результаты клинических наблюдений за применением средств «Фитодент» в качестве ухода за полостью рта при лечении и профилактике пародонтита. Рекомендованы дальнейшие сравнительные исследования композиций, перекрестные и сравнительные исследования в зависимости от частоты применения и времени воздействия и с титрованием концентраций активных компонентов, в том числе на смешанных биопленках.
Ключевые слова: дигидрокверцетин, пародонтит, медные производные хлорофилла, гель, кора осины, антибиопленкообразующее действие, антимикробное действие, антиадгезивное действие, Фитодент
Благодарности: авторы выражают благодарность С. С. Асташовой, дизайнеру научно-практического журнала «Академия хлорофилла и коры осины» за подготовку фотографий и таблиц для публикации.
Вклад авторов: Л. А. Краева, Г. Н. Хамдулаева, М. А. Носова — концепция и дизайн исследования; И. И. Латиф, А. Н. Шаров — анализ литературы, сбор и обработка данных; Л. А. Краева — статистическая обработка; Л. А. Краева, А. Н. Шаров, И. И. Латиф — подготовка черновика рукописи; И. С. Копецкий, Д. А. Еремин, Е. В. Постникова, М. A. Постников — редактирование.
Соблюдение этических стандартов: исследование одобрено этическим комитетом СамГМУ (протокол № 7 от 10 января 2022 г.)
Для корреспонденции: Алексей Николаевич Шаров
Невский пр., 46, г. Санкт-Петербург, Россия; ur.xelavorahs@em
Пародонтит (П) — крайне актуальная стоматологическая проблема в России и в мире [1–4]. Доказавшие свою эффективность средства для купирования острого инфекционно-воспалительного процесса содержат химический антисептик (чаще всего хлоргексидин в концентрации 0,12–0,2%) практически в 100% форм выпуска [5–8]. Однако химические антисептические средства имеют ограниченный эффективный срок применения ввиду развития резистентности бактериальной флоры. Растительные комплексы, обладающие антисептическими свойствами, сопоставимые по спектру действия и эффективности, в последние годы зарекомендовали себя как способные заместить классическую стандартную антисептическую терапию [9–12]. Очевидно, что разные формы выпуска: водные растворы, водно-спиртовые растворы, масляные растворы, гелевые формы, — имеют разную эффективность за счет различия эффективной экспозиции по времени на тканях пародонта, что определяет частоту применения средства, длительность купирования острого периода и как следствие — время компенсированной стабильной ремиссии пациента [13–14]. Доказано антибактериальное действие фитонцидов хвойных растений, экстрактов коры осины, вытяжек из ламинарии японской и сахаристой. Результат применения известен давно, а различные комбинированные формы имеют космополитный характер применения в стоматологии. При этом доказательная научная база фрагментарна и имеет в основном клиническое подтверждение, а не фундаментальное [15–18]. Применение гелевых форм при лечении пародонтита предпочтительно за счет длительной экспозиции активных компонентов на тканях пародонта. Имеющиеся в настоящее время в практике стоматолога-пародонтолога гели содержат либо антисептик, либо субстраты для репарации тканей. Нет геля с мультинаправленным действием, т. е. элиминирующим токсины и биологический мусор, способствующим метаболизму в тканях пародонта, с неспецифическим иммуномодулирующим действием, нормализующим процессы дыхания и трофики пародонта, и как результат — комбинированной индукцией ауторегенерации [19].
Как известно, полость рта отличается большим видовым разнообразием микроорганизмов. Основная часть из них являются комменсалами. Однако выявлен ряд бактериальных видов, которые непосредственно или опосредованно связаны с развитием П и других воспалительных процессов. Так, Streptococcus sanguinis способствует образованию биопленки на поверхности зубов с включением в ее состав Fusobacterium nucleatum, участвующего в развитии П [20], а также вероятностью развития в дальнейшем эндокардита [21]. Большое число исследователей заняты поиском препаратов из растительных компонентов или полученных синтетическим путем из веществ природного происхождения для борьбы с кариесогенными и пародонтогенными бактериями Streptococcus mitis, Streptococcus oralis, Streptococcus salivarius, Enterococcus faecalis [22–25]. Присутствие таких бактерий, как Staphylococcus aureus, и его метаболитов в полости рта может служить маркером определенной стадии П [26]. А наличие патогенетической оси «полость рта — кишечник» помогает рассматривать ряд бактерий, особенно обладающих маркерами вирулентности, в качестве копатогенов при пародонтите: Klebsiella pneumoniae, Pseudomonas aeruginosa, Acinetobacter baumannii [27–29]. Поэтому в настоящей работе были рассмотрены именно эти патогены. Целью исследования было оценить антибактериальную, антиадгезивную и антибиопленкообразующую активность различных форм выпуска комбинированных средств с растительными и синтетическими компонентами различных направлений активности на пародонтопатогенную флору.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено в отделе новых технологий ФБУН НИИ эпидемиологии и микробиологии имени Пастера в период октябрь 2021 г. — апрель 2022 г.
Использовали уже патентованный состав геля с медными производными хлорофилла, корой осины, альгинатом натрия и дигидрокверцетином (ДКВ), обладающий необходимым спектром антибактериального действия и отвечающий требованиям к препарату для комплексной терапии П [30]. Продемонстрирован положительный клинический результат применения геля с медными производными хлорофилла, корой осины, альгинатом натрия и ДКВ при П [31], а также при при гингивите и П [32].
Композиции активных компонентов
Эликсир представляет собой водно-спиртовой концентрат активных компонентов: вода, спирт этиловый 20%, хлорофиллин натрия-меди, экстракт осиновой коры, экстракт ламинарии, кокамидопропилбетаин, ароматизатор пищевой «Мятный» натуральный, поливинилпирролидон.
Ополаскиватель представляет собой водный раствор активных компонентов: вода, хлорофиллин натриямеди, экстракт осиновой коры, экстракт ламинарии, кокамидопропилбетаин, ароматизатор пищевой «Мятный» натуральный, поливинилпирролидон, натрия бензоат.
Масло «Фитолон» представляет собой масляный раствор активных компонентов: масло рафинированное косточки персика или оливы, хлорофиллин натрия-меди.
Масло «Провитам» представляет собой масляный раствор активных компонентов: масло рафинированное косточки персика или оливы, концентрат провитаминный хвойный.
Гель 1 с хлоргексидином представляет собой гелевую композицию активных компонентов: сорбитол, вода, гидрогенизированное касторовое масло, гидроксиэтилцеллюлоза, альгинат натрия, хлоргексидина гидрохлорид, д-пантенол, аллантоин, метилпарабен, метилсалицилат, ароматизатор «Пектраль», ментол, экстракт пихты, хлорофиллин натрия-меди, эвгенол, пектин.
Гель 2 с корой осины и ДКВ представляет собой гелевую композицию активных компонентов: сорбитол, вода, гидрогенизированное касторовое масло, гидроксиэтилцеллюлоза, альгинат натрия, дигидрокверцетин, д-пантенол, аллантоин, экстракт коры осины, метилпарабен, метилсалицилат, хвойный комплекс, ментол, ароматизатор «Пектраль», лимонная кислота, хлорофиллин натрия-меди, эвгенол.
Гель 3 с хлоргексидином представляет собой гелевую композицию активных компонентов: сорбитол, вода, гидрогенизированное касторовое масло, гидроксиэтилцеллюлоза, альгинат натрия, д-пантенол, хлоргексидина гидрохлорид, аллантоин, метилпарабен, метилсалицилат, ароматизатор «Пектраль», ментол, экстракт пихты, хлорофиллин натрия меди, эвгенол, пектин, — выдержанную до истечения срока годности 2 года.
Штаммы бактерий
Референтные штаммы бактерий:
- Staphylococcus aureus АТСС № 25923
- Enterococcus faecalis ATCC № 29212
- Klebsiella pneumoniae ATCC № 13883
- Pseudomonas aeruginosa ATCC № 27853
- Acinetobacter baumannii ATCC № 19606
Штаммы бактерий из коллекции микроорганизмов лаборатории:
- Streptococcus sanguinis № 2111
- Streptococcus mitis № 2118
- Streptococcus oralis № 2114
- Streptococcus salivarius № 2107
Методы исследования
С помощью бактериологического метода исследования изучали влияние растительных комплексов на биологические свойства бактерий: выживаемость, адгезивные и антибиопленкообразующие свойства.
Исследование антибактериальных свойств растительных комплексов
Готовили микробные взвеси 24-часовых культур бактерий в физиологическом растворе, содержащем 1 × 108 КОЕ/мл. Далее путем десятикратных разведений доводили количество бактерий до 1 × 105 КОЕ/мл. При последнем разведении использовали мясопептонный бульон. Микробные взвеси переносили в 24 пробирки по 1 мл. В три пробирки, содержащие по 1 мл микробной взвеси конечной концентрации, вносили по 1 мл каждого растительного комплекса, в оставшиеся три пробирки вносили по 1 мл физиологического раствора. Все пробирки оставляли в термостате при температуре +37 °С на 30 мин. Далее из каждой пробирки производили высев по 10 мкл на чашки Петри с питательным агаром: для стрептококков — кровяной агар, для остальных видов бактерий — мясопептонный агар. Посев осуществляли по методу газона. Чашки Петри инкубировали в термостате 24 ч при температуре +37 °С. Далее производили подсчет колоний на каждой чашке, для каждого образца растительного компонента рассчитывали среднее арифметическое.
Исследование антиадгезивных свойств растительных комплексов
Исследование проводили по методике А. С. Благонравовой [33] на клетках буккального эпителия. Для этого клетки трижды отмывали от индигенной микрофлоры в забуференном физиологическом растворе при рН 7,2–7,4 при скорости 35 g в течение 10 мин. Затем клетки разделяли по 0,5 мл в пробирки. В каждую пробирку добавляли по 0,5 мл бактериальной суспензии, содержащей 3 × 108 КОЕ/мл S. sanguinis и по 0,5 мл каждого растительного комплекса. Одна пробирка содержала только буккальный эпителий — контроль (естественная колонизация). Опыты и контроли производили в трех циклах повторений. Далее пробирки со всеми компонентами интенсивно встряхивали и помещали в термостат при температуре +37 °С на 30 мин. После этого проводили отмывание от не прикрепившихся микроорганизмов, готовили мазки на предметных стеклах, фиксировали и окрашивали по Граму. Индекс адгезии рассчитывали по формуле:
ИА = АКБ50/50Э, (1)
где ИА — индекс адгезии, АКБ50 — количество клеток бактерий, прикрепившихся к 50 эпителиоцитам, 50Э — 50 изученных эпителиоцитов.
Исследование антибиопленочных свойств растительных комплексов
Исследование осуществляли с помощью регистрации формирующихся микроколоний бактерий на плотной питательной среде. Для этого суточную бактериальную культуру исследуемых штаммов стандартизировали измерением мутности 0,5 по МакФарланду. Методом серийных разведений концентрацию клеток доводили до 1 × 10⁶ КОЕ/мл, смешивали с каждым растительным комплексом в соотношении 1 : 10 и по отдельности каждую распределяли по стерильному предметному стеклу. В качестве контроля использовали инокулюм бактерий в питательном бульоне без добавления препарата. Далее образцы помещали в термостат при температуре +37 °С на 3 ч. После этого все стекла просматривали под микроскопом Axio Scope А1 (Zeiss; Германия) при увеличении в 400 раз. Снимки выполняли с использованием профессиональной стационарной цифровой фотокамеры AxioCam HRc Rev3 (Zeiss; Германия). Отмечали количество выросших бактериальных микроколоний в контрольных и экспериментальных пробах, просматривая несколько полей зрения. Снижение в экспериментальных образцах количества микроколоний более чем в два раза по сравнению с контролем свидетельствует о хорошем антибиопленочном свойстве растительной композиции в различных формах.
Статистический анализ данных выполняли в среде пакета MS Excel 2010 (Microsoft; США). Обработку полученных результатов производили по методу Стьюдента. Результаты считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследование антибактериальной активности
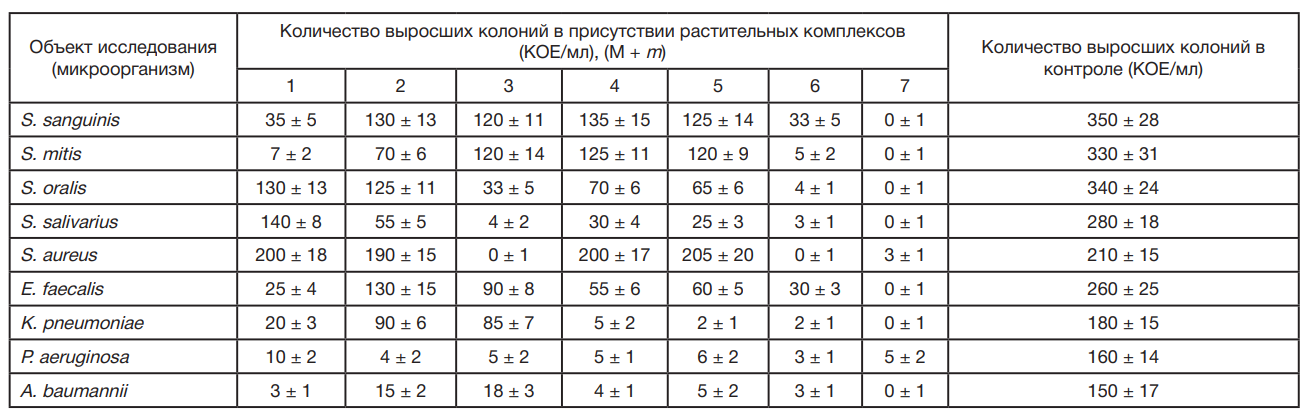
Результаты антибактериальной активности представлены в табл. 1 и на рис. 1.
Описание результатов:
- Эликсир, имеющий в составе 20% этилового спирта по массе и максимальную концентрацию активных компонентов: экстракт коры осины, альгинат натрия и хлорофиллин натрия-меди, показал наибольшую эффективность против бактериальной флоры.
- Гель 1 с химическим антибактериальным агентом (хлоргексидином) в бактерицидной концентрации 0,12% и растительными активными компонентами (альгинат натрия, Д-пантенол, аллантоин, метил салицилат, ментол, экстракт пихты, хлорофиллин натрия-меди, эвгенол) показал сопоставимую высокую антибактериальную эффективность.
- Гель 3 аналогичного состава с истекшим сроком годности 2 года показал среднюю антибактериальную активность.
- Ополаскиватель и Гель 2 с корой осины и ДКВ не показали высокой цидной активности против пародонтопатогенной флоры.
- Масляные растворы показали низкую цидную активность против пародонтопатогенной флоры.
Исследование антиадгезивной активности
Результаты антиадгезивной активности представлены в табл. 2.
Описание результатов:
- Эликсир и гель с ДКВ (Гель 2) показали сопоставимую максимальную антиадгезивную эффективность.
- Гель с ХГ и ополаскиватель показали средний эффект.
- Масляные растворы показали низкую антиадгезивную активность.
Исследование антибиопленочных свойств растительных комплексов
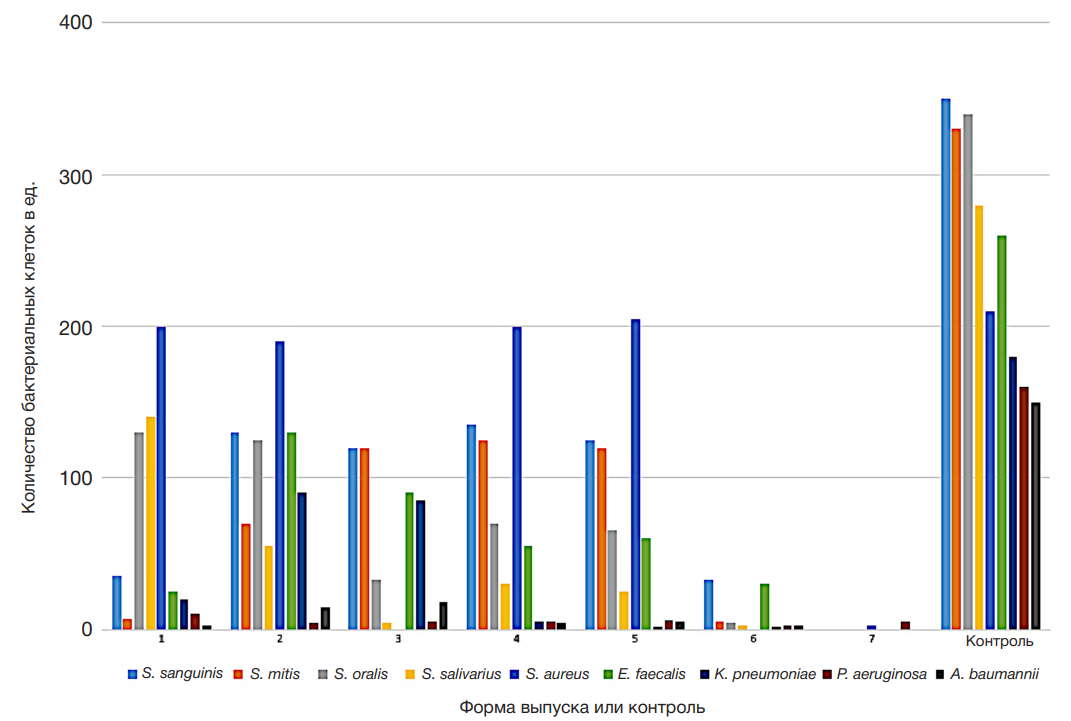
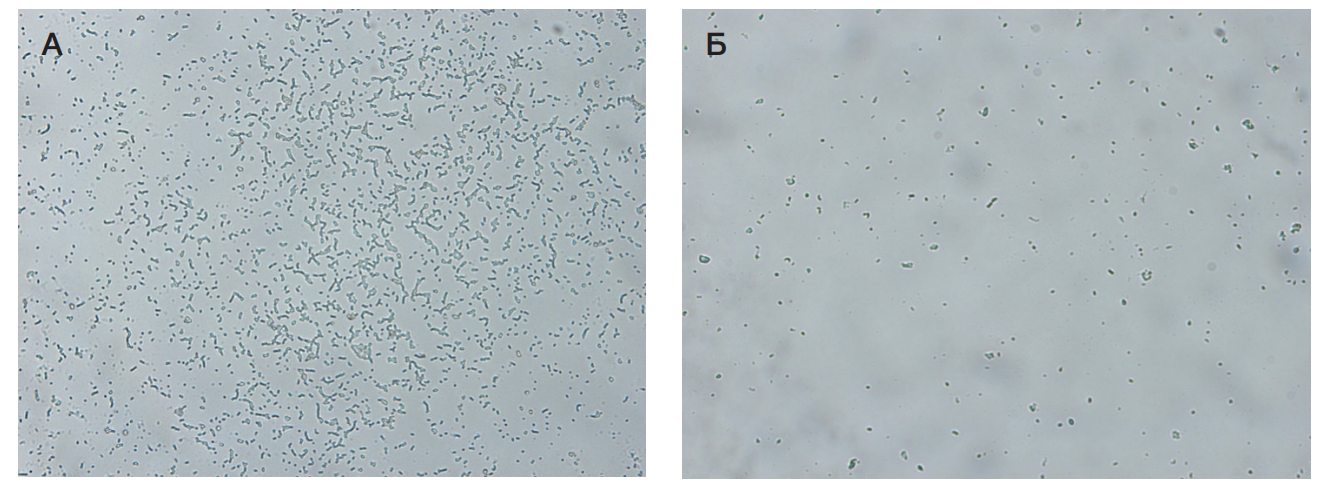
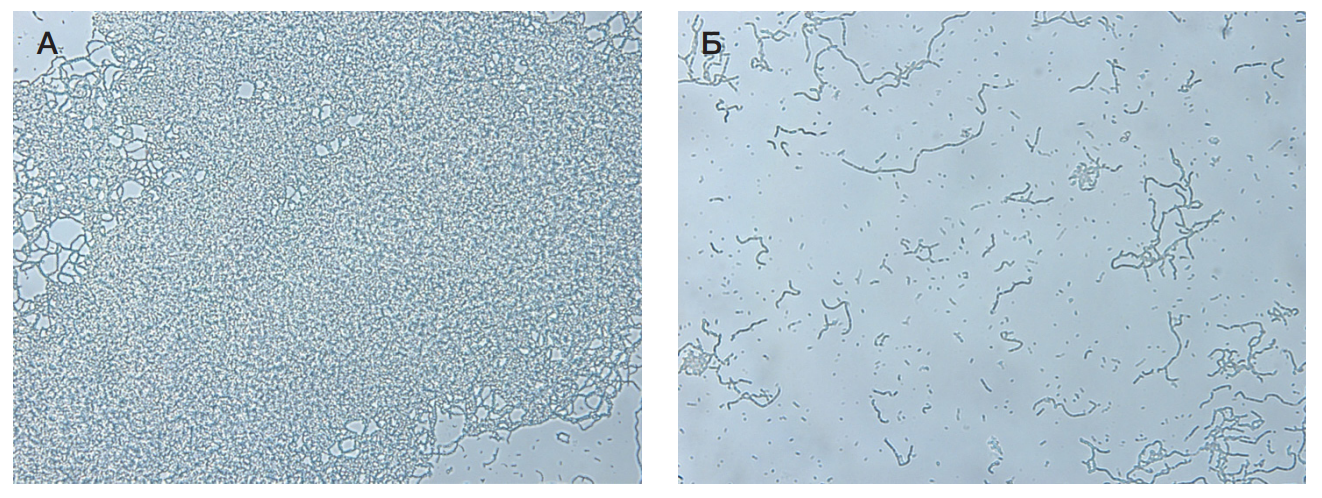
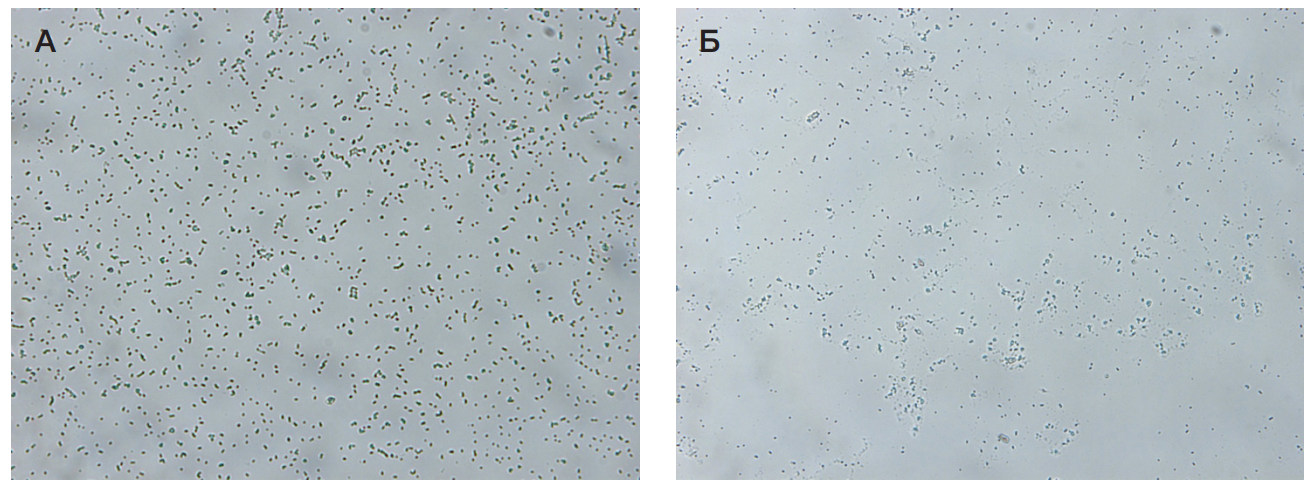
Результаты антибиопленкообразующего действия различных форм выпуска представлены на рис. 2–рис. 4.
Описание результатов:
Все средства показали высокую антибиопленкообразующую активность. Максимальный результат получен в случае применения гелевых форм (Гель 1 и Гель 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Флора имеет тенденцию к изменению состава и качеств биопленки [1, 8, 20, 21, 23], поэтому необходимо оценивать физические показатели биопленки у конкретного пациента до начала лечения для более точной диагностики участия системных и общесоматических проблем, уровня гигиенической культуры пациента, персонифицированного подбора плана лечения, учета фенотипических показателей и достижения прогнозируемого положительного клинического результата, стабильного в долгосрочной перспективе при реабилитации пациентов с пародонтитом.
Антибактериальная активность растительных комплексов в отношении пародонтопатогенных бактерий проявляется в результате трех процессов: антиадгезивной активности, собственно антибактериального действия и антибиопленочных свойств [2, 8]. Поскольку любой инфекционный процесс бактериальной этиологии начинается с адгезии и колонизации микроорганизмов места внедрения, выявление антиадгезивных свойств у препаратов, используемых в стоматологической практике, позволяет предотвратить на ранних этапах адгезию и колонизацию бактерий. Тем самым ослабляется первая фаза инфекционного процесса и предотвращается образование бактериальной биопленки. У исследуемых растительных комплексов выявлена высокая антибиопленочная активность, что снижает вероятность развития очага хронической инфекции в области пародонта. В свою очередь наличие прямого антибактериального действия у растительных комплексов способствует снижению количества бактерий, при котором инициация инфекционного процесса становится маловероятной [6, 12].
Высокую антисептическую эффективность эликсира предположительно обеспечивает содержание этилового спирта (20% по массе) и высокая концентрация растительных антибактериальных компонентов.
Эффективность гелевой формы (Гель 1) вероятнее всего связана с пролонгированным высвобождением активных веществ за счет уникальной биоадгезивной пленкообразующей основы.
Сохранение антисептической эффективности гелевой формы аналогичного состава с истекшим сроком годности (Гель 3) с ее сравнительным снижением наиболее вероятно вызвано старением компонентов основы и ее быстрой деградацией, снижением кумулятивной активности сложных растительных комплексов, при сохранении антисептической активности хлоргексидина. Это также дает основание предполагать комплексное мультинаправленное комбинированное действие исследуемой композиции.
Высокая антиадгезивная эффективность вероятнее всего обусловлена альгинатом натрия, экстрактом коры осины и содержанием спирта в случае эликсира; за счет альгината натрия, ДКВ и экстракта коры осины в случае гелевой формы (Гель 2).
Сравнительная меньшая антисептическая активность водных и масляных форм связана с низкой концентрацией прямых антибактериальный агентов (экстракта коры осины в первую очередь) и малого времени экспозиции.
Форма выпуска существенно влияет на время экспозиции активных растительных комплексов: гели дают максимальный эффект за счет замедленного равномерного высвобождения действующих веществ, биоадгезии и образования пленки на десне и слизистой в полости рта [13–14]. Высокая концентрация активных веществ в водно-спиртовых растворах также вызывает стойкий и длительный антибактериальный эффект, но не обеспечивает длительной экспозиции на тканях пародонта. Гель с истекшим сроком годности теряет активность за счет старения основы из-за потери влаги. Целесообразно изготавливать гелевые формы небольшими сериями или в отдельных случаях экстемпорально. Основа гелей действует особенным образом: адгезируясь к высушенной поверхности слизистой или десны, длительно сохраняясь в локусе экспозиции, замедленно высвобождая активные компоненты, давая при этом возможность снижать дозировки в композиции; что требует дополнительных исследований.
Таким образом, трехэтапное антибактериальное действие растительных комплексов снижает риск развития пародонтитного процесса, даже в случае присутствия в этой области пародонтопатогенных бактерий. Использование в острый период в комплексной терапии после проведения кабинетной профессиональной гигиены растительных комплексов, особенно в виде гелевых форм выпуска, способствует быстрому восстановлению структуры и состояния тканей пародонта, нормализации трофики и питания, дыхания и обменных процессов в тканях. А применение после купирования острого процесса способствует удлинению периода ремиссии и существенно снижает риск повторных обострений, их течение и повторное повреждение тканей инфекционными агентами.
В острый период до 14–21 дня целесообразно применять комбинацию: Эликсир + Гель с хлоргексидином 0,12%, а после купирования острого процесса: Полоскание и Гель с корой осины и ДКВ [11, 13]. Полоскание и Гель с корой осины и ДКВ могут применяться для профилактики обострений у пациентов с хроническим генерализованным пародонтитом изза отсутствия химических компонентов, вызывающих резистентность бактерий при сохранении неспецифического антибактериального эффекта за счет изменения проницаемости клеточной стенки бактерий.
ВЫВОДЫ
У исследованных растительных комплексов в гелевой форме выявлена высокая антисептическая, антиадгезивная и антибиопленочная активность. Масляные формы выпуска целесообразно использовать в комплексной терапии заболеваний СОР (слизистой оболочки рта); эликсир и Гель с хлорофиллом и хлоргексидином 0,12% — в комплексной терапии пародонтита, Гель с корой осины и ДКВ и Ополаскиватель — для профилактики пародонтита и других поражений десны СОР. Необходимы дальнейшие исследования активности растительных комплексов в различных формах с титрованием концентраций у эликсира по сравнению с ополаскивателем, сравнением результатов частоты нанесения гелевых форм между собой и определением срока наступления резистентности в случае Геля с химическим антисептиком. Важно продолжить работу по оценке биологических свойств пародонтопатогенных микроорганизмов in vitro, используя экспериментальные модели смешанных (мультивидовых) биопленок. Флора полости рта сильно изменилась за последние 20 лет, что обусловлено и спецификой регионов проживания. При проведении исследований рекомендовано сначала оценивать актуальный состав пародонтопатогенных бактерий в налете и на поверхности корня зуба, а также в пародонтальной жидкости.

- Бородулина И. И., Васильева Л. В., Румакин В. П., Ковалевский А. М., Фадеев Р. А., Гребнев Г. А. Морфология пародонтального кармана при хроническом генерализованном пародонтите средней степени тяжести. Медицинский вестник Северного Кавказа. 2019; 14: 164–7.
- Цепов Л. М., Голева Н. А. Роль микрофлоры в возникновении воспалительных заболеваний пародонта. Пародонтология. 2009; 1: 7–12.
- Tonetti, MS, Van Dyke TE. Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFPA. AP Workshop on Periodontitis and Systemic Diseases. J Periodontol. 2013; 84 (4): 24–29.
- Карданова Л. В., Тхазаплижева М. Т., Балкаров А. О. Некоторые аспекты местного лечения хронических воспалительных заболеваний пародонта. Современные проблемы науки и образования. 2014; 6: 1048–54.
- Иорданишвили А. К., Ковалевский А. М. Факультетская стоматология: руководство для врачей-стоматологов. М.: СИМК, 2015; 504 с.
- Тхазаплижева, М. Т., Батырбекова Ф. Р. Сравнительная оценка эффективности изолированного и сочетанного применения хлоргексидина и низкочастотного ультразвука в комплексном лечении пародонтита средней степени тяжести. Материалы V Всемирного конгресса по иммунологии и аллергии. Аллергология и иммунология. 2007; 8 (1): 145.
- Barnett ML. The rationale for the daily use of an antimicrobial mouthrinse J Am Dent Assoc. 2006; 137: 16–21.
- Teles RP, Teles FRF. Antimicrobial agents used in the control of periodontal biofilms: effective adjuncts to mechanical plaque control. Braz Oral Res. 2009; 23 (1): 39–48.
- Николаев А. И., Цепов Л. М. Практическая стоматология: учеб. пособие. М.: МЕДпресс-информ, 2018; 928 с.
- Киюн И. Д. Сравнительное исследование отбеливающих зубных паст с умеренной абразивностью. Молодой ученый. 2015; 6: 274–7.
- Федоров Ю. А., Дрожжина В. А. Профилактика стоматологических заболеваний. В кн.: В. А. Козлов, редактор. Стоматология: учебник для медицинских вузов и последипломной подготовки специалистов. СПб.: СпецЛит, 2011; 36–67.
- Джиоева Р. Ф. Клиническая эффективность фитотерапии при лечении хронического генерализованного пародонтита. Вестник медицинского стоматологического института. 2013; 4 (27): 27–29.
- Улитовский С. Б. Полоскания для рта или жидкие средства гигиены рта. СПб.: Человек, 2017; 192 с.
- Улитовский С. Б. Средства индивидуальной гигиены рта: учебник для последиплом. образования. М.: Спец. изд-во мед. кн., 2018; 200 с.
- Дрожжина В. А., Петрищев Н. Н., Федоров Ю. А. Повышение физиологической резистентности тканей пародонта белых крыс при действии биологически активных веществ ламинарии. Физиол. журнал. 1995; 81 (2): 126–33.
- Блинова К. Ф., Яковлев Г. П., редакторы. Ботаникофармакогностический словарь. М.: Высшая школа, 1990; 272 с.
- Дейнеко И. П., Фаустова Н. М. Элементарный и групповой химический состав коры и древесины сосны. Химия растительного сырья. 2015; 1: 51–62.
- Лобанова И. Ю., Турецкова В. Ф., Зверев Я. Ф., Талалаева О. С. Изучение острой токсичности и антиоксидантной активности экстракта листьев осины сухого. Фундаментальные исследования. 2012; 9: 308–12.
- Беляцкая А. В., Кашликова И. М., Елагина А. О., Краснюк (мл.) И. И., Краснюк И. И., Степанова О. И. Нитрофураны для наружного применения. Разработка и регистрация лекарственных средств. 2019; 8 (2): 38–47.
- He X, Hu W, Kaplan CW, Guo L, Shi W, Lux R. Adherence to streptococci facilitates Fusobacterium nucleatum integration into an oral microbial community. Microb Ecol. 2012; 63 (3): 532–42. DOI: 10.1007/s00248-011-9989-2.
- Zhu B, Macleod LC, Kitten T, Xu P. Streptococcus sanguinis biofilm formation & interaction with oral pathogens. Future Microbiol. 2018; 13 (8): 915–32. DOI: 10.2217/fmb-2018-0043.
- Kumarasamy B, Manipal S, Duraisamy P, Ahmed A, Mohanaganesh S, Jeevika C. Role of aqueous extract of morinda citrifolia (Indian noni) ripe fruits in inhibiting dental caries-causing streptococcus mutans and streptococcus mitis. J Dent (Tehran). 2014; 11 (6): 703–10.
- Cabal B, Cafini F, Esteban-Tejeda L, et al. Inhibitory effect on in vitro Streptococcus oralis biofilm of a soda-lime glass containing silver nanoparticles coating on titanium alloy. PLoS One. 2012; 7 (8): e42393. DOI: 10.1371/journal.pone.0042393.
- Mirpour M, Gholizadeh Siahmazgi Z, Sharifi Kiasaraie M. Antibacterial activity of clove, gall nut methanolic and ethanolic extracts on Streptococcus mutans PTCC 1683 and Streptococcus salivarius PTCC 1448. J Oral Biol Craniofac Res. 2015; 5 (1): 7–10. DOI: 10.1016/j.jobcr.2015.02.002.
- Wu S, Liu Y, Zhang H, Lei L. Nano-graphene oxide with antisense walR RNA inhibits the pathogenicity of Enterococcus faecalis in periapical periodontitis. J Dent Sci. 2020; 15 (1): 65–74. DOI: 10.1016/j.jds.2019.09.006.
- Lee J, Lee JB, Song HY, et al. Diagnostic Models for Screening of Periodontitis with Inflammatory Mediators and Microbial Profiles in Saliva. Diagnostics (Basel). 2020; 10 (10): 820. DOI: 10.3390/ diagnostics10100820/.
- Cai Z, Zhu T, Liu F, Zhuang Z, Zhao L. Co-pathogens in Periodontitis and Inflammatory Bowel Disease. Front Med (Lausanne). 2021; 8: 723719. DOI: 10.3389/fmed.2021.723719.
- Li Q, Wang H, Tan L, et al. Oral Pathogen Fusobacterium nucleatum Coaggregates With Pseudomonas aeruginosa to Modulate the Inflammatory Cytotoxicity of Pulmonary Epithelial Cells. Front Cell Infect Microbiol. 2021; 11: 643913. DOI: 10.3389/ fcimb.2021.643913.
- Richards AM, Abu Kwaik Y, Lamont RJ. Code blue: Acinetobacter baumannii, a nosocomial pathogen with a role in the oral cavity. Mol Oral Microbiol. 2015; 30 (1): 2–15. DOI: 10.1111/omi.12072.
- Ковалевский А. М., Латиф И. И., Ковалевский В. А., Шаров А. Н., Носова М. А., Некрасова В. Б., авторы; ООО «ФИТОЛОННАУКА», патентообладатель. Композиция в форме геля для ухода за тканями полости рта. Патент РФ № 2733718 от 06.10.2020.
- Никитенко В. В., Ковалевский А. М., Латиф И. И. Эффективность применения композиции в форме геля с экстрактом коры осины и хлорофиллом для лечения и профилактики воспалительных заболеваний пародонта. В сборнике: В. В. Никитенко, В. А. Железняк, редакторы. Материалы научно-практической конференции «Актуальные вопросы теоретической и практической стоматологии», 7-8 октября 2021 г. СПб., 2021; 128–33.
- Латиф И. И., Ковалевский А. М., Носова М. А., Шаров А. Н., Краева Л. А. Оценка эффективности гелевой композиции для ухода тканями полости рта. Стоматологическая весна в Белгороде — 2022: сборник трудов Международной научнопрактической конференции к 100-летию МГМСУ. Белгород: «БелГУ», 2022; 276 с.
- Благонравова А. С., Афонин А. Н., Воробьева О. Н., Широкова И. Ю. Сравнительный анализ адгезивности микроорганизмов, выделенных от больных и с объектов внешней среды лечебно-профилактических учреждений. Медицинский альманах. 2011; 5 (18): 215–8.