ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Предоперационное планирование артропластики тазобедренного сустава
Башкирский государственный медицинский университет, Уфа, Россия
Предоперационное планирование артропластики ТБС предоставляет хирургам уникальную возможность тщательного изучения анатомии пациента, позволяет определить оптимальный размер, позиционирование импланта, а также предупредить потенциальные осложнения. Развитие цифровых технологий позволяет повысить возможности предоперационного планирования за счет использования трехмерного моделирования. Цель: провести сравнение точности трехэтапного предоперационного планирования артропластики ТБС по сравнению со стандартным методом. В исследование было включено 224 пациента с различными формами дегенеративно-дистрофических заболеваний ТБС, которые были разделены на основную и контрольную группу в зависимости от метода планирования. В группе исследования предоперационное планирование артропластики проводилось в три этапа: оценка плотности костной ткани в области опорных зон на основании КТ-томографии; виртуальное проектирование с использованием автоматизированных программ; изготовление 3D-модели на основе компьютерного моделирования. В группе сравнения использовали рентгенограммы и шаблоны эндопротеза. Результаты показали, что статистически значимой разницы между методами планирования не было у пациентов, страдающих остеоартрозом и аваскулярным некрозом головки бедра (p > 0,05), в отличие от группы с посттравматической патологией ТБС, у которой отмечалась статистически значимая разница (рк = 0,002). Выводы: алгоритм трехэтапной методики предоперационного планирования артропластики ТБС показал более высокую эффективность для пациентов с различной нозологической формой дегенеративно-дистрофических заболеваний ТБС по сравнению со стандартным методом.
Ключевые слова: эндопротезирование тазобедренного сустава, артропластика, предоперационное планирование, объемное моделирование, 3D-печать
Финансирование: работа выполнена при поддержке гранта Правительства Республики Башкортостан для государственной поддержки научных исследований, проводимых под руководством ведущих ученых, в рамках программы Евразийского НОЦ; и при поддержке Программы стратегического академического лидерства Башкирского государственного медицинского университета (ПРИОРИТЕТ-2030).
Вклад авторов: Б. Ш. Минасов, Р. Р. Якупов, А. Р. Билялов — разработка дизайна исследования, анализ результатов; Т. Б. Минасов, М. М. Валеев, Т. Р. Мавлютов — интраоперационный контроль определения размеров компонентов эндопротеза, сбор данных, анализ результатов; И. Э. Нигамедзянов, В. Н. Акбашев, К. К. Каримов — статистический анализ, оценка результатов, обзор литературы, компьютерное, объемное моделирование, 3D-печать костей таза, вертлужного и бедренного компонентов эндопротеза.
Соблюдение этических стандартов: исследование одобрено этическим комитетом БГМУ (протокол № 11 от 15 ноября 2023 г.).
Для корреспонденции: Владислав Николаевич Акбашев
ул. Ленина, д. 3., 45008, г . Уфа, Россия; ur.liam@bka-dalV
В последние десятилетия объемы оказания высокотехнологичной медицинской помощи в области травматологии и ортопедии существенно возросли, в том числе вмешательства по эндопротезированию крупных суставов нижних конечностей — тазобедренного и/или коленного сустава [1]. Тотальное эндопротезирование тазобедренного сустава (ТБС) — стандартная хирургическая процедура для лечения тяжелой патологии [2]. Основной целью эндопротезирования является уменьшение боли и восстановление функции нижней конечности, что позволяет пациенту вернуться к активной деятельности и улучшить качество жизни. При тотальном эндопротезировании ТБС вертлужный компонент и ножка эндопротеза должны иметь соответствующий размер и положение компонентов, что необходимо для достижения хороших функциональных результатов и долгосрочности службы протеза. Однако при неправильном позиционировании или определении размеров компонентов эндопротеза увеличивается риск развития интра- и послеоперационных осложнений, таких как удлинение или укорочение конечности, интраоперационные переломы, асептическое расшатывание, вывих головки эндопротеза и т. д. [3]. Все это способствует развитию послеоперационного болевого синдрома в области оперированного сустава, нестабильности и преждевременному износу компонентов эндопротеза, что приводит к неудовлетворенности пациента и снижению его качества жизни [4]. При любом эндопротезировании необходимо предоперационное планирование и интраоперационный контроль. Предоперационное планирование имеет первостепенное значение для оптимизации результатов при эндопротезировании ТБС. Оно помогает хирургу визуализировать окончательное положение имплантата после тщательного изучения клинических и рентгенографических данных [5]. В случае первичного эндопротезирования предоперационное планирование можно провести при помощи стандартных рентгенограмм, шаблонов (2D) или при помощи соответствующего программного обеспечения. При первичном эндопротезировании, когда оперативному вмешательству предшествовали травмы, остеотомии, операции, проведение предоперационного планирования затруднено в связи с нарушением рентгенанатомических критериев.
В качестве традиционного метода предоперационного планирования эндопротезирования ТБС используют стандартную рентгенограмму ТБС с наложением на нее шаблонов эндопротеза для точного определения размеров вертлужного и бедренного компонента эндопротеза, а также их позиционирования.
Трехмерное планирование позволяет более четко определить уникальные анатомические особенности и ориентиры пациента, а также обеспечивает оптимальную визуализацию для предоперационного определения размера имплантата. Методы 3D-планирования позволяют более точно определить размер вертлужного компонента и ножки эндопротеза (96–100%), по сравнению с 2D-шаблонами (16–43%). Результаты подтверждают превосходство 3D-методов над 2D-шаблонами в точности определения размеров имплантатов. Данные компьютерной томографии 3D-планирования являются привлекательной альтернативой навигации для восстановления длины и оси конечности [6–9].
Отсутствие единых подходов к планированию оперативного лечения не позволяет получать идентичные результаты лечения в аналогичных клинических ситуациях и необходимо создание определенного алгоритма предоперационного планирования для выбора тактики лечения при той или иной патологии сустава.
Целью данного исследования является проведение анализа эффективности трехэтапного предоперационного планирования артропластики ТБС в зависимости от нозологической формы дегенеративно-дистрофических заболеваний ТБС по сравнению со стандартным методом.
ПАЦИЕНТЫ И МЕТОДЫ
Был проведен сравнительный анализ оценки результатов различных методов предоперационного планирования эндопротезирования ТБС. В исследовании приняли участие 224 пациента. Критерии включения пациентов в исследование: наличие первичного (идиопатического) остеоартроза ТБС III–IV стадии (по классификации Kellgren & Lawrence ) с нарушением функции сустава III степени и более; наличие асептического некроза головки бедренной кости II–III и наличие выраженного болевого синдрома; посттравматическая патология (состояние после остеосинтеза проксимального отдела бедра или вертлужной впадины в связи с переломом данных сегментов) с развитием осложнений в виде посттравматического остеоартроза или ложного сустава и нуждающиеся в артропластике ТБС. Диагноз был установлен на основании клинико-анамнестических данных, а также с использованием дополнительных инструментальных методов исследования (рентгенографии, компьютерной и магнитно-резонансной томографии). Критерии исключения: наличие инфекционно-воспалительных заболеваний пораженного сегмента; наличие сопутствующих соматических заболеваний, которые являлись абсолютным противопоказанием к проведению операции; отсутствие добровольного согласия пациента, возраст моложе 18 лет. Всех пациентов разделили на две группы: группа исследования (116 человек) и группа сравнения (108 человек). В группе исследования было выделено три подгруппы: 34 пациента с остеоартрозом (средний возраст 60,8 ± 7,2), 30 пациентов с аваскулярным некрозом головки бедра (средний возраст 43,9 ± 7,9 лет), 52 пациента с посттравматической патологией ТБС (этой группе пациентов был выполнен остеосинтез вследствие перелома: шейки, вертельной зоны бедра, вертлужной впадины таза и т. п.) (60,2 ± 11,1 лет). Группа сравнения также была разделена на три подгруппы: 33 пациента с остеоартрозом (средний возраст 61,3 ± 6,8), 29 пациентов с аваскулярным некрозом головки бедра (42,6 ± 8,4 года), 46 пациентов с посттравматической патологией ТБС (59,3 ± 12,7 года). Средний возраст пациентов среди всех исследуемых был равен 57 ± 6,2 года, женщины составили 119 человек (53,12%), мужчины 105 человек (46,87%).
В группе исследования (n = 116) предоперационное планирование артропластики ТБС проводили в три этапа.
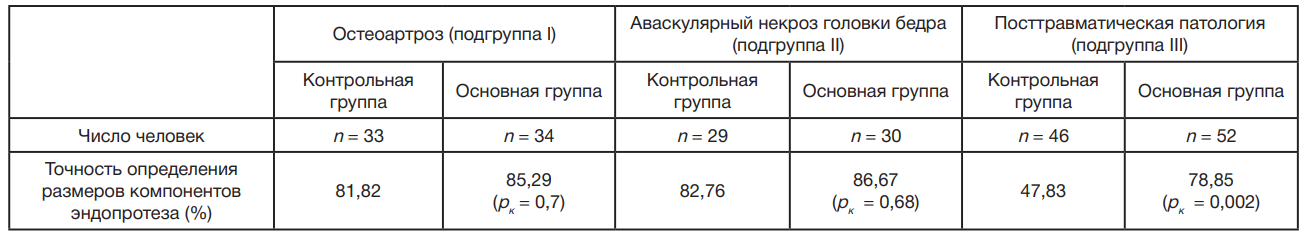
На первом этапе в области вертлужной впадины и бедра на основе компьютерной томографии (КТ) ТБС определяли плотности кости в трех плоскостях по шкале Хаунсфилда. Плотность оценивали по всему периметру опорных зон с учетом планируемого места расположения и установки имплантата. Важным критерием установки и позиционирования эндопротеза было определение зоны с оптимальной плотностью костной ткани, а также участков со сниженной плотностью, остеосклерозом, кистами и различными дефектами. При проведении предоперационного планирования у пациентов после остеосинтеза определение плотности опорных зон было затруднено из-за наличия «металлических артефактов» (рис. 1 и рис. 2).
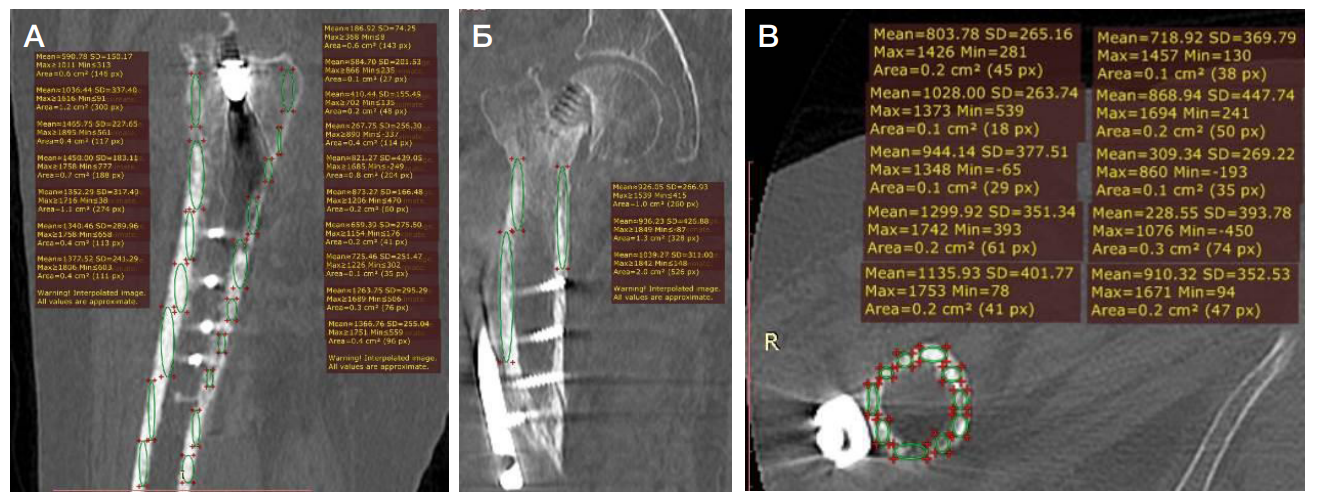
На втором этапе для определения оптимального размера и положения компонентов эндопротеза использовали программное обеспечение ТравмаКад версии 2.4 (Brainlab; United States). Для этого в программу загружали рентгенограмму таза с захватом ТБС, на которую накладывали цифровой шаблон бедренного и вертлужного компонента эндопротеза. При этом полная визуализация проксимального отдела бедра при предоперационном планировании эндопротезирования с помощью программного обеспечения была затруднена из-за наличия металлоконструкции (рис. 3).
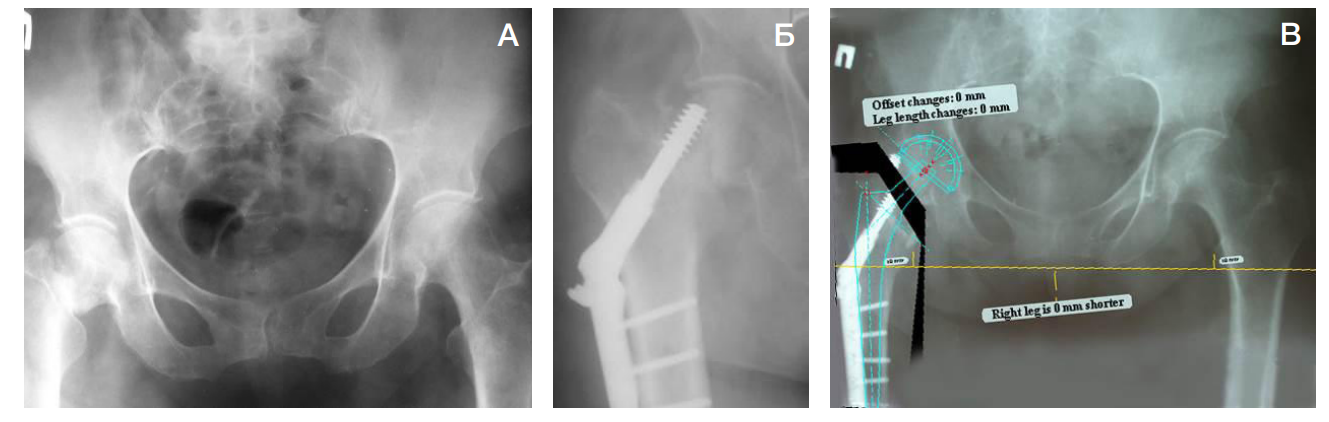
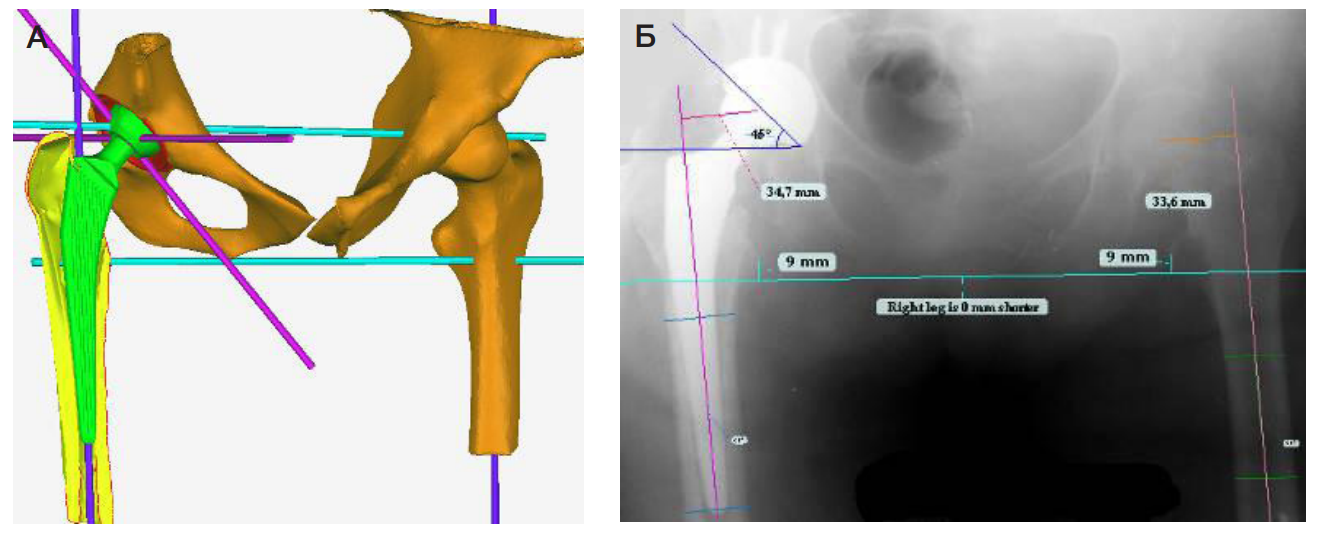
Третьим этапом при помощи программного обеспечения Geomagic Studioс (Raindrop Geomagio Inc.; USA) и 3D Slicer (Copyright 2023, Slicer Community; USA) проводили виртуальную установку компонентов эндопротеза после создания объемной модели исходного состояния (рис. 4). Данный этап позволил провести оценку нарушения анатомии сегмента, определить более точное позиционирование эндопротеза, провести стартовую биомеханику, помимо этого, определить тактику проведения эндопротезирования ТБС. При выраженных деформациях ТБС помимо компьютерного моделирования проводили 3D-печать пораженного сегмента до и после эндопротезирования ТБС (рис. 5).
В контрольной группе (n = 108) предоперационное планирование проводили с применением стандартных методов: использовали рентгенограммы таза с захватом ТБС в прямой-задней проекции и накладывали на нее шаблоны компонентов эндопротеза (скиц) для определения размера импланта.
После предоперационной подготовки в обеих исследуемых группах было проведено оперативное лечение — тотальное эндопротезирование ТБС.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
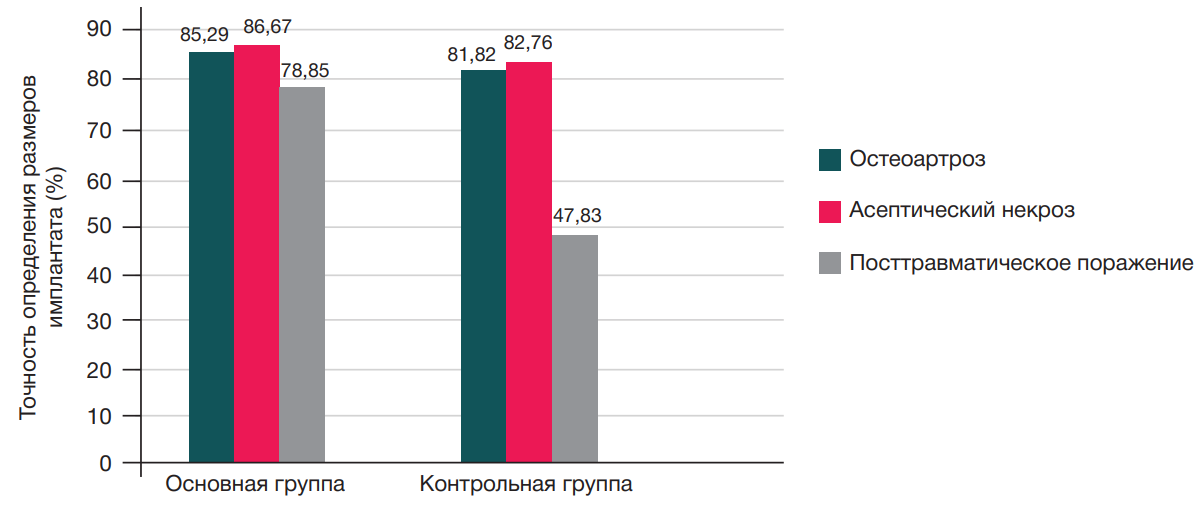
Оценку результатов проводили на основании соответствия размеров компонентов эндопротеза, которые определяли в предоперационном периоде и во время самой операции (интраоперационно). У пациентов с остеоартрозом и аваскулярным некрозом головки бедра в основной группе точность определения размеров импланта была выше, но сопоставима с контрольной группой (p > 0,05), в подгруппе с посттравматической патологией была отмечена статистически значимая разница по точности определения предполагаемых размеров компонентов эндопротеза в основной и контрольной группах (рк = 0,002). Основные результаты и точность определения размеров импланта в зависимости от нозологии и примененного метода предоперационного планирования продемонстрированы в табл. 1 и на рис. 6.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Сопоставимость результатов у пациентов с остеоартрозом и асептическим некрозом в основной и контрольных группах может быть связана с незначительными анатомическими нарушениями сегмента таза и нижней конечности, в то время как у пациентов с посттравматической патологией планируемые размеры компонентов эндопротеза в контрольной группе не соответствовали фактически установленной более чем в половине случаев, что говорит о низкой эффективности применения стандартного метода планирования для данной группы пациентов, ввиду более выраженной нарушенной анатомии сегментов в результате перелома, последствий остеосинтеза и реконструктивных операций, а также нарушения анатомии ТБC, конгруэнтности суставных поверхностей, вторичной деформации таза и позвоночника, укорочения нижней конечности более чем на 3 см [10–12].
В результате анализа был создан алгоритм выбора различных методов предоперационного планирования в зависимости от формы дегенеративно-дистрофических поражений ТБС и выраженности его анатомических нарушений (табл. 2).
ВЫВОДЫ
Предложенный подход к выбору технологии предоперационного планирования позволяет точно определить размер компонентов эндопротеза, а также способствует правильной ориентации и позиционированию компонентов эндопротеза при проведении артропластики ТБС. Предложенный алгоритм трехэтапной методики показал более высокую эффективность предоперационного планирования и индивидуального проектирования для пациентов с различной нозологической формой дегенеративно-дистрофических заболеваний ТБС по сравнению со стандартным методом и позволил точно определить размер компонентов эндопротеза. Предоперационное планирование эндопротезирования ТБС по предложенной методике позволяет оценить характеристики патологического процесса на локальном и системном уровнях. Наиболее сложная ситуация отмечена у пациентов с посттравматической патологией ТБС. Это связано с тем, что у данной группы пациентов, как правило, имеется значимое разрушение костных структур в опорных зонах бедра и вертлужной впадины.


- Khoziainova SS, et al. Physical therapy in the rehabilitation of patients after endoprosthetic replacement of major joints in the lower extremities: a scientometric analysis of evidence-based studies. Vopr kurortol fizioter lech fiz kul’t. 2019; 96 (6): 22. DOI: 10.17116/kurort20199606122. Russian.
- Thirion T, Georis P, Gillet P. Preoperative planning interest of a total hip prosthesis. Rev Med Liege. 2019; 74 (11): 593–597.
- Huo Jet et al. Value of 3D preoperative planning for primary total hip arthroplasty based on artificial intelligence technology. J Orthop Surg Res. 2021; 16 (1): 156. DOI: 10.1186/s13018-021-02294-9.
- Knafo Y, Houfani F, Zaharia B, Egrise F, Clerc-Urmès I, Mainard D. Value of 3D preoperative planning for primary total hip arthroplasty based on biplanar weightbearing radiographs. BioMed Research International. 2019; 2019: 1–7. DOI: 10.1155/2019/1932191.
- Moralidou M, Di Laura A, Henckel J, Hothi H, Hart AJ. Threedimensional pre-operative planning of primary hip arthroplasty: a systematic literature review. EFORT Open Reviews. 2020; 5 (12): 845–55. DOI: 10.1302/2058-5241.5.200046.
- Alagha MA, Logishetty K, O’Hanlon C, Liddle AD, Cobb J. Threedimensional preoperative planning software for hip resurfacing arthroplasty. Bioengineering (Basel). 2023; 10 (8): 939. DOI: 10.3390/bioengineering10080939.
- Schiffner E, et al. Is computerised 3D templating more accurate than 2D templating to predict size of components in primary total hip arthroplasty. HIP International. 2019; 29 (3): 270–275. DOI: 10.1177/1120700018776311.
- Ding X, et al. Value of preoperative three-dimensional planning software (AI-HIP) in primary total hip arthroplasty: a retrospective study. J Int Med Res. 2021; 49 (11). DOI: 10.1177/03000605211058874.
- Inoue D, et al. Value of computed tomography-based three-dimensional surgical preoperative planning software in total hip arthroplasty with developmental dysplasia of the hip. Journal of Orthopaedic Science. 2015; 20 (2): 340–46. DOI: 10.1007/s00776-014-0683-3.
- Zheng Cao, Wei Yang, Minzhi Yang, Xiangpeng Kong, Yi Wang, Renwen Guo, et al. Application of preoperative digital-template planning in total hip arthroplasty via direct anterior approach. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2019; 33 (11): 1374– 1378. DOI: 10.7507/1002-1892.201903108. In Chinese.
- Takegami Y, Komatsu D, Seki T, Ishiguro N, Hasegawa Y. Total hip arthroplasty after failed curved intertrochanteric varus osteotomy for avascular necrosis of the femoral head. Nagoya J Med Sci. 2016; 78 (1): 89–97. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4767517/.
- Gautam D, Gupta S, Malhotra R. Total hip arthroplasty in acetabular fractures. J Clin Orthop Trauma. 2020; 11 (6): 1090– 8. DOI: 10.1016/j.jcot.2020.10.037.