ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Влияние пробенецида на активацию астроцитов in vitro
1 Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва, Россия
2 Московский государственный университет имени М. В. Ломоносова, Москва, Россия
Нейровоспаление развивается в мозговой ткани как при острых повреждениях мозга, так и при нейродегенеративных заболеваниях. От баланса провоспалительных и противовоспалительных факторов будет зависеть исход нейровоспаления и прогноз функционального состояния мозга. Поэтому целью многих исследований является поиск возможных терапевтических мишеней, позволяющих сдвигать ход воспалительной реакции в пользу реализации противоспалительных механизмов. Показано, что каналы, образованные белками паннексинами экспрессируются во всех клетках мозга, в том числе и в астроцитах. Однако их роль в процессах нейровоспаления пока не ясна. Каналы, сформированные паннексином 1 (Panx1), могут быть вовлечены в провоспалительную активацию астроцитов, индуцируемую тромбином и/или липополисахаридом (ЛПС). Целью исследования было оценить тромбин- и ЛПС-вызванную активацию первичных кортикальных астроцитов мыши в условиях блокады Panx1 пробенецидом. Установлено, что и в случае аппликации тромбина (50 и 100 нМ), и в случае инкубации клеток с ЛПС, происходит изменение функционального профиля астроцитов, изменяется их пролиферация и секреторная активность. Наблюдаемое при этом увеличение секреции NO, β-гексозаминидазы (БГА) и IL6 прекращалось на фоне обработки клеток пробенецидом. Полученные результаты свидетельствуют о возможности рассматривать пробенецид в качестве потенциального агента, влияющего на воспалительный процесс в мозговой ткани путем стабилизации астроцитов через инактивацию Panx1 и снижение астроглиоза.
Ключевые слова: нейровоспаление, пробенецид, паннексин 1, Panx1, астроциты, тромбин, липополисахарид, астроглиоз
Финансирование: работа поддержана Российским научным фондом, грант 22-25-00848.
Вклад авторов: И. И. Бабкина, М. П. Морозова — получение и ведение первичной культуры астроцитов; сбор, интерпретация и статистическая обработка данных, написание рукописи; В. В. Мазеева — получение и ведение первичной культуры астроцитов, интерпретация и статистическая обработка данных; Л. Р. Горбачева — концепция и дизайн эксперимента, интерпретация данных, руководство проектом, написание рукописи.
Соблюдение этических стандартов: исследование одобрено этическим комитетом РНИМУ имени Н. И. Пирогова (протокол № 23/2021 от 13 декабря 2021 г.).
Для корреспонденции: Любовь Руфэльевна Горбачева
ул. Островитянова, д. 1, г. Москва, 117997; ur.liam@76ibrog
Воспалительный ответ направлен на удаление повреждающего агента и восстановление структурнофункциональной целостности ткани и может сопровождаться как патогенетическими, так и адаптивными изменениями. Запуск острой воспалительной реакции в нервной ткани способен активировать процессы нейрогенеза, ангиогенеза и функциональной пластичности нейронов. Однако хроническое течение воспаления потенциирует дальнейшую альтерацию клеток и усугубляет ход нейродегенеративных заболеваний, повышая риск развития осложнений и инвалидизации пациентов.
Астроциты — одни из самых многочисленных клеток ЦНС, вовлеченных в реализацию нейровоспаления. Степень их активности в значительной мере определяет исход нейровоспаления. Активированные резидентные и иммунокомпетентные клетки ЦНС, включая микроглию и астроциты, являются источниками провоспалительных факторов. В результате происходит увеличение проницаемости ГЭБ, инфильтрация иммунных клеток в ткани мозга, дополнительная альтерация, активация системы гемостаза и образование тромбина.
Показано, что развитие нейродегенеративных процессов сопряжено с тромбин-зависимым усилением активации микроглии и опосредовано стимуляцией iNOS, секрецией активных форм кислорода (АФК) и провоспалительных факторов СОХ2, TNFα, IL1β, IL6 [1]. Кроме того, тромбин потенцирует пролиферацию астроцитов через активацию PAR1/МАРК-каскада.
Запуск нейровоспаления может быть также вызван экзогенными факторами, например, липополисахаридом (ЛПС), компонентом клеточной стенки бактерий. Основной мишенью ЛПС является рецептор TLR4, экспрессируемый астроцитами, микроглией и эндотелием, а его активация запускает образование провоспалительных медиаторов.
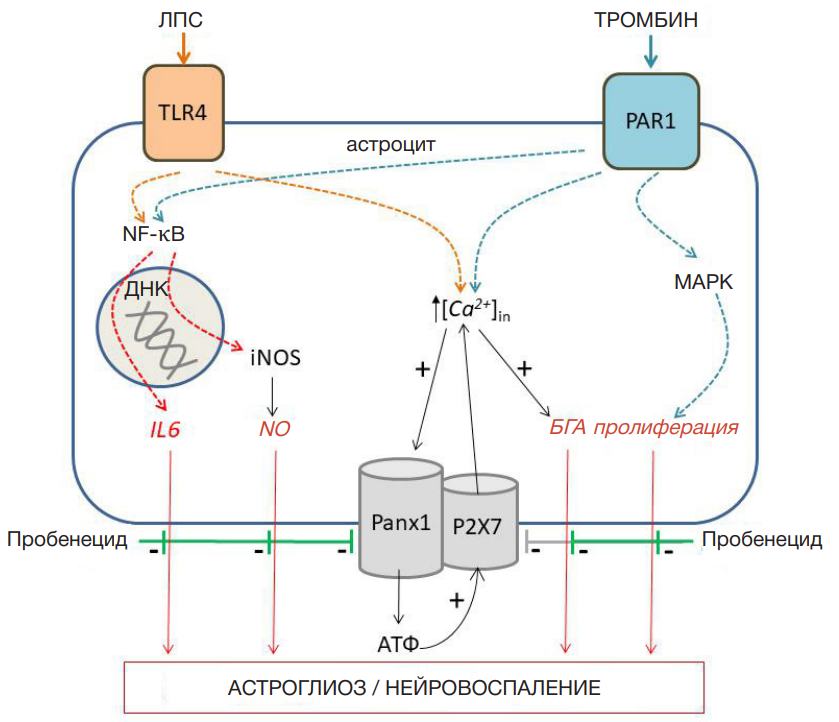
Важную роль в развитии воспалительного ответа с участием астроцитов играют каналы, образованные белками паннексинами. Последние не только обеспечивают транспорт веществ, но и формируют ансамбли с другими ионо- и метаботропными рецепторами, регулируя активность этих рецепторов [2]. Особую роль играет паннексин 1 (Panx1), который широко представлен в ЦНС и экспрессируется нейронами, астроцитами, микроглией, церебральным эндотелием и гладкомышечными клетками [3]. Panx1 регулирует высвобождение из клеток АТФ и других нуклеотидов, сборку инфламмасом и секрецию цитокинов, что определяет его вклад в развитие ряда нейродегенеративных процессов. В связи с этим, Pаnx1 является потенциальной мишенью для фармакотерапии нейродегенеративных заболеваний и острых повреждений мозга [4, 5].
Потенциальным нейропротектором может быть пробенецид, обладающий широким спектром действия, включая ингибирование Panx1. Показано, что пробенецид способен специфично активировать TRPV2 в сенсорных нейронах и блокировать высвобождение ATФ из клеток как астроцитов, так и микроглии [5, 6]. Поэтому его рассматривают в качестве перспективного препарата для лечения нейродегенеративных и психиатрических заболеваний.
Таким образом, цель настоящего исследования оценить влияние пробенецида, блокатора Panx1, на тромбин- и ЛПС-индуцированную провоспалительную активацию астроцитов мыши in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Вещества и растворы
В работе были использованы следующие реактивы: 10× HBSS без Са2+ и Мg2+ (Gibco; США), 1 М HEPES (Gibco; США), 10× PBS (Gibco; США), BSA (Sigma; США), среда для культивирования клеток DMEM/F12 (Gibco; США), инактивированная телячья сыворотка HI FBS (Gibco; США), пенициллин-стрептомицин (Invitrogen; США), трипсин-ЭДТА (Gibco; США), раствор Версена («Панэко»; Россия); пробенецид (BioQuest; США); тромбин (Sigma; США), липополисахарид Escherichia coli O111:B4 (L3024; Sigma, США), WST-1 (Sigma; США), реактив Грисса (Sigma; США), реактив для измерения клеточной пролиферации WST-1 ДНКаза (Sigma; США), Mouse IL6 ELISA kit (abcam ab 222503), Triton ×100, лизирующий буфер, раствор RIPA и ингибиторы протеаз и фосфатаз, реагент Бредфорда (Bio-Rad; США).
Получение и ведение первичной культуры астроцитов
Первичные кортикальные астроциты выделяли из полушарий мозга мышей линии С57BL/6 в возрасте 0–3 дня. Для получения клеточных культур использовали протокол, описанный ранее [7]. Полушария головного мозга извлекали и помещали в буфер (1× HBSS, 100 мМ пирувата натрия и 1М HEPES), промывали и измельчали. Далее гомогенат мозга инкубировали с папаином 0,5 мг/мл (1× PBS, L-Cystein-HCl, BSA, глюкоза, 8 мин, 37 °С). Затем гомогенат ресуспендировали в буфере, содержащем ДНКазу (0,01 мг/мл), после чего центрифугировали при 1500 об. в течение 5 мин при +4 °С. Полученный осадок ресуспендировали в буфере (1× HBSS c Ca2+ и Mg2+, 100 мМ пируват натрия, 1М HEPES) и повторно центрифугировали. Осадок ресуспендировали в 1 мл культуральной среды (DMEM/F12, 10% FBS, антибиотикантимикотик, GlutaMAХ). Клетки помещали в культуральные флаконы 25 см2 и культивировали 10–12 дней при 37 °С и 5% СО2. На 2-е и 7-е сутки проводили полную смену среды, удаляя микроглию, помещая флакон с клетками на шейкер на 6–8 ч с последующей заменой среды на свежую. За 4 суток до эксперимента клетки снимали с флакона 0,05%-м раствором трипсина в фосфатно-солевом буфере и помещали в 48-луночные планшеты. Перед экспериментальным воздействием среду в культурах заменяли на бессывороточную на 3 ч с последующим добавлением тромбина в конечной концентрации 50 нМ или 100 нМ или ЛПС в концентрации 100 нг/мл или 1 мкг/мл. Пробенецид 0,1 мМ добавляли за 30 мин до воздействия тромбина или ЛПС. Через 6, 24 и 48 ч проводили измерения.
Измерение выживаемости астроцитов (WSТ-тест)
Выживаемость оценивали через 24 ч после активации астроцитов с помощью теста WST-1 в соответствие с протоколом производителя. Оптическую плотность образцов измеряли при λ = 450 нм на планшетном фотометре iMark (BioRad; США). Полученные данные интерпретировали как пролиферацию клеток, предполагая, что вклад клеточной гиперплазии в данных условиях не значителен, и ориентируясь на производителя, представляющего данный тест как WST-1-пролиферативный реагент.
Измерение накопления нитритов в среде культивирования астроцитов
Секрецию оксида азота (NO) оценивали по накоплению в среде культивирования нитритов через 24 ч после инкубации с индукторами воспаления с помощью реактива Грисса. Реактив Грисса при взаимодействии с нитритами образует окрашенные азотсоединения, интенсивность поглощения которых оценивали при λ = 530 нм на планшетном фотометре iMark (BioRad; США). Результаты представляли в относительных значениях, как секрецию NO одной клеткой, используя отношение уровня нитритов в культуральной среде к количеству клеток в соответствующей лунке планшета, оцененному при помощи WST-теста.
Измерение активности β-гексозаминидазы
Активность β-гексозаминидазы (БГА) оценивали через 24 и 48 ч после активации астроцитов по модифицированному методу, предложенному Schwartz LB и соавторами [8] в супернатанте и внутриклеточно для последующего расчета секреции фермента по формуле:
Х (Х + Y) × 100%,
где Х — оптическая плотность образца, отражающая активность фермента в среде культивирования за вычетом оптической плотности фона; Y — оптическая плотность образца, отражающего активность внутриклеточного пула фермента за вычетом оптической плотности фона.
Далее секрецию БГА представляли в относительных единицах по отношению к контролю, принятому за 1.
Измерение уровня секреции IL6 астроцитами
Секрецию IL6 через 6 ч после воздействия исследуемых веществ на первичную культуру астроцитов оценивали с помощью коммерческого набора ELISA (Mouse IL6 ELISA kit (abcam ab 222503) в соответствии с протоколом производителя. Предел чувствительности IL6 составлял 30 пг IL6/мл. После воздействия исследуемых веществ отбирали культуральную среду, в которой определяли с помощью набора содержание IL6. Клетки в лунках планшета промывали натрий-фосфатным буфером и лизировали с помощью RIPA-буфера с добавлением ингибиторов протеаз. Лизаты центрифугировали при 14 000 g 15 мин при 4 °С, после чего в супернатанте измеряли содержание общего белка с помощью реактива Бредфорда. Секрецию IL6 представляли в пг/мг общего белка.
Статистическая обработка
Анализ данных производили в программе GraphPad Prism 8 (GraphPad Software Inc.; США). Нормальность распределения выборок проверяли с использованием критерия Шапиро–Уилка. Для сравнения групп использовали двухфакторный дисперсионный анализ ANOVA с последующим апостериорным анализом при помощи критерия Тьюки. Данные представлены как среднее арифметическое ± стандартная ошибка (SEM), различия считали статистически значимыми (*) при р < 0,05. Количество экспериментов (n, число посадок астроцитов) указаны в каждом случае отдельно.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
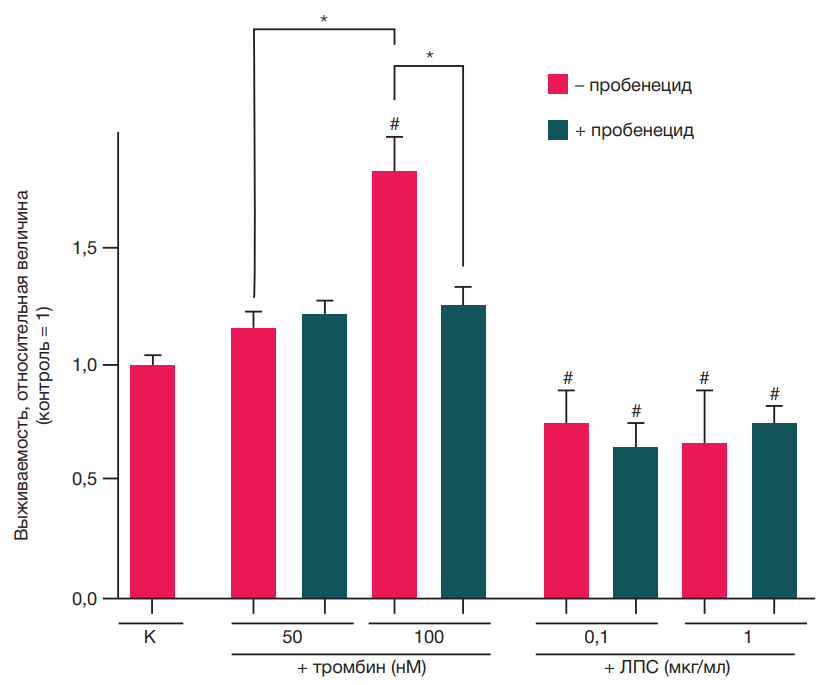
Влияние пробенецида на выживаемость активированных тромбином и ЛПС астроцитов
Тромбин является одним из участников воспалительного ответа, поскольку система гемостаза одной из первых реагирует на повреждение тканей. В первой серии экспериментов нейровоспаление моделировали добавлением тромбина в среду культивирования астроцитов мыши. Продемонстрировано, что тромбин в концентрации 100 нМ значимо (р < 0,05) повышает число живых астроцитов, а обработка клеток пробенецидом снижает данный показатель до контрольных значений, что может свидетельствовать об участии Panx1 каналов в тромбин-индуцированной пролиферации астроцитов (рис. 1). В отличие от тромбина, ЛПС в данных условиях во всех используемых концентрациях вызывал снижение выживаемости, что может свидетельствовать о его токсическом действии на астроциты (рис. 1). Пробенецид не изменял эффект ЛПС (рис. 1).
Влияние пробенецида на секрецию NO активированными астроцитами
Увеличение продукции NO в очаге поражения является признаком развития нейровоспаления. Исследование влияния тромбина и ЛПС на секрецию NO астроцитами показало, что через 24 ч после аппликации тромбина 100 нМ, но не 50 нМ происходит значительное накопление нитритов в культуральной среде астроцитов, при этом пробенецид отменяет тромбин-вызванную секрецию NO, что указывает на необходимость участия в данном процессе Panx1 (рис. 2). В случае с 24-часовой инкубацией клеток с ЛПС наиболее выраженный рост секреции был обнаружен при концентрации 0,1 мкг/кг ЛПС, который удавалось отменить блокадой Panx1. При повышении концентрации ЛПС до 1 мкг/кг секреция NO не отличалась от контрольных значений и не зависела от Panx1 (рис. 2).
Влияние пробенецида на секрецию β-гексозаминидазы активированными астроцитами
Другим маркером провоспалительной активации астроцитов может быть высвобождение из клеток лизосомного фермента β-гексозаминидазы (БГА).
Оценку влияния пробенецида на секрецию БГА астроцитами осуществляли через 24 и 48 ч после их активации тромбином в концентрации 50 и 100 нМ и ЛПС 0,1 и 1 мкг/мл. Через 24 ч наблюдали провоспалительное действие тромбина в концентрации 100 нМ и привлечение к реализации данного эффекта Panx1, поскольку его блокада пробенецидом значимо снижает секрецию БГА (рис. 3). Аппликация ЛПС в концентрации 0,1 мкг/мл вызывала через 24 ч активацию клеток, в отличие от влияния 1 мкг/мл ЛПС (рис. 3). В обоих случаях блокада Panx1-каналов пробенецидом не изменяла эффекта эндотоксина (рис. 3).
Увеличение времени экспозиции тромбина с 24 до 48 ч привело к более выраженному повышению секреции БГА астроцитами и было опосредовано Panx1, поскольку на фоне пробенецида данный показатель снижается до контрольных значений (рис. 4). Секреция БГА на фоне ЛПС, аналогично тромбину, более выражена через 48 ч после воздействия. При этом противоспалительный эффект пробенецида проявляется только на фоне ЛПС в концентрации 1 мкг/мл — секреция БГА клетками снижается до уровня контроля (рис. 4).
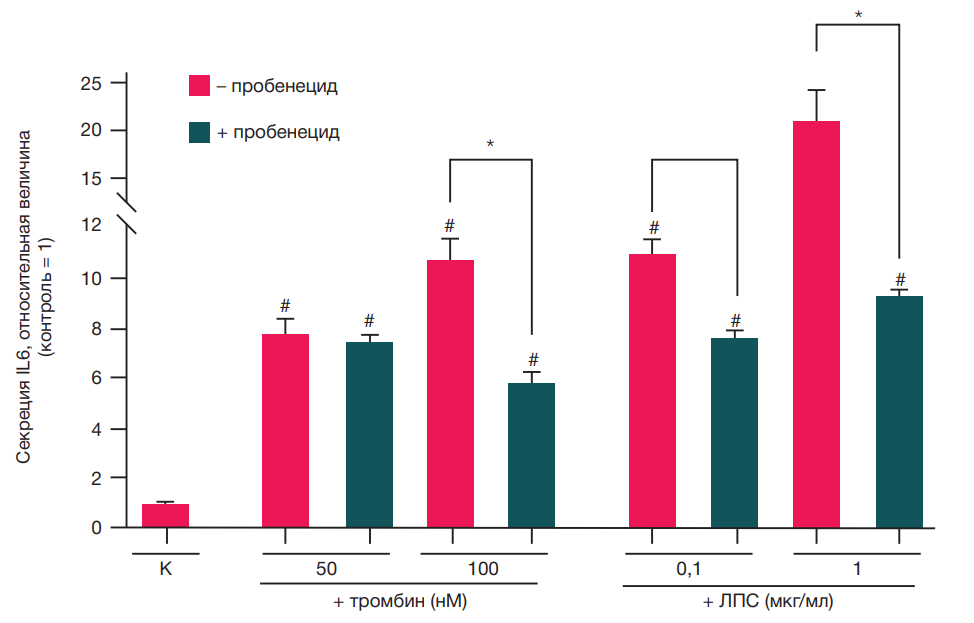
Влияние пробенецида на секрецию IL6 активированными астроцитами
Активация астроцитов сопряжена с секрецией провоспалительных цитокинов, в частности, IL6. Высокие концентрации тромбина и ЛПС вызывали увеличение уровня секреции IL6 через 6 ч после индукции. При этом эффект ЛПС был в 2 раза более выраженным по сравнению с действием тромбина (р < 0,05). Таким образом, ЛПС оказался более специфичным провоспалительным агентом. Пробенецид в обоих случаях имел противоспалительный эффект и отменял провоспалительную активацию астроцитов, вызванную как тромбином, так и ЛПС, существенно снижая уровень секреции IL6 (рис. 5), что указывает на участие Panx1 в реализации секреторной функции реактивных астроцитов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хроническое нейровоспаление является патогенетическим фактором, запускающим процессы нейродегенерации и повышающим риск необратимого повреждения ЦНС. Астроциты, наиболее многочисленные клетки мозга, обеспечивающие взаимодействие глии и нейронов, могут участвовать в регуляции нейровоспаления. Провоспалительная активация астроцитов сопряжена с усилением их пролиферативной и секреторной активности и может сопровождаться открытием каналов Panx1 [9].
Высвобождение АТФ из клеток, в том числе через Panx1, является сигналом для множества функций: от миграции, пролиферации и роста в физиологических условиях до запуска нейровоспаления и нейродегенерации при патологических состояниях. Эффекты АТФ реализуются через пуринэргические рецепторы: лиганд-управляемые ионные каналы (P2X) и метаботропные рецепторы, связанные с G-белком (P2Y). В запуске нейровоспаления важная роль принадлежит Р2Х7-рецепторам. Таким образом, пробенецид через блокаду Panx1 способен ограничивать высвобождение АТФ и опосредованно — пуринергическую передачу сигналов [6]. Однако есть сведения, что пробенецид может непосредственно блокировать Р2Х7-рецепторы [10].
Интересно, что кооперация Panx1 с рецепторами P2Y1 и P2Y2 через PLC-каскад вызывает рост уровня Са2+ в клетке, что повышает активацию Panx1 [11]. Предположительно Са-индуцированная активация Panx1 происходит через фосфорилирование CaMKII, открытие Panx1 и высвобождение АТФ [12].
При ишемии головного мозга и развитии эксайтотоксичности происходит гиперактивация NMDAR, что активирует Panx1 и запускает проапоптотические сигнальные пути [13]. Активация Panx1 инициирует сборку инфламмасом — мультимерных белковых комплексов в цитозоле всех клеток, которые контролируют воспалительную реакцию. Активация инфламмасомы обеспечивает появление активной формы провоспалительной каспазы-1, которая расщепляет про-IL1β и про-IL18 с образованием зрелых цитокинов IL1β и IL18 [3, 6]. Через каспазу-1 запускается и пироптоз — провоспалительная форма гибели клеток, сопровождающаяся высвобождением провоспалительных сигналов. Высвобождение АТФ, например через Раnx1, в окружающую среду и последующая активация P2X7R также ведут к активации воспалительных процессов, сборке инфламмасом и продукции IL1β [6].
Интересно, что в системе совместного культивирования нейроны-астроциты АТФ и глутамат, высвобождаемые из астроцитов, обработанных кондиционированной средой от активированной микроглии, вызывают гибель нейронов за счет активации Panx1 нейронов [14]. Таким образом, Panx1 регулирует высвобождение АТФ и других нуклеотидов, сборку инфламмасом и секрецию цитокинов, что может определять его вклад в развитие нейродегенерации. Поэтому Pаnx1 является потенциальной мишенью для фармакотерапии нейродегенеративных заболеваний и острых повреждений мозга. Показано возможное сопряжение PAR1 с каналами Panx1 [15].
Нами продемонстрирован рост числа астроцитов под действием тромбина (рис. 1). Подобный эффект может быть сопряжен с тромбин/PAR1-опосредуемым фосфорилированием ERK1/2 или активацией PLCε, которая в свою очередь регулирует MAPK/NF-κBвнутриклеточный каскад [16]. Этот эффект может быть также связан с запуском тромбин/PAR1-зависимой секрецией IL6 астроцитами и передачей дальнейшего сигнала через IL6/STAT3-путь, развитием астроглиоза, в том числе увеличением уровня кислого фибриллярного белка астроцитов (GFAP) и виментина. В работе показано, что пробенецид ингибирует тромбин-опосредованный рост числа астроцитов и возвращает данный показатель к контрольным значениям, что указывает на возможность вовлечения Panx1-каналов в данный процесс. Это согласуется с данными, полученными на эпителиальных клетках легких и эндотелиоцитах человека, где продемонстрирована тромбин-зависимая активация каналов Panx1 [15, 17]. Однако механизмы подобной кооперации еще предстоит изучить.
Для моделирования воспалительного ответа в эксперименте широко применяют провоспалительный фактор ЛПС. Известно, что провоспалительную активацию клеток под действием ЛПС опосредует TLR4. Через TLR4 запускается активация целого ансамбля факторов, включая NF-κB через сигнальный комплекс MyD88-IRAK-TRAF6-TAK1 [18]. В результате возможны изменение пролиферации астроцитов, экспрессия провоспалительных цитокинов через активацию MAPK/NF-kB [19]. Кроме этого, показано, что в ЛПС-опосредованном воспалении может быть задействован каскад Akt/ERK/JNK, поскольку при его блокаде снижалась секреция провоспалительных цитокинов [20]. Существуют данные о ЛПС/TLR4-зависимом повышении уровня пролиферации астроцитов мыши.
В настоящей работе показано, что ЛПС снижает выживаемость клеток, но активирует секрецию первичных культивируемых кортикальных астроцитов мыши. Ожидаемо, что вызванная ЛПС активация астроцитов приводила к стойкому увеличению секреции провоспалительного интерлейкина IL6 (рис. 5) и в меньшей степени — NO и БГА (рис. 3, рис. 4). Интересно, что блокада Panx1-каналов пробенецидом значимо снижала ЛПСвызванную провоспалительную секрецию астроцитов.
Провоспалительная активация астроцитов сопровождается увеличением продукции множества хемокинов, цитокинов, а также активацией индуцибельной NO-синтазы (iNOS) и секрецией NO [21, 22]. Показано, что повышение образования NO сопутствует течению многих нейродегенеративных заболеваний, например болезни Альцгеймера и Паркинсона, а также может участвовать в образовании активных форм азота, оказывая цитотоксическое действие на нервные клетки [23, 24]. В астроцитах индукторами синтеза NO могут выступать как эндогенные, так и экзогенные провоспалительные факторы [21, 24]. Так, нами показано повышение секреции NO первичными астроцитами мыши под действием тромбина и ЛПС (рис. 3). Ранее на клетках астроцитомы были продемонстрированы PAR1-опосредованная секреция NO и активация iNOS [25]. Наблюдаемая нами тромбин-вызванная продукция NO культивируемыми астроцитами при блокаде Panx1 пробенецидом снижалась (рис. 3). Этот факт указывает на возможность кооперации тромбинового рецептора PAR1 и Panx1. Известно, что активацию Panx1-канала может индуцировать высокая концентрация внутриклеточного Са2+, которая, в свою очередь, может быть следствием активации сигнального пути тромбин/PAR1/Gq/РКС/IP3 [4]. Panx1-зависимый выброс АТФ через P2X7 усиливает тромбин-вызванное увеличение внутриклеточного кальция [26] и активацию nNOS и eNOS в астроцитах.
Нами показано, что ЛПС-стимулируемая секреция NO астроцитами так же, как и вызванная тромбином, отменяется в присутствии пробенецида (рис. 2). Другие исследователи наблюдали зависимость эффектов ЛПС от Panx1 на HK-2-клетках. Например, обнаружено облегчение течения ЛПС-индуцированного воспаления на фоне блокады Panx1, выраженное в ингибировании NLRP3 и снижении экспрессии Bax и Bcl2 [27].
Известно, что уровень активации иммунокомпетентных клеток (макрофагов, тучных клеток) может быть оценен по уровню секреции БГА. В нашей работе мы оценили по субстрат-ферментной реакции активность БГА в среде культивирования астроцитов через 24 и 48 ч после аппликации тромбина и ЛПС. Как в случае действия тромбина, так и ЛПС увеличение секреции БГА было более выражено через 48 ч, что, вероятно, связно с «отставленной» активацией астроцитов по принципу положительной обратной связи. Эти результаты согласуются с данными о тромбин-зависимом росте секреции БГА в тромбоцитах и тучных клетках, на которых показано вовлечение Р2Х7 рецепторов в активацию дегрануляции [28].
К специфичным маркерам воспаления относится провоспалительный цитокин IL6. Анализ его уровня в исследуемых нами культурах астроцитов подтвердил выраженный провоспалительный эффект как тромбина, так и, в большей степени, ЛПС (рис. 5). Подобный провоспалительный эффект тромбина был ранее показан на астроцитах [29]. Данный эффект протеазы связывают с тромбин/PAR1-зависимой активацией белка G12/13, запускающего каскад RhoGEF/RhoA/фосфолипаза Cε — DAG и PKС — PKD, завершающийся повышением экспрессии IL6, COX-2 и других провоспалительных генов [30]. Выраженное провоспалительное действие ЛПС на астроциты с индукцией секреции IL6 было так же продемонстрировано другими исследователями [31]. Вместе с тем, в настоящем исследовании мы впервые показали пробенецид-зависимое снижение тромбин- и ЛПС-вызванной секреции IL6 на первичных культурах астроцитов (рис. 6). Z. Zhang с соавторами при сепсисе в гиппокампе, а L. Wei с коллегами на клетках U87-MG наблюдали пробенецид-вызванное ингибирование экспрессии TNFα, IL6, IL1β и IL8, в том числе в присутствии ЛПС [19, 32]. В то же время существуют работы, которые не подтверждают участие Panx1 и потенциальных гетеродимеров P2X4/P2X7 в P2X7-зависимом высвобождении IL6, CCL2 и TNFα в микроглии [33].
В качестве потенциального нейропротектора мы исследовали эффекты пробенецида, вещества с широким спектром действия. Пробенецид свободно проникает через ГЭБ благодаря высокой растворимости в липидах. Он способен взаимодействовать с мембранными белкамиканалами TRPV2 и переносчиками органических анионов (ОАТ1-3) и катионов (ОСТ1-3), а также полуканалами, образованными Panx1, что указывает на его потенциальное терапевтическое использование, например, в качестве адъюванта для увеличения биодоступности некоторых лекарств в ЦНС. Перспективным и интересным видится применение пробенецида в качестве блокатора полуканалов Panx1 для подавления нейровоспаления, являющегося нейродегенеративным компонентом многих заболеваний ЦНС [6]. Учитывая множественность активирующих Panx1 стимулов и полифункциональность его эффектов, важно учитывать двойственность эффектов пробенецида: с одной стороны, он может запускать противоспалительные эффекты, сдерживая активацию инфламмасом, с другой стороны, снижение глиальнонейронального взаимодействия и пластичности повышает риск дополнительного повреждения ткани. В пользу противовоспалительного и нейропротекторного действия пробенецида указывает снижение на фоне его воздействия уровня экспрессии AQP4, NLRP3 и каспазы-1 в культуре астроцитов при кислородно-глюкозной депривации [34]. Пробенецид повышал выживаемость астроцитов через снижение продукции АФК и подавление экспрессии NLRP3, каспазы-1 и IL1β [6].
Таким образом, применение пробенецида, ингибитора Panx1, в качестве противоспалительного агента (рис. 6), может представлять интерес при разработке новых направлений эффективного контроля нейровоспаления, одного из важных факторов, потенцирующих повреждение мозга при травмах и нейродегенеративных заболеваниях [35, 36].
ВЫВОДЫ
Провоспалительная активация астроцитов мышей аппликацией тромбина (50 и 100 нМ) и липополисахарида (0,1 и 1 мкг/мл) приводила к изменению их функционального профиля, сопровождающегося изменением пролиферации и секреторной активности клеток. При этом на фоне ЛПС наблюдается наиболее выраженное повышение секреции IL6, в отличие от тромбина, который оказывал более выраженное действие на секрецию NO и пролиферацию астроцитов. Продемонстрировано, что индуцируемую этими факторами секрецию NO, БГА и IL6 отменял пробенецид, блокатор каналов Panx1. Интересно, что пробенецид отменял влияние тромбина на пролиферацию астроцитов, но не на эффект ЛПС. Выраженность ингибирования секреции IL6 и БГА пробенецидом так же различалась на фоне ЛПС и тромбина. Полученные результаты свидетельствуют о возможном участии каналов, образованных Panx1, в тромбин- и липополисахаридвызванной провоспалительной активации астроцитов и индукции астроглиоза. Однако поиск механизмов и ключевых участников сигнального каскада, запускаемого в условиях тромбин- и ЛПС-вызванного нейровоспаления на фоне предобработки клеточных культур пробенецидом требует дальнейшего исследования.



- Choi SH, Da YL, Seung UK, Byung KJ. Thrombin-induced oxidative stress contributes to the death of hippocampal neurons in vivo: Role of microglial NADPH oxidase. Journal of Neuroscience. 2005; 25: 4082–90.
- D’hondt C, Ponsaerts R, De Smedt H, Vinken M, De Vuyst E, De Bock M, et al. Pannexin channels in ATP release and beyond: An unexpected rendezvous at the endoplasmic reticulum. Cellular Signalling. 2011; 23: 305–16.
- Koval M, Cwiek A, Carr T, Good ME, Lohman AW, Isakson BE. Pannexin 1 as a driver of inflammation and ischemia–reperfusion injury. Purinergic Signalling. 2021; 17: 521–31.
- Galkov MD, Surin AM, Lisina OYu, Gorbacheva LR. Neurodegeneration and Neuroinflammation: The Role of Pannexin 1. Neurochemical Journal. 2023; 17: 727–39.
- Rusiecka OM, Tournier M, Molica F, Kwak BR. Pannexin1 channels — a potential therapeutic target in inflammation. Front Cell Dev Biol. 2022; 10: 1020826.
- García-Rodríguez C, Mujica P, Illanes-González J, López A, Vargas C, Sáez JC, et al. Probenecid, an Old Drug with Potential New Uses for Central Nervous System Disorders and Neuroinflammation. Biomedicines. 2023; 11.
- Иванова А. Е., Горбачева Л. Р., Струкова С. М., Пинелиc В. Г., Райзер Г. Участие активированного протеина С и тромбина в регуляции функций астроцитов. Биол мембраны. 2013; 30: 387–97.
- Schwartz LB, Austen KF, Wasserman SI. Immunologic Release of β-Hexosaminidase and β-Glucuronidase from Purified Rat Serosal Mast Cells. The Journal of Immunology. 1979; 123: 1445–50.
- Penuela S, Gehi R, Laird DW. The biochemistry and function of pannexin channels. Biochimica et Biophysica Acta — Biomembranes. 2013; 1828: 15–22.
- Bhaskaracharya A, Dao-Ung P, Jalilian I, Spildrejorde M, Skarratt KK, Fuller SJ, et al. Probenecid Blocks Human P2X7 ReceptorInduced Dye Uptake via a Pannexin-1 Independent Mechanism. PLoS ONE. 2014; 9: e93058.
- Locovei S, Wang J, Dahl G. Activation of pannexin 1 channels by ATP through P2Y receptors and by cytoplasmic calcium. FEBS Letters. 2006; 580: 239–44.
- Yang K, Xiao Z, He X, Weng R, Zhao X, Sun T. Mechanisms of Pannexin 1 (PANX1) Channel Mechanosensitivity and Its Pathological Roles. International Journal of Molecular Sciences. 2022; 23.
- Szydlowska K, Tymianski M. Calcium, ischemia and excitotoxicity. Cell Calcium. 2010; 47: 122–9.
- Orellana JA, Froger N, Ezan P, Jiang JX, Bennett MVL, Naus CC, et al. ATP and glutamate released via astroglial connexin 43 hemichannels mediate neuronal death through activation of pannexin 1 hemichannels. Journal of Neurochemistry. 2011; 118: 826–40.
- Gödecke S, Roderigo C, Rose CR, Rauch BH, Gödecke A, Schrader J. Thrombin-induced ATP release from human umbilical vein endothelial cells. Am J Physiol Cell Physiol. 2012; 302: 915–23.
- Chen X, Zhang H, Hao H, Zhang X, Song H, He B, et al. Thrombin induces morphological and inflammatory astrocytic responses via activation of PAR1 receptor. Cell Death Discovery. 2022; 8.
- Seminario-Vidal L, Kreda S, Jones L, O’Neal W, Trejo JA, Boucher RC, et al. Thrombin promotes release of ATP from lung epithelial cells through coordinated activation of Rho- and Ca2+ -dependent signaling pathways. Journal of Biological Chemistry. 2009; 284: 20638–48.
- Fiebich BL, Batista CRA, Saliba SW, Yousif NM, de Oliveira ACP. Role of microglia TLRs in neurodegeneration. Frontiers in Cellular Neuroscience. 2018; 12.
- Zhang Z, Lei Y, Yan C, Mei X, Jiang T, Ma Z, et al. Probenecid Relieves Cerebral Dysfunction of Sepsis by Inhibiting Pannexin 1-Dependent ATP Release. Inflammation. 2019; 42: 1082–92.
- Yu D-K, Lee B, Kwon M, Yoon N, Shin T, Kim N-G, et al. Phlorofucofuroeckol B suppresses inflammatory responses by down-regulating nuclear factor κB activation via Akt, ERK, and JNK in LPS-stimulated microglial cells. International Immunopharmacology. 2015; 28: 1068–75.
- Kozuka N, Itofusa R, Kudo Y, Morita M. Lipopolysaccharide and proinflammatory cytokines require different astrocyte states to induce nitric oxide production. J of Neuroscience Research. 2005; 82: 717–28.
- Chen Q, Liang Z, Yue Q, Wang X, Siu SWI, Pui-Man Hoi M, et al. A Neuropeptide Y/F-like Polypeptide Derived from the Transcriptome of Turbinaria peltata Suppresses LPS-Induced Astrocytic Inflammation. J Nat Prod. 2022; 85: 1569–80.
- Liu B, Gao H-M, Wang J-Y, Jeohn G-H, Cooper CL, Hong J-S. Role of nitric oxide in inflammation-mediated neurodegeneration. Ann N Y Acad Sci. 2002; 962: 318–31.
- Li T, Xu T, Zhao J, Gao H, Xie W. Depletion of iNOS-positive inflammatory cells decelerates neuronal degeneration and alleviates cerebral ischemic damage by suppressing the inflammatory response. Free Radic Biol Med. 2022; 181: 209–20.
- Boven LA, Vergnolle N, Henry SD, Silva C, Imai Y, Holden J, et al. Up-Regulation of Proteinase-Activated Receptor 1 Expression in Astrocytes During HIV Encephalitis. The Journal of Immunology. 2003; 170: 2638–46.
- Isakson BE, Thompson RJ. Pannexin-1 as a potentiator of ligandgated receptor signaling. Channels. 2014; 8: 118–23.
- Huang G, Bao J, Shao X, Zhou W, Wu B, Ni Z, et al. Inhibiting pannexin-1 alleviates sepsis-induced acute kidney injury via decreasing NLRP3 inflammasome activation and cell apoptosis. Life Sciences. 2020; 254.
- Wareham KJ, Seward EP. P2X7 receptors induce degranulation in human mast cells. Purinergic Signalling. 2016; 12: 235–46.
- Ponath G, Park C, Pitt D. The role of astrocytes in multiple sclerosis. Frontiers in Immunology. 2018; 9.
- Okada S, Nakamura M, Mikami Y, Shimazaki T, Mihara M, Ohsugi Y, et al. Blockade of interleukin-6 receptor suppresses reactive astrogliosis and ameliorates functional recovery in experimental spinal cord injury. Journal of Neuroscience Research. 2004; 76 (2): 265–76.
- Krasovska V, Doering LC. Regulation of IL6 secretion by astrocytes via TLR4 in the fragile X mouse model. Frontiers in Molecular Neuroscience. 2018; 11: 272.
- Wei L, Sheng H, Chen L, Hao B, Shi X, Chen Y. Effect of pannexin-1 on the release of glutamate and cytokines in astrocytes. Journal of Clinical Neuroscience. 2016; 23: 135–41.
- Shieh CH, Heinrich A, Serchov T, van Calker D, Biber K. P2X7dependent, but differentially regulated release of IL6, CCL2, and TNF-α in cultured mouse microglia. GLIA. 2014; 62: 592–607.
- Jian Z, Ding S, Deng H, Wang J, Yi W, Wang L, et al. Probenecid protects against oxygen–glucose deprivation injury in primary astrocytes by regulating inflammasome activity. Brain Research. 2016; 1643: 123–9.
- Hainz N, Wolf S, Tschernig T, Meier C. Probenecid Application Prevents Clinical Symptoms and Inflammation in Experimental Autoimmune Encephalomyelitis. Inflammation. 2016; 39: 123–8.
- Wang Q, Li H, Ling Z, Chen G, Wei Z-Y. Inhibition of Schwann cell pannexin 1 attenuates neuropathic pain through the suppression of inflammatory responses. J Neuroinflammation. 2022; 19: 244.