ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Лечение гонартроза с применением аутологической обогащенной тромбоцитами плазмы
Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва, Россия
Инъекции плазмы с тромбоцитами рассматривают как перспективный метод лечения. Препараты, воздействующие на субхондральную кость, могут способствовать улучшению структуры ткани и замедлению разрушения суставного хряща. Целью работы было изучить результаты лечения пациентов с гонартрозом путем внутрисуставного и внутрикостного введения обогащенной тромбоцитами плазмы (ОТП). В исследование включены 187 пациентов с 1–3-й стадией, разделенные на три группы. В группе 1 (основная) осуществляли внутрисуставное введение ОТП, в группе 2 (сравнения) — внутрикостные инъекции ОТП. Для оценки использовали визуально-аналоговую шкалу и опросник «SF-36». В группе 1 и 2 было зарегистрировано снижение показателя стартовой боли уже через 3 месяца после проведенного лечения. Снижение частоты синовитов отмечено у пациентов группы 1 через 3 месяца; в группе 2 — через 6 месяцев (21,9 и 31,3% соответственно; р < 0,05). Частота регистрации отечности мягких тканей области сустава снижалась через 6 месяцев у пациентов группы 1 и группы 2 (8,2 и 8,3% соответственно). У пациентов группы 1 была выявлена положительная динамика через 3 месяца (70,40%), группы 2 — через 6 месяцев (69,80%) по физическому компоненту качества жизни; у пациентов группы 1 и группы 2 через 3 месяца (64,30 и 65,10% соответственно), через 6 месяцев (65,10 и 66,40% соответственно) — по психическому компоненту. Таким образом, использование ОТП при гонартрозе свидетельствует о снижении боли, улучшении параметров жизни. Внутрикостные инъекции ОТП значительно улучшают клинические симптомы и физическое качество жизни пациентов.
Ключевые слова: качество жизни, боль, внутрикостное введение, внутрисуставное введение
Вклад авторов: К. А. Егиазарян, М. А. Данилов — разработка дизайна исследования, анализ результатов; М. А. Данилов, Р. М. Абдусаламов — сбор данных, обзор литературы, проведение процедур введения, оценка результатов.
Соблюдение этических стандартов: исследование одобрено этическим комитетом ФГАОУ ВО РНИМУ им. Н. И. Пирогова (протокол № 213 от 13 декабря 2021 г.).
Для корреспонденции: Максим Александрович Данилов
ул. Островитянова, д. 1, г. Москва, 117997, Россия; moc.liamg@volinad.dm
Остеоартроз (ОА) коленного сустава (гонартроз) — дегенеративное заболевание суставов, которое со временем прогрессирует вследствие потери суставного хряща [1].
Порядка 13% женщин и 10% мужчин в возрасте 60 лет и старше страдают симптоматическим ОА коленного сустава. Среди людей старше 70 лет распространенность патологии возрастает до 40%. Без учета возрастной характеристики частота симптоматического гонартроза составляет примерно 240 случаев на 100 000 человек в год [2].
Гонартроз имеет прогрессирующее течение, обусловленное особенностями патогенеза, которое, как правило, приводит к развитию инвалидности.
Причины поражения хряща при остеоартрозе не полностью понятны, но могут включать конституциональные и генетические факторы, травму, болезнь перегрузки и др. В последнее время значительно возрос интерес к патологическим изменениям субхондральной кости — ишемии и локальному некрозу — как патогенетическим факторам болезни [3]. Важное значение уделяется наличию травм коленного сустава в анамнезе [4].
Ограничение физической активности, боли и дискомфорт при движении оказывают значительное негативное влияние на повседневную деятельность пациента и социальную активность, что приводит к снижению его качества жизни (КЖ) [5].
В связи с этим большое внимание уделяют методам лечения ОА коленного сустава. Применение методов консервативного лечения с различной степенью эффективности направлено на устранение клинических проявлений (болевого синдрома) и частичное улучшение функционального состояния сустава [6]. Однако такие терапевтические стратегии не оказывают влияния на патогенез ОА и не приводят к улучшению КЖ пациентов.
В настоящее время из известных направлений современной ортопедии перспективны разработка и внедрение новых методик для лечения ОА, которые позволят не только купировать клинические симптомы, но и предотвратить прогрессирование патологического процесса. Одна из них — применение инъекций плазмы, обогащенной тромбоцитами (ОТП) [7, 8]. Ее эффекты, в основном, обусловлены продуктами секреции тромбоцитов. Помимо органелл, в цитоплазме тромбоцитов имеется большое количество гранул, содержащих более 300 различных биологически активных веществ. Выделяют три типа секреторных гранул тромбоцитов: плотные гранулы (или γ-гранулы), α-гранулы и лизосомы. Содержимое лизосом, в основном, представлено различными ферментами (кислыми гидролазами). Плотные гранулы тромбоцитов содержат катехоламины, серотонин, АДФ, АТФ и кальций, участвующие в активации каскада тромбообразования. Под действием факторов роста в область травмы мигрируют и размножаются там фибробласты, клетки эндотелия и эпителиальные клетки. В результате происходят образование внеклеточного матрикса, рост новых сосудов, созревание и ремоделирование соединительной ткани. Противовоспалительный эффект оказывают такие медиаторы α-гранул тромбоцитов, как HGF, TNFα, TGFβ1, VEGF и EGF. Модуляция воспаления в сторону его уменьшения оказывает также и обезболивающий эффект [9–12].
Цель работы — изучить результаты лечения пациентов с ОА коленных суставов путем внутрисуставного и внутрикостного введения ОТП.
ПАЦИЕНТЫ И МЕТОДЫ
На базе ГКБ № 1 имени Н. И. Пирогова г. Москва, Республиканской клинической больницы г. Махачкала (Республика Дагестан) в период с 2018 по 2022 г. было проведено обследование и лечение 187 пациентов (в возрасте 40–70 лет) с 1–3-й стадиями остеоартроза (ОА) коленных суставов с последующей оценкой динамики симптомов и признаков заболевания.
Верификацию диагноза ОА коленного сустава проводили согласно нормативным документам [13–15].
Критерии включения пациентов в исследование: возраст пациента 40–70 лет; наличие подтвержденного данными рентгенографического исследования диагноза ОА коленного сустава; соответствие поражения сустава I–III стадии по шкале Kellgren; интенсивность болевого синдрома при ходьбе ≥ 40 мм по визуально-аналоговой шкале (ВАШ) на протяжении последних 2 недель; отказ от приема любых системных хондропротекторов и/или препаратов, стимулирующих регенерацию хряща, в течение 2 месяцев до начала исследования; отказ от приема нестероидных противовоспалительных препаратов (НПВП) в течение 2 недель до начала настоящей работы; добровольное согласие пациента к участию в исследовании и адекватному сотрудничеству в ходе его проведения.
Критерии исключения: возраст младше 40 лет и старше 70 лет; отказ от участия в исследовании и/или в подписании формы информированного согласия; уровень оценки боли при ходьбе <40 мм по ВАШ; рентгенологическое поражение коленного сустава соответствует IV стадии (по Келгрену); хирургическое лечение гонартроза в течение предшествующих 6 месяцев; наличие выраженной деформации коленного сустава; длительность обострения больше месяца; беременность и/или лактация; наличие серьезных или нестабильных соматических заболеваний (тяжелых заболеваний печени, сердечно-сосудистой системы, легких или почек, онкологических, психических заболеваний), декомпенсированного сахарного диабета; использование лекарственных средств для регенерации тканей, системных хондропротекторов в течение 2 месяцев до включения в исследование; прием НПВП в течение 2 недель до включения в исследование.
Пациенты в зависимости от метода лечения были распределены на три группы. Основную группу (группа 1) составили 73 пациента (21 мужчин и 52 женщины), средний возраст — 57,4 ± 2,87 года, в комплексе лечения которых были использованы внутрисуставные инъекции ОТП. В группу сравнения (группа 2) было включено 48 больных (15 мужчин и 33 женщины), средний возраст — 56,9 ± 2,85 года, лечение которым проводили с помощью внутрикостных инъекций ОТП. Группа контроля (группа 3) состояла из 66 человек (21 мужчина и 45 женщин), средний возраст — 57,1 ± 2,86 года, лечебные мероприятия у которых состояли из приема нестероидных противовоспалительных средств, курса хондропротекторов и курса внутрисуставного введения глюкортикоидов. У пациентов группы 1 внутрисуставные инъекции аутологичной ОТП выполняли одним курсом введения (три инъекции раз в неделю) раз в год; у пациентов группы 2 — внутрикостные инъекции ОТП, курсом введения (две инъекции раз в две недели) раз в год.
Среди пациентов всех групп наиболее часто регистрировали вторую стадию заболевания: у 37 (50,7%) пациентов группы 1, в 22 случаях (45,8%) — в группе 2 и у 27 (40,9%) пациентов — в группе контроля. Статистически значимых межгрупповых различий по частоте диагностики различных стадий ОА у обследованных пациентов выявлено не было.
Всем пациентам проводили комплексное обследование, которое включало сбор жалоб, изучение анамнеза жизни и заболевания, физикальное обследование с анализом объективных признаков патологии суставов, оценкой выраженности поражения.
В рамках комплексного первичного обследования также выполняли рентгенографическое исследование, ультразвуковое исследование (УЗИ), магнитно-резонансную томографию (МРТ).
Для оценки выраженности болевого синдрома использовали визуально-аналоговую шкалу (ВАШ); для оценки показателей качества жизни — неспецифический опросник SF-36 (до лечения, через три и шесть месяцев после терапии).
Для статистического анализа данных применяли пакеты программ Statsoft. STATISTICA 10 и Microsoft Excel 2016 (США).
При нормальном распределении показателей для проведения межгруппового сравнения применяли критерий Стьюдента, при непараметрическом распределении — критерий Манна–Уитни. Нормальность распределения оценивали с применением критерия Шапиро–Уилка. Пороговое значение для уровня статистической значимости нулевой гипотезы (α) было принято равным 0,05 для всех межгрупповых сравнений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
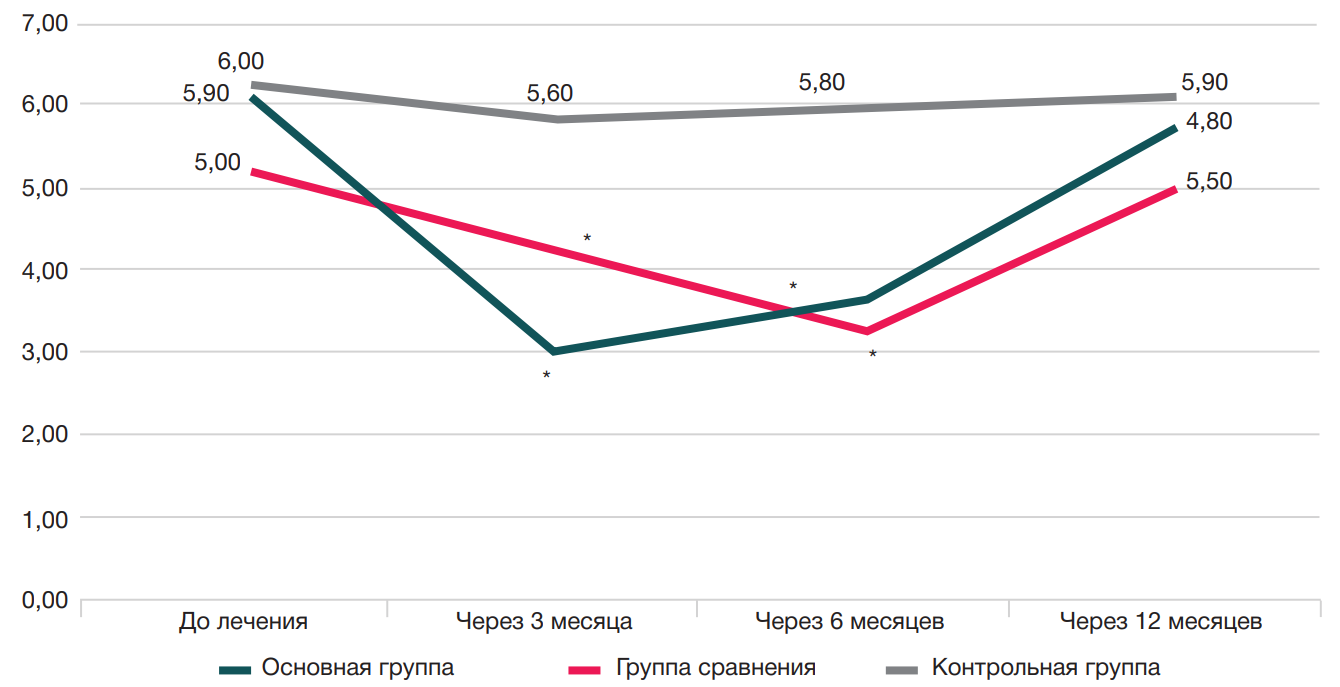
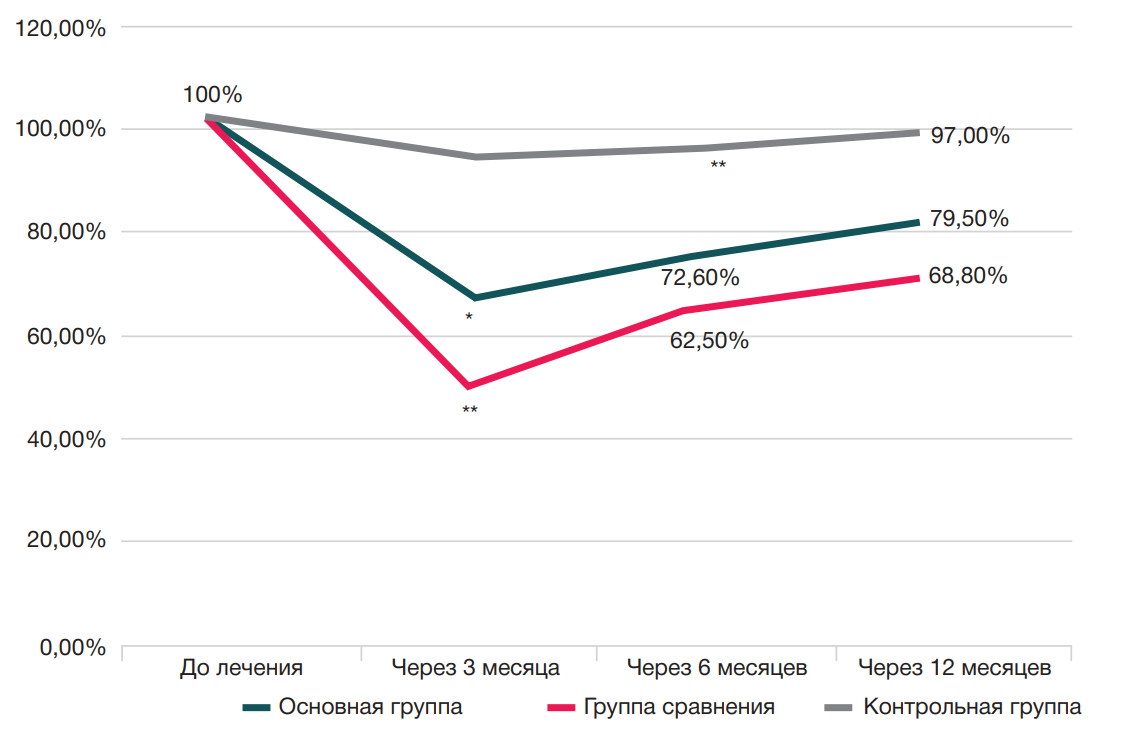
Динамика стартовой боли после отдыха более 30 мин у пациентов трех групп представлена на рис. 1.
Представленные данные свидетельствуют о том, что до начала лечения все пациенты (100%) испытывали стартовую боль после отдыха более 30 мин.
У пациентов основной группы и группы сравнения было зарегистрировано достоверное снижение показателя стартовой боли после отдыха более 30 мин уже через три месяца после проведенного лечения со 100% до 64,4 и 47,90% соответственно.
Через шесть и 12 месяцев наблюдалось нарастание интенсивности болевых ощущений у пациентов основной группы до 72,60 и 79,50% соответственно; у пациентов группы сравнения — до 62,50 и 68,80% соответственно.
У пациентов контрольной группы динамика стартовой боли была статистически не значимой и составляла 92,40% через три месяца; 93,90% — через шесть месяцев; 97,0% — через 12 месяцев.
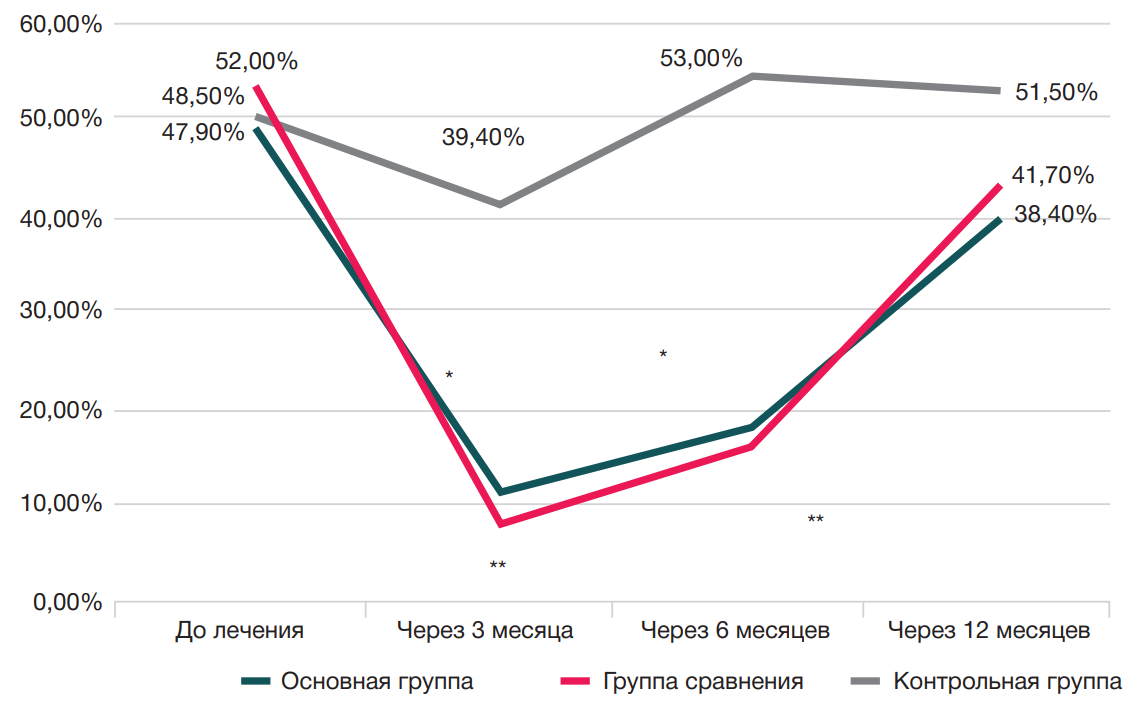
Динамика показателей ощущения утренней скованности в суставах у пациентов исследуемых групп представлена на рис. 2.
Продемонстрирована достоверная динамика уменьшения жалоб на утреннюю скованность в суставах у пациентов основной группы и группы сравнения по отношению к группе контроля.
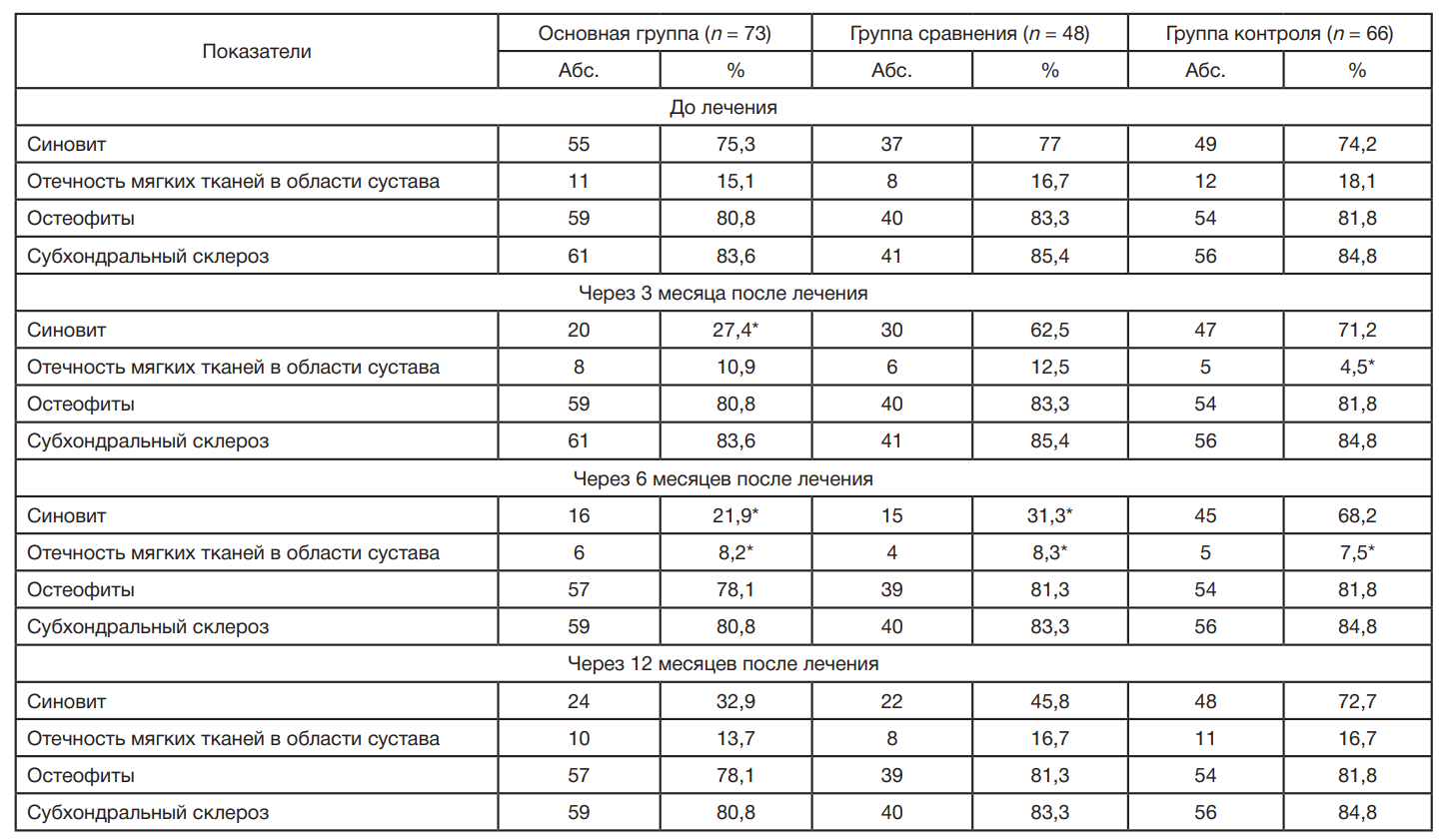
Характеристика параметров ОА коленного сустава по данным УЗИ приведена в таблица.
Следует отметить, что до лечения частота регистрации синовитов, отечности мягких тканей, остеофитов и субхондрального склероза была сопоставимой между группами. Достоверные различия по частоте регистрации синовита от исходного уровня были отмечены у пациентов основной группы через три месяца (27,4%); у пациентов основной группы и группы сравнения — через шесть месяцев (21,9 и 31,3% соответственно); по частоте регистрации отечности мягких тканей области сустава — через шесть месяцев у пациентов основной группы и группы сравнения (8,2 и 8,3% соответственно). Через 12 месяцев результаты между группами были статистически не значимы, однако наименьшие значения изучаемых параметров по данным УЗИ регистрировались у пациентов основной группы.
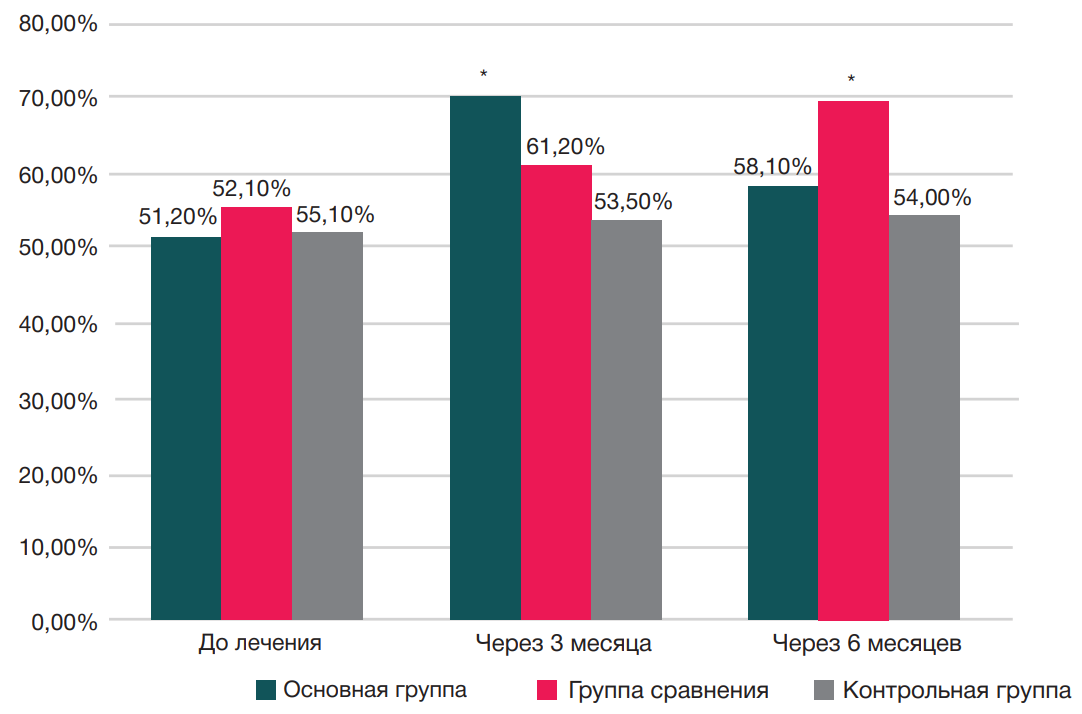
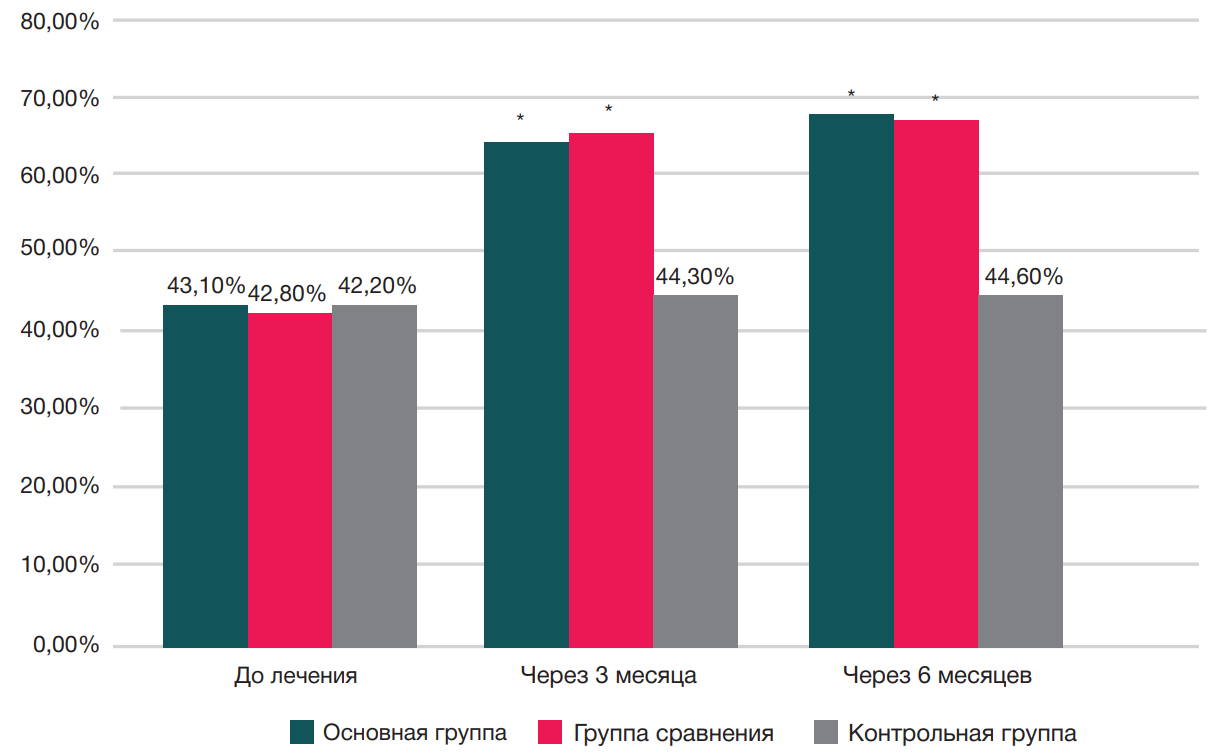
Результаты сравнительного анализа КЖ по физическому и психическому компонентам опросника SF-36 у пациентов исследуемых групп до лечения, через три месяца и шесть месяцев наблюдения представлены на рис. 3 и рис. 4.
На фоне терапии у пациентов основной группы и группы сравнения наблюдалась достоверная положительная динамика: у пациентов основной группы через три месяца (70,40%), группы сравнения — через шесть месяцев (69,80%).
Через шесть месяцев терапии у пациентов основной группы и группы сравнения результаты были выше исходных значений с лучшими параметрами у пациентов группы сравнения. У пациентов контрольной группы значения показателей параметров физического компонента качества жизни SF-36 статистически значимо не менялись на протяжении лечения (51,20% — до лечения; 53,50% — через три месяца; 54,0% — через шесть месяцев).
На фоне лечения отмечается статистически значимая положительная динамика по психическому компоненту опросника SF-36 у пациентов основной группы и группы сравнения через три месяца (64,30 и 65,10% соответственно), через шесть месяцев (65,10% и 66,40% соответственно). У пациентов контрольной группы динамики выявлено не было (42,20% — до лечения, 44,30% — через три месяца, через шесть месяцев — 44,60%).
Характеристика интенсивности боли по опроснику ВАШ представлена на рис. 5.
Статистически значимая (р < 0,05) положительная динамика на фоне лечения отмечена у пациентов основной группы и группы сравнения через три и шесть месяцев терапии, при этом через три месяца лучшие показатели зафиксированы у пациентов основной группы (2,80 ± 0,14 и 3,90 ± 0,19 соответственно); через шесть месяцев — у пациентов группы сравнения (3,40 ± 0,17 и 3,0 ± 0,15 соответственно). У пациентов контрольной группы назначенная терапия не привела к купированию интенсивности болевого синдрома и показатели значений не различались на протяжении всего периода наблюдения (до лечения — 6,0 ± 0,3; через три месяца — 5,60 ± 0,28; через шесть месяцев — 5,80 ± 0,29; через 12 месяцев — 5,90 ± 0,30).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ОА коленного сустава — патология, рост которой обусловлен увеличением продолжительности жизни населения. Это значимая социальная, экономическая и медицинская проблема, в решении которой должны быть использованы нефармакологические, фармакологические и хирургические методы лечения на разных стадиях ОА коленного сустава. Хирургическое вмешательство в виде частичной или полной замены коленного сустава чаще всего используют на поздних стадиях ОА коленного сустава [16–17]. Лечение, основанное на регенеративной медицине, такое как ОТП и клеточная терапия, направлено на расширение терапевтического арсенала для избежания или отсрочки хирургического вмешательства. В то время как клеточная терапия все еще находится в зачаточном состоянии и ей предстоит преодолеть ряд проблем, ОТП применяют уже более 15 лет, и она занимает консолидированную позицию в лечении этого заболевания. Проводится все большее количество рандомизированных клинических исследований для получения убедительных выводов об эффективности и безопасности ОТП. Несмотря на то что внутрисуставное введение ОТП для лечения ОА коленного сустава показывает многообещающие результаты, данный метод по мнению ряда авторов воздействует только на суставной хрящ и синовиальную оболочку, не достигая субхондральной кости. Добавление внутрикостных инъекций в субхондральную кость может обеспечить более комплексное лечение [18, 19]. Клинические исследования внутрикостного применения ОТП при ОА суставов по данным работ отечественных и зарубежных авторов в настоящее время находятся на ранних стадиях. Обоснование его применения во многом зависит от расширяющихся знаний о роли костно-хрящевой функциональной единицы в развитии ОА коленных суставов, а также от роста количества доклинических исследований и внутрикостных методов лечения других костных патологий [20, 21]. В этой области необходимы дальнейшие исследования, чтобы лучше понять клеточные процессы, лежащие в основе его потенциального механизма действия, и будущие направления внутрикостных инъекций.
ВЫВОДЫ
Использование обогащенной тромбоцитами плазмы при лечении ОА сопровождается достоверно лучшими результатами в отношении выраженности болевого синдрома, проявлений по данным методам исследования, в отношении параметров качества жизни по сравнению со стандартной терапией (использование нестероидных противовоспалительных средств, хондропротекторов, внутрисуставного введения глюкокортикоидов). Внутрикостное введение ОТП позволяет добиться достоверно лучших результатов при оценке редукции клинической симптоматики и КЖ пациентов по физическому компоненту.
- Hsu H, Siwiec RM. Knee Osteoarthritis. [Updated 2023 Jun 26]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing. 2023. Available from: https://www.ncbi.nlm.nih.gov/books/NBK507884/.
- Magnusson K, Turkiewicz A, Englund M. Nature vs nurture in knee osteoarthritis — the importance of age, sex and body mass index. Osteoarthritis Cartilage. 2019; 27 (4): 586–92.
- Егиазарян К. А., Лазишвили Г.Д. и др. Алгоритм хирургического лечения больных с рассекающим остеохондритом коленного сустава. Вестник Российского государственного медицинского университета. 2018; 2: 77–83.
- Егиазарян К. А., Черкасов С. Н., Аттаева Л. Ж. Анализ структуры первичной заболеваемости по классу травмы, отравления и некоторые другие последствия воздействия внешних причин взрослого населения Российской Федерации. Кафедра травматологии и ортопедии. 2017; 1: 25–27.
- Li JS, Tsai TY, Clancy MM, Li G, Lewis CL, Felson DT. Weight loss changed gait kinematics in individuals with obesity and knee pain. Gait Posture. 2019; 68: 461–5.
- Васильева Л. В., Лахин Д. И. Влияние метаболического синдрома на клиническую картину остеоартроза. Медицинский Вестник Северного Кавказа. 2017; 12 (1): 8–11.
- Гусева А. И., Тагильцева Ю. С. Применение обогащенной тромбоцитами плазмы в лечении заболеваний опорнодвигательного аппарата. Аллея науки. 2018; 6 (5): 148–51.
- Cui Y, Lin L, Wang Z, Wang K, Xiao L, Lin W, et al. Research trends of platelet-rich plasma therapy on knee osteoarthritis from 2011 to 2021: A review. Medicine (Baltimore). 2023; 102 (2): e32434.
- Wang L, et al. Comparison of the effects of autologous and allogeneic purified platelet-rich plasma on cartilage damage in a rabbit model of knee osteoarthritis. Front Surg. 2022; 9: 911468.
- Wang Y, et al. Clinical efficacy of platelet-rich plasma as adjuvant therapy in patients undergoing arthroscopic repair of meniscal injury. J Int Med Res. 2020; 48 (9): 300060520955059.
- Sheean AJ, Anz AW, Bradley JP. Platelet-rich plasma: fundamentals and clinical applications. Arthroscopy. 2021; 37 (9): 2732–4.
- dos Santos RG; et al. The regenerative mechanisms of plateletrich plasma: A review. Cytokine. 2021; 144: 155560.
- Об утверждении стандарта первичной медико-санитарной помощи при гонартрозе и сходных с ним клинических состояниях. Приказ Министерства здравоохранения РФ от 24 декабря 2012 г. № 1498н. М., 2012.
- Насонов Е. Л., редактор. Российские клинические рекомендации. Ревматология под ред. М.: ГЭОТАР-Медиа, 2017; 464 с.
- Bruyère O, et al. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis — from evidence-based medicine to the real-life setting. Seminars in arthritis and rheumatism. WB Saunders. 2016; 45 (4): S3-S11.
- Moretti L, Maccagnano G, Coviello M, Cassano GD, Franchini A, Laneve A, et al. Platelet rich plasma injections for knee osteoarthritis treatment: A prospective clinical study. J Clin Med. 2022; 11 (9): 2640.
- Cui Yubo, Lin Liqiong, Wang Zhiwei, Wang Kai, Xiao Lili, Lin Wentao, et al. Research trends of platelet-rich plasma therapy on knee osteoarthritis from 2011 to 2021: A review. Medicine. 2023; 102 (2): e32434.
- Patel S, Rajnish RK, Baburaj V, Kumar P, Sharma S, Kumar V. Intraosseous infiltration of platelet-rich plasma for knee osteoarthritis: A systematic review of literature and limited meta-analysis. Indian J Orthop. 2022; 56 (11): 1847–57. DOI: 10.1007/s43465-022-00737-x. PMID: 36310547; PMCID: PMC9561501.
- Sánchez M, Jorquera C, de Dicastillo LL, et al. Real-world evidence to assess the effectiveness of platelet-rich plasma in the treatment of knee degenerative pathology: a prospective observational study. Therapeutic Advances in Musculoskeletal Disease. 2022; 14. DOI: 10.1177/1759720X221100304.
- Torres-Torrillas M, Damia E, Romero Ad, Pelaez P, MiguelPastor L, Chicharro D, et al. Intra-osseous plasma rich in growth factors enhances cartilage and subchondral bone regeneration in rabbits with acute full thickness chondral defects: Histological assessment. Front Vet Sci. 2023; 10: 1131666. DOI: 10.3389/fvets.2023.1131666.
- Torres-Torrillas M, Damiá E, Peláez P, Miguel-Pastor L, Cuervo B, Cerón JJ, et al. Intra-osseous infiltration of adipose mesenchymal stromal cells and plasma rich in growth factors to treat acute full depth cartilage defects in a rabbit model: serum osteoarthritis biomarkers and macroscopical assessment. Front Vet Sci. 2022; 9: 1057079. DOI: 10.3389/fvets.2022.1057079.