ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Сравнительный анализ способов расчета торической интраокулярной линзы у пациентов после сквозной кератопластики
1 Чебоксарский филиал Федерального государственного автономного учреждения «Национальный медицинский исследовательский центр «Межотраслевой научно-технический комплекс «Микрохирургия глаза» имени С. Н. Фёдорова» Минздрава России, Чебоксары, Россия
2 Государственное автономное учреждение Чувашской Республики дополнительного профессионального образования «Институт усовершенствования врачей» Минздрава Чувашии, Чебоксары, Россия
Расчет торической интраокулярной линзы (тИОЛ) у пациентов после сквозной кератопластики (СКП) вызывает ряд сложностей. Целью исследования было провести сравнительный ретроспективный анализ различных способов расчета тИОЛ при факоэмульсификации катаракты (ФЭК) у пациентов после СКП. Был проведен анализ историй болезни 36 глаз (36 пациентов) после СКП, на которых была выполнена ФЭК с имплантацией тИОЛ. Все тИОЛ были пересчитаны четырьмя способами. В группе 1 расчет тИОЛ проводили с применением данных кератометрии передней поверхности роговичного трансплантата, измеренных при помощи кератотопографа, и задней поверхности роговичного трансплантата — при помощи оптической когерентной томографии роговицы или шаймпфлюг-кератотопографа). В группе 2 измерение кератометрии обеих поверхностей роговичного трансплантата выполняли при помощи шаймпфлюг-кератотопографа, в группе 3 — на ОКТ роговицы, в группе 4 — при помощи кератотопографа. Для расчета тИОЛ в группах 1–3 применяли онлайн-калькулятор Barrett True — K Toric Calculator, в группе 4 — The Kane Formula. Была отмечена статистически значимая разница по значениям сферического и цилиндрического компонентов рефракции между исследуемыми группами (p < 0,05). Наибольшая предсказуемость расчета тИОЛ обнаружена в группе 1: попадание в послеоперационную рефракцию по сферическому компоненту в пределах ±0,5 дптр — в 58% глаз и в пределах ±1,0 дптр — в 67% глаз, по цилиндрическому компоненту — в пределах –0,5 дптр — в 56% глаз и в пределах –1,0 дптр — в 89% глаз. Таким образом, наибольшая предсказуемость расчета тИОЛ была отмечена у пациентов группы 1.
Ключевые слова: сквозная кератопластика, посткератопластическая аметропия, торическая интраокулярная линза, способ расчета
Вклад авторов: М. В. Синицын — концепция и дизайн работы, сбор материала, анализ и обработка данных, статистическая обработка, написание текста; А. А. Воскресенская, Н. А. Поздеева — редактирование, утверждение версии, подлежащей публикации.
Для корреспонденции: Максим Владимирович Синицын
пр. Тракторостроителей, д. 10, 428028, г. Чебоксары, Россия; ur.liam@nicinisktnm
Выполнение сквозной кератопластики (СКП) приводит практически у каждого пациента к возникновению посткератопластического роговичного астигматизма (РА) [1–3]. При возникновении катаракты у пациентов после СКП и необходимости выполнения ее экстракции большое значение приобретает точность выбранного способа расчета интраокулярной линзы (ИОЛ) [4–6]. Наиболее высокие функциональные результаты отмечают у пациентов при регулярном РА и выполнении экстракции катаракты с имплантацией торической ИОЛ (тИОЛ) [7–9].
Однако обсуждаемым остается вопрос способа расчета тИОЛ. Не все авторы учитывают при расчете тИОЛ кривизну задней поверхности роговичного трансплантата, считая, что ее преломление, как и в здоровой роговице, близко к преломлению лучей света влагой передней камеры. Поэтому часто используют кератометрические значения только передней поверхности роговичного трансплантата [10, 11]. В настоящее время применяют различные онлайн-калькуляторы, а также калькуляторы фирм-производителей тИОЛ, которые учитывают кривизну обеих поверхностей роговичного трансплантата. Однако даже при применении кератометрических показателей обеих поверхностей роговичного трансплантата послеоперационные результаты значительно варьируют в связи с использованием различной диагностической аппаратуры [12, 13]. В связи с вышесказанным определение наиболее предсказуемого метода расчета тИОЛ при экстракции катаракты у пациентов после СКП обусловили актуальность и востребованность данного исследования.
Цель исследования — провести сравнительный ретроспективный анализ различных способов расчета тИОЛ при экстракции катаракты у пациентов после СКП.
ПАЦИЕНТЫ И МЕТОДЫ
Был проведен ретроспективный анализ историй болезни 36 глаз (36 пациентов) после СКП, которым была выполнена факоэмульсификация катаракты (ФЭК) с имплантацией тИОЛ. Всем пациентам имплантировали тИОЛ RayOne Toric RAO610T (Rayner, Великобритания). Возраст вошедших в клиническое исследование пациентов (12 мужчин и 24 женщины) составил 31–76 лет (средний возраст 57 ± 13 лет). В анамнезе СКП была выполнена по поводу наследственной дистрофии роговицы в шести глазах, пеллюцидной дегенерации роговицы — в восьми, центрального рубца роговицы — в шести, помутнения роговицы после язвы — в шести, кератоконуса IV стадии — в шести, вторичной кератэктазии — в четырех глазах. Срок между ФЭК и выполнением СКП у пациентов составил 4–15 лет. Все роговичные трансплантаты были прозрачными. Диаметр роговичного трансплантата достигал 7,5–8,5 мм (в среднем — 8,14 ± 0,36 мм).
При расчете тИОЛ измерение длины глаза, глубины передней камеры, толщины хрусталика, расстояние «от белого до белого» проводили с помощью оптической биометрии на приборе IOL Master 500 (Carl Zeiss AG, Германия). Значения кератометрических данных и оси расположения главных меридианов передней поверхности роговичного трансплантата определяли при помощи кератотопографа TMS-5 (Tomey, Япония), шаймпфлюг-кератотопографа Pentacam (Oculus Optikgerate GmbH, Германия), оптической когерентной томографии (ОКТ) роговицы на аппарате CASIA 2 (Tomey, Япония). Значения кератометрических данных и оси расположения главных меридианов задней поверхности роговичного трансплантата оценивали при помощи шаймпфлюг-кератотопографа Pentacam и оптического когерентного томографа (ОКТ) роговицы CASIA 2. У всех пациентов по данным кератотопограмм до ФЭК был диагностирован регулярный РА.
При расчете тИОЛ в калькуляторы вводили значения A-константы 118,6 тИОЛ RayOne Toric RAO610T, Lens Factor, индуцированного астигматизма, положения основного разреза, рефракции цели, толщины роговичного трансплантата в центре. Расчет ИОЛ проводили по онлайн-калькуляторам Barrett True-K Toric Calculator и The Kane Formula.
По данным историй болезни у части пациентов при расчете тИОЛ были получены расхождения в значениях оптической силы и торического компонента тИОЛ в связи с различными кератометрическими данными передней поверхности роговичного трансплантата, измеренными с помощью кератотопографа, ОКТ роговицы и шаймпфлюг-кератотопографа. В этих случаях брали либо среднее значение кератометрических показателей, измеренных с помощью вышеуказанной диагностической аппаратуры, либо среднее значение близких по результатам кератометрических показателей.
Из карт историй болезни были также взяты показатели сферического (Sph) и цилиндрического компонентов рефракции (Cyl) через три месяца и позже после ФЭК, когда была отмечена стабилизация данных параметров.
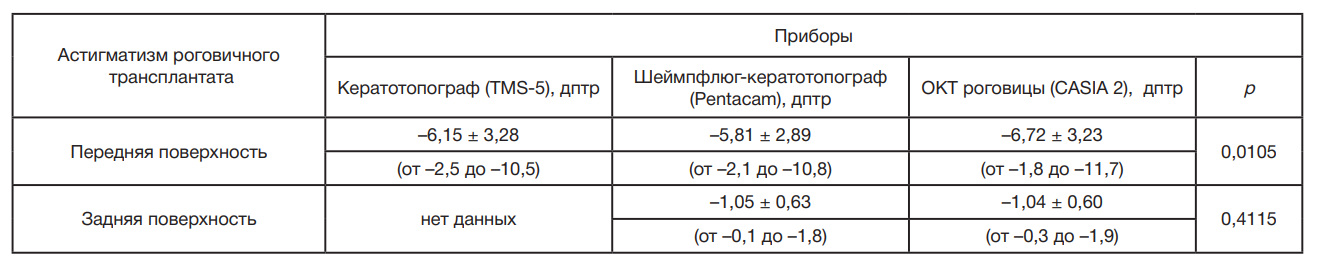
Для определения наиболее предсказуемого метода расчета тИОЛ мы разделили их на четыре группы в зависимости от используемых диагностических приборов для измерения кератометрических показателей (табл. 1).
В группе 1 при измерении кератометрических показателей передней поверхности роговичного трансплантата использовали кератотопограф (TMS-5), задней поверхности — шаймпфлюг-кератотопографа (Pentacam) или ОКТ роговицы (CASIA 2), учитывая сопоставимые данные кератометрии задней поверхности роговичного трансплантата, получаемые данными приборами. В группе 2 кератометрические данные обеих поверхностей роговичного трансплантата измеряли с помощью шаймпфлюг-кератотопографа (Pentacam), в группе 3 — с помощью ОКТ роговицы (CASIA 2). В группе 4 измеряли кривизну только передней поверхности роговичного трансплантата при помощи кератотопографа (TMS-5).
В группах 1–4 для расчета тИОЛ использовали онлайн-калькулятор Barrett True-K Toric Calculator, так как он позволяет учитывать данные кератометрии обеих поверхностей роговичного трансплантата. В группе 4 расчет тИОЛ проводили при помощи онлайн-калькулятора The Kane Formula, позволяющего анализировать только данные кератометрии передней поверхности роговичного трансплантата.
Расчет оптической силы тИОЛ во всех группах проводили на эмметропическую рефракцию цели, торического компонента — на полную коррекцию суммарного РА в группах 1–3 и на коррекцию РА передней поверхности роговичного трансплантата в группе 4.
На основании данных оптической силы и торического компонента имплантированных тИОЛ, а также послеоперационного рефракционного результата был проведен сравнительный анализ предсказуемости расчета тИОЛ, пересчитанных различными методами в группах 1–4.
Анализ статистических данных проводили в программе IBM SPSS Statistics 20. Для оценки нормальности распределений исследуемых показателей использовали критерий Шапиро–Уилка. В связи с нормальным распределением значений исследуемых показателей в каждой из групп сравнения для оценки статистически значимой разницы исследуемых показателей между двумя группами использовали параметрический t-критерий Стьюдента для независимых переменных, между тремя группами — однофакторный дисперсионный анализ. Различия исследуемых показателей между двумя группами считали статистически достоверными при р < 0,05, между тремя группами — при р < 0,017. Значения исследуемых параметров были представлены в виде M ± σ, где М — среднее арифметическое, σ ― стандартное отклонение.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
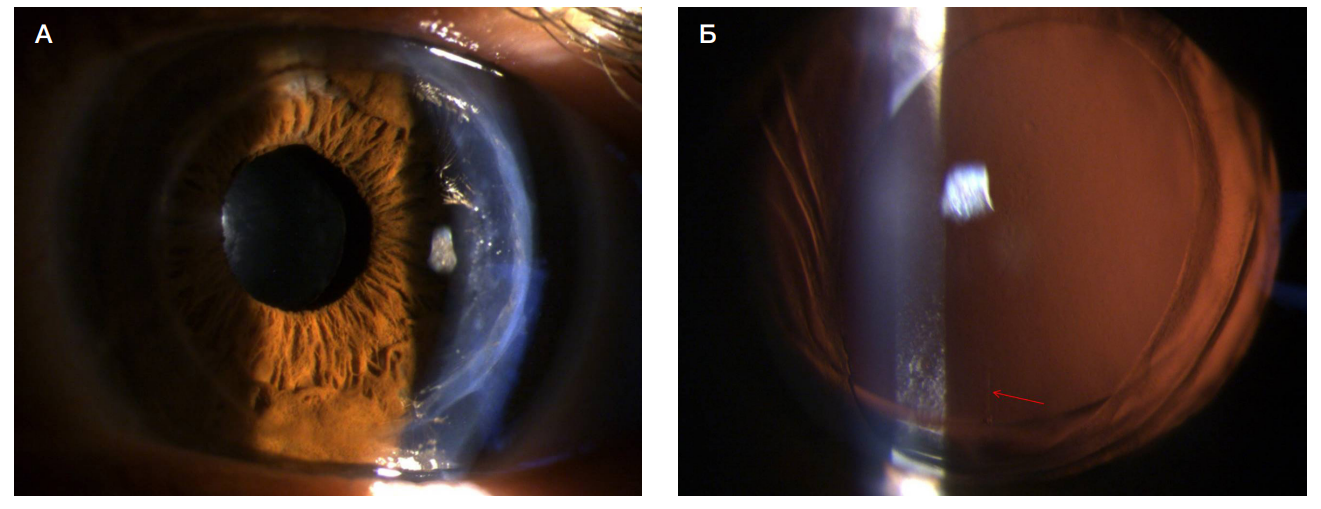
По данным историй болезни после выполненных ФЭК интра- и послеоперационных осложнений ни у одного из пациентов отмечено не было. При биомикроскопии у всех пациентов на следующий день после операции оптические среды были прозрачными, тИОЛ центрированы (рис. 1).
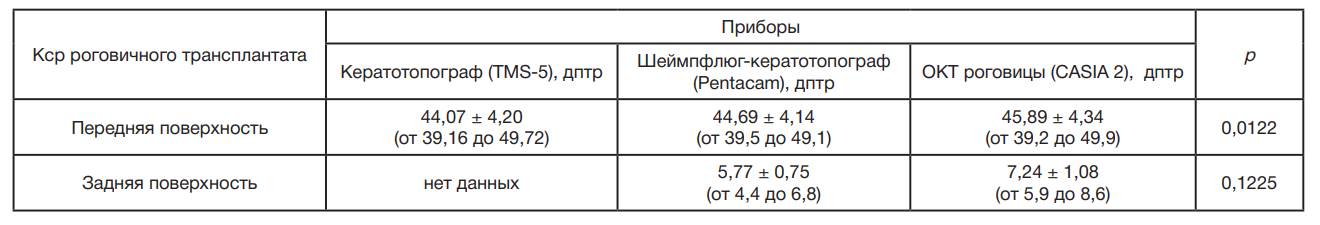
Дооперационные данные среднего значения РА, как и кератометрии (Кср) передней поверхности роговичного трансплантата, статистически различались по данным кератотопографа (TMS-5), шаймпфлюг-кератотопографа (Pentacam) и ОКТ роговицы (CASIA 2), а РА, как и Кср задней поверхности роговичного трансплантата, были сопоставимы по данным шаймпфлюг-кератотопографа и ОКТ роговицы (табл. 1, табл. 2).
Разница более 5° в расположении осей главных меридианов передней и задней поверхностей роговичного трансплантата по данным шаймпфлюг-кератотопографа была отмечена в 12 глазах (33,3%), по данным ОКТ роговицы — в 15 глазах (41,7%).
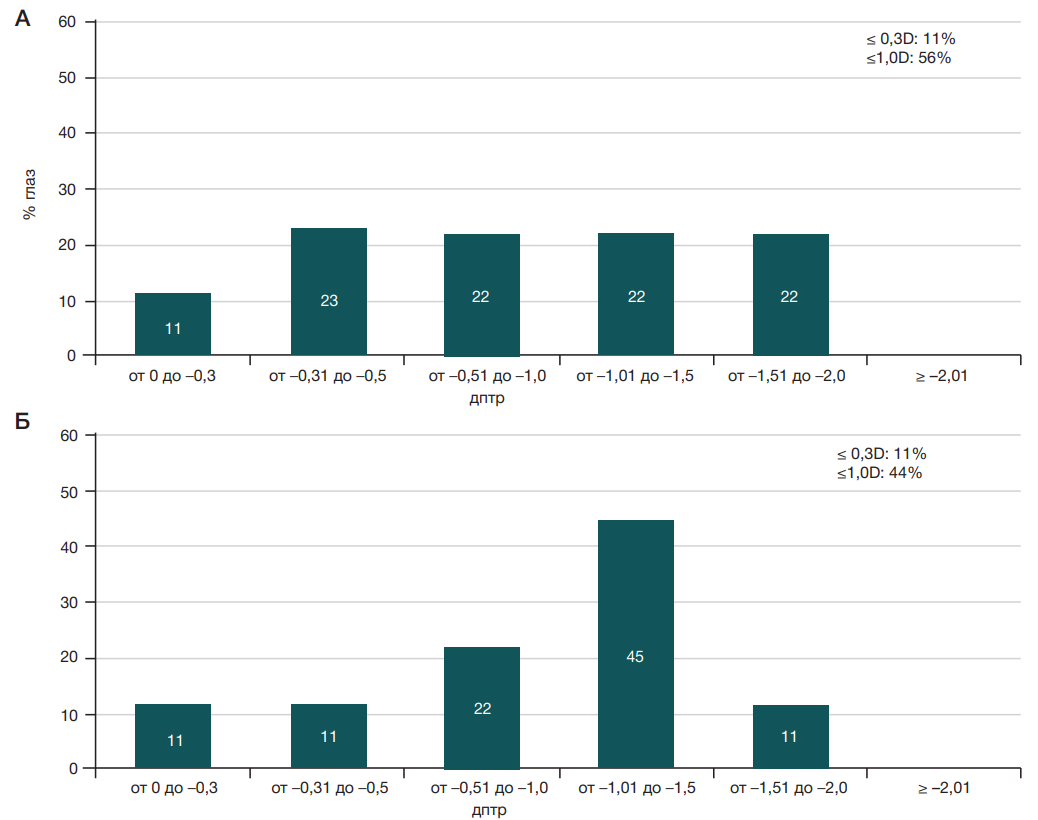
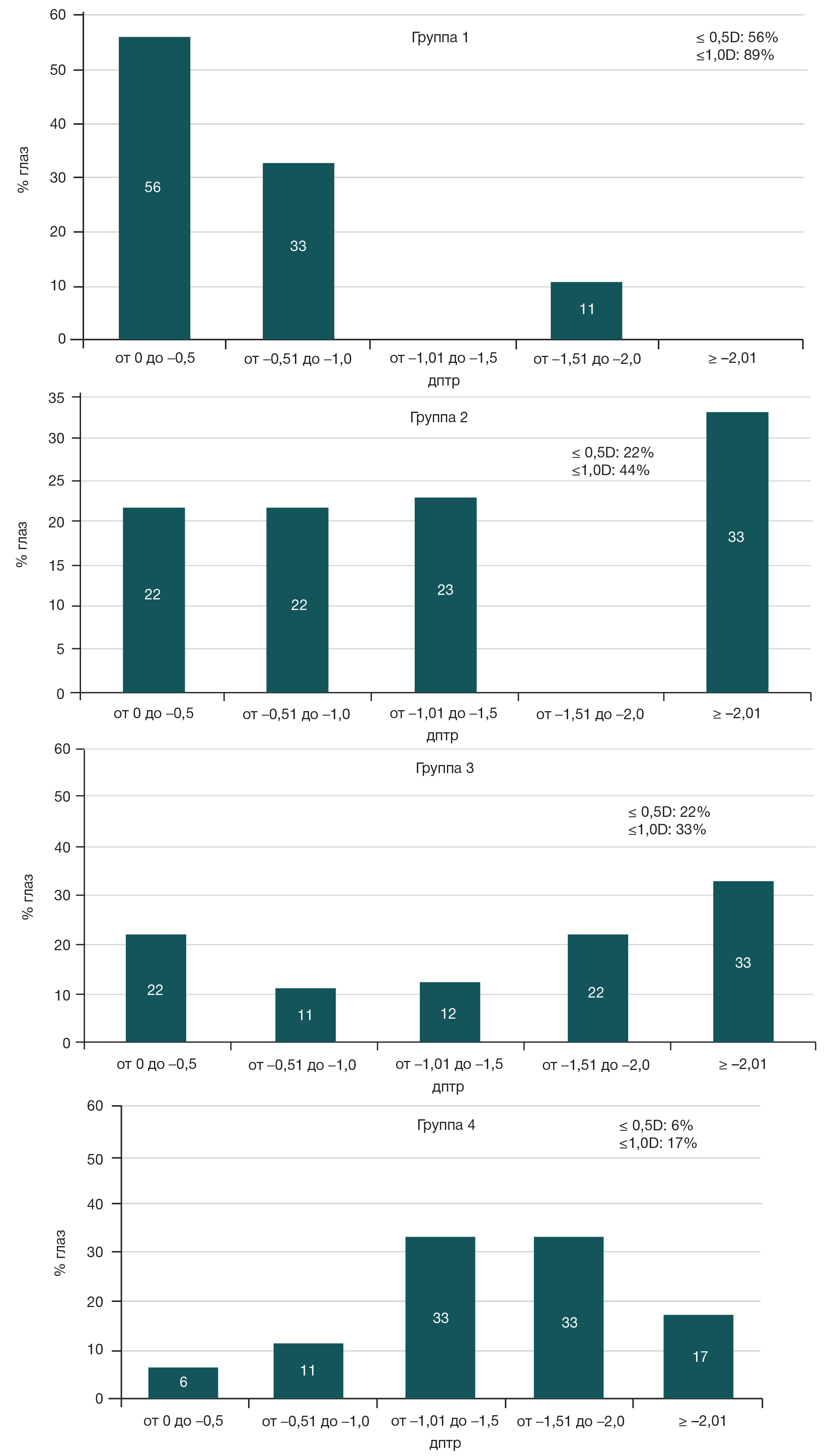
Результаты дооперационного анализа РА задней поверхности роговичного трансплантата по данным шаймпфлюг-кератотопографа и ОКТ роговицы представлены в виде диаграмм (рис. 2).
Частота встречаемости РА задней поверхности роговичного трансплантата по данным ОКТ роговицы в пределах ≤ –0,3 дптр составила 11% и в пределах ≤ –1,0 дптр — 56% (рис. 1). Частота встречаемости РА задней поверхности по данным шаймпфлюг-кератотопографа в пределах ≤ –0,3 дптр составила 11% и в пределах ≤ –1,0 дптр — 44%. Таким образом, средняя частота встречаемости РА задней поверхности в пределах ≤ –0,3 дптр по данным обоих приборов составила 11%.
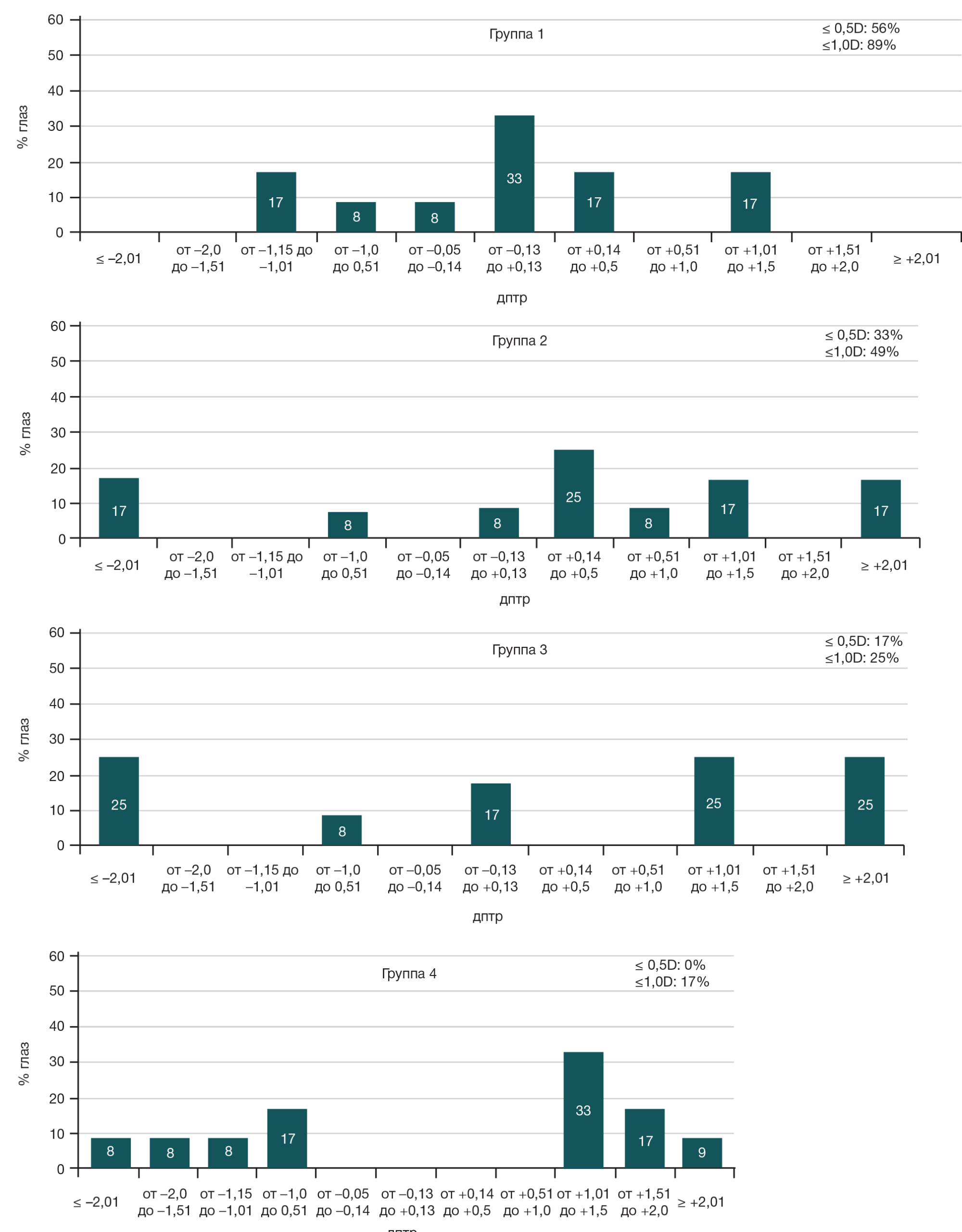
При расчете оптической силы тИОЛ отмечено попадание в запланированную рефракцию цели по Sph в группе 1 в пределах ±0,5 дптр в 58% глаз, ±1,0 дптр — в 66% глаз, в группе 2 в пределах ±0,5 дптр — в 33% глаз, ±1,0 дптр — в 49% глаз, в группе 3 в пределах ±0,5 дптр — в 17% глаз, ±1,0 дптр — в 25% глаз, в группе 4 в пределах ±0,5 дптр — нет, ±1,0 дптр — в 17% глаз (рис. 3).
Наибольшая предсказуемость попадания в рефракцию цели по Sph отмечена при расчете оптической силы тИОЛ в группе 1, наименьшая предсказуемость — в группе 4 (рис. 2).
При расчете торического компонента тИОЛ отмечено попадание по Cyl в группе 1 в пределах –0,5 дптр в 56% глаз, –1,0 дптр — в 89% глаз, в группе 2 в пределах –0,5 дптр — в 22% глаз, –1,0 дптр — в 44% глаз, в группе 3 в пределах –0,5 дптр — в 22% глаз, –1,0 дптр — в 33% глаз, в группе 4 в пределах –0,5 дптр — в 6% глаз, –1,0 дптр — в 17% глаз (рис. 4).
Наибольшая предсказуемость попадания в рефракцию цели по Cyl отмечена при расчете торического компонента тИОЛ в группе 1, наименьшая предсказуемость — группе 4 (рис. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Учитывая, что практически у каждого пациента после СКП возникает РА, выполнение экстракции катаракты с имплантацией тИОЛ позволяет за одну операцию решить проблему с катарактой и одновременно скорректировать РА. Однако точность расчета тИОЛ у пациентов после СКП имеет много особенностей. Во-первых, сложность расчета тИОЛ возникает из-за затруднения в выборе наиболее точного его калькулятора. В настоящее время существуют два вида калькуляторов тИОЛ: учитывающие кривизну только передней поверхности роговицы или кривизну ее обеих поверхностей. Как известно, в норме, преломление задней поверхности роговицы очень приближено к преломлению лучей влаги передней камеры, в связи с чем кератометрией ее задней поверхности пренебрегают многие авторы. Однако при выполнении на роговице операций кератометрические показатели ее задней поверхности могут меняться. По некоторым данным, РА задней поверхности роговицы в норме составляет в среднем –0,3 дптр, и только 9% глаз имеют РА задней поверхности роговицы более –0,5 дптр [14]. В нашем исследовании у пациентов после СКП все прямо противоположно. Лишь 11% глаз имеют РА задней поверхности роговичного трансплантата в пределах ≤ –0,3 дптр, в 44% глаз по данным ОКТ и в 56% глаз по данным шаймпфлюг-кератотопографа он выше –1,0 дптр. Поэтому его необходимо учитывать, чтобы точно подобрать торический компонент тИОЛ.
Следующим моментом, который может привести к ошибке в расчете тИОЛ, является расположение главных меридианов передней и задней поверхностей роговичного трансплантата. Как известно, при совпадении осей главных меридианов обеих поверхностей роговичного трансплантата РА задней поверхности компенсирует на свою величину значение РА передней поверхности, что приводит к снижению суммарного РА. Это необходимо учитывать вместе с величиной индуцированного астигматизма при расчете торического компонента тИОЛ, чтобы не перекорректировать и не перевернуть ось РА на противоположную. Большое значение имеет также расположение осей главных меридианов обеих поверхностей роговичного трансплантата. Если они отличаются не более чем на 5°, то тИОЛ может сразу скорректировать весь суммарный РА, иначе РА задней поверхности роговицы останется и в зависимости от своей величины (в нашем исследовании он достигал 1,8–1,9 дптр) может снижать зрение после операции. В данном исследовании разница в расположении главных меридианов обеих поверхностей роговичного трансплантата была более 5° по данным шаймпфлюгкератотопографа в 33,3% глаз, по данным ОКТ роговицы — в 41,7% глаз. В этих случаях РА задней поверхности остается после имплантации тИОЛ.
Следующим моментом является выбор прибора, результаты которого будут наиболее точны при расчете тИОЛ. По результатам данного исследования кератометрические показатели задней поверхности роговичного трансплантата сопоставимо замеряют как ОКТ роговицы, так и шаймпфлюг-кератотопограф. Разница заключается в измерении кератометрии передней поверхности роговичного трансплантата. По результатам исследования наибольшую предсказуемость по сферическому и цилиндрическому компонентам рефракции продемонстрировал способ расчета тИОЛ в группе 1, при котором кератометрические показатели передней поверхности роговичного трансплантата измеряли с помощью кератотопографа, работающего с использованием принципа колец Пласидо, и задней поверхности роговичного трансплантата — с помощью ОКТ роговицы или шаймпфлюг-кератотопографа. Наименьшая предсказуемость расчета тИОЛ была в группе 4, что может объясняться расчетом тИОЛ без учета кривизны задней поверхности роговичного трансплантата.
В настоящее время существует несколько калькуляторов тИОЛ, которые учитывают кератометрию обеих поверхностей роговичного трансплантата. В нашем исследовании значение одного из главных меридианов задней поверхности роговичного трансплантата было более 7,5 дптр в 12 глазах (34,3%), что позволяет их ввести только в онлайн-калькуляторе Barrett True-K Toric Calculator.
По данным литературы, рефракционные результаты экстракции катаракты с имплантацией тИОЛ различаются из-за применения авторами не только разных калькуляторов расчета тИОЛ, но и кератометрических данных с различных диагностических приборов. Так, было проведено клиническое исследование по коррекции РА после СКП более 2,25 дптр на 67 глазах (45 пациентов) с катарактой методом ФЭК с имплантацией тИОЛ Acrysof Toric SN60T6- SN60T9 [15]. После операции НКОЗ составил 0,61 ± 0,26, КОЗ — 0,81 ± 0,21. Послеоперационный цилиндрический компонент рефракции (ЦКР) был менее 0,75 дптр у 62% глаз и менее 1,00 дптр — у 81% глаз [15]. В 2021 г. опубликованы результаты клинического исследования по коррекции роговичного астигматизма высокой степени (от 6 до 10 дптр) после СКП у пациентов с катарактой методом ФЭК с имплантацией тИОЛ. После операции среднее значение НКОЗ увеличилось с 0,04 ± 0,02 до 0,6 ± 0,14, ЦКР снизился с –9,0 ± 1,80 до –1,1 ± 0,45 дптр, среднее значение послеоперационного сфероэквивалента составило 0,75 ± 0,5 дптр [7]. В 2022 г. представлены результаты ФЭК с имплантацией тИОЛ у пациентов после СКП с регулярной формой роговичного астигматизма более 1,5 дптр. После операции НКОЗ увеличилась с 0,1 ± 0,02 до 0,38 ± 0,11, КОЗ — с 0,23 ± 0,07 до 0,78 ± 0,12, послеоперационный ЦКР составил 0,93 ± 0,87 дптр [5].
Таким образом, наиболее предсказуемым будет метод расчета тИОЛ, при котором в калькулятор, учитывающий кератометрические данные обеих поверхностей роговичного трансплантата, будут внесены данные передней поверхности роговичного трансплантата, измеренные с помощью кератотопографа, работающего с использованием принципа колец Пласидо, и задней поверхности роговичного трансплантата — с помощью ОКТ роговицы или шаймпфлюг-кератотопографа.
ВЫВОДЫ
Проведенный сравнительный ретроспективный анализ различных методов расчета тИОЛ при экстракции катаракты у пациентов после СКП показал наибольшую предсказуемость попадания в запланированную рефракцию цели в группе 1. При расчете оптической силы и торического компонента интраокулярной линзы целесообразно использовать калькуляторы, учитывающие кератометрические показатели обеих поверхностей роговичного трансплантата, а именно кератометрические данные передней поверхности роговичного трансплантата, измеренные при помощи кератотопографа, работающего с использованием колец Пласидо, и кератометрические показатели задней поверхности роговичного трансплантата, измеренные при помощи оптического когерентного томографа роговицы или шаймпфлюг-кератотопографа.

- Deshmukh R, Nair S, Vaddavalli PK, Agrawal T, Rapuano CJ, Beltz J, et al. Post-penetrating keratoplasty astigmatism. Surv Ophthalmol. 2022; 67 (4): 1200–28. DOI: 10.1016/j.survophthal.2021.11.005.
- Kijonka M, Nowińska A, Wylęgała E, Wylęgała A, Wróblewska-Czajka E, Kryszan K, et al. Postoperative Astigmatism after Keratoplasty: A Systematic Review Meta-Analysis Based on PRISMA. J Clin Med. 2024; 13 (11): 3306. DOI: 10.3390/jcm13113306.
- Alió JL, Niazi S, Doroodgar F, Barrio JLAD, Hashemi H, Javadi MA. Main issues in penetrating keratoplasty. Taiwan J Ophthalmol. 2024; 14 (1): 50–58. DOI: 10.4103/tjo.TJO-D-24-00001.
- Den S, Shimmura S, Shimazaki J. Cataract surgery after deep anterior lamellar keratoplasty and penetrating keratoplasty in age- and disease-matched eyes. J Cataract Refract Surg. 2018; 44 (4): 496–503. DOI: 10.1016/j.jcrs.2018.01.024.
- Pellegrini M, Furiosi L, Yu AC, Giannaccare G, Scuteri G, Gardeli I, et al. Outcomes of cataract surgery with toric intraocular lens implantation after keratoplasty. J Cataract Refract Surg. 2022; 48 (2): 157–61. DOI: 10.1097/j.jcrs.0000000000000730.
- Tang Q, Yao K. Challenges in cataract surgery after penetrating keratoplasty managed using femtosecond laser: A series of 3 case reports. Medicine (Baltimore). 2024; 103 (25): e38614. DOI: 10.1097/MD.0000000000038614.
- Reddy JK, Pooja CM, Prabhakar GV. High power custom toric intraocular lens for correcting high corneal astigmatism in post-keratoplasty and keratoconus patients with cataract. Indian J Ophthalmol. 2021; 69 (7): 1766–68. DOI: 10.4103/ijo.IJO_2640_20.
- Moreno-Martínez A, Martín-Melero O, Andrés-Pretel F, Gómez-Cortés A, Granados-Centeno JM. Outcomes of Phacoemulsification With Toric Intraocular Lenses in Addressing Postkeratoplasty Astigmatism. Cornea. 2024; 43 (1): 76–82. DOI: 10.1097/ICO.0000000000003288.
- Jeeva IK, Masud S, Ali TS, Siddiqui MAR, Waheed AA, Awan A. Evaluation of visual outcomes with toric intraocular lens implantation using digital marker during cataract surgery. J Pak Med Assoc. 2024; 74 (3): 450–5. DOI: 10.47391/JPMA.8008.
- Alfonso-Bartolozzi B, Fernández-Vega-Cueto L, Fernández-Vega L, Martínez-Alberquilla I, Madrid-Costa D, Alfonso JF. Triple Procedure: A Stepwise Combination of Deep Anterior Lamellar Keratoplasty and Cataract Surgery. Cornea. 2024; 43 (3): 301–6. DOI: 10.1097/ICO.0000000000003364.
- Krysik K, Lyssek-Boron A, Janiszewska-Bil D, Wylegala E, Dobrowolski D. Impact of ultrasound and optical biometry on refractive outcomes of cataract surgery after penetrating keratoplasty in keratoconus. Int J Ophthalmol. 2019; 12 (6): 949–53. DOI: 10.18240/ijo.2019.06.11.
- Lin H, Zhang J, Niu GZ, Huang XY, Zhang YS, Liu CY, et al. Phacoemulsification in eyes with corneal opacities after deep anterior lamellar keratoplasty. Int J Ophthalmol. 2019; 12 (8): 1344–47. DOI: 10.18240/ijo.2019.08.17.
- Синицын М. В., Поздеева Н. А. Коррекция иррегулярного посткератопластического астигматизма у пациентов с катарактой. The EYE ГЛАЗ. 2023; 25 (2): 99–107. DOI: 10.33791/2222-4408-2023-2-99-107.
- Koch DD, Ali SF, Weikert MP, Shirayama M, Jenkins R, Wang L. Contribution of posterior corneal astigmatism to total corneal astigmatism. J Cataract Refract Surg. 2012; 38 (12): 2080–87. DOI: 10.1016/j.jcrs.2012.08.036.
- Visser N, Ruíz-Mesa R, Pastor F, Bauer NJ, Nuijts RM, Montés-Micó R. Cataract surgery with toric intraocular lens implantation in patients with high corneal astigmatism. J Cataract Refract Surg. 2011; 37 (8): 1403–10. DOI: 10.1016/j.jcrs.2011.03.034.