ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Динамика маркеров воспаления на начальных стадиях хронической болезни почек при сахарном диабете 1-го типа
1 Южно-Уральский государственный медицинский университет Министерства здравоохранения Российской Федерации, Челябинск, Россия
2 Челябинская областная клиническая больница, Челябинск, Россия
3 Российский университет дружбы народов имени Патриса Лумумбы, Москва, Россия
Сахарный диабет (СД) — один из основных факторов, способствующих развитию и усугублению хронической болезни почек (ХБП). Точные и удобные маркеры для раннего выявления, оценки прогрессирования и надлежащего контроля терапии ХБП у лиц с СД ограничены показателями скорости клубочковой фильтрации (СКФ) и альбуминурией. В связи с ролью хронического воспаления в патогенезе СД и ХБП целью работы было изучить показатели воспалительного процесса и их взаимосвязь с СКФ у больных СД 1-го типа (СД1) при ранних стадиях ХБП. В исследовании участвовали здоровые люди (n = 14), больные СД1 без признаков ХБП (n = 30), а также больные СД1 с 1-й стадией ХБП (n = 60), 2-й стадией ХБП (n = 38) и 3-й стадией ХБП (n = 31). СКФ рассчитывали по формуле СКD-ЕРI (рСКФ), в сыворотке иммуноферментным методом определяли концентрацию IL1β и TNFα, С-реактивного белка (С-РБ), а также концентрацию церулоплазмина (ЦП), рассчитывали индекс нейтрофилы/лимфоциты, лейкоцитарный индекс интоксикации (ЛИИ). Установлено, что в сыворотке повышается концентрация IL1β, TNFα, С-РБ и ЦП, увеличивается ЛИИ, индекс нейтрофилы/ лимфоциты. Выраженность воспалительного процесса и острофазового ответа прогрессирует и максимальна при 3б стадии ХБП, когда концентрация в сыворотке IL1β увеличивается в 2,4 раза (р = 0,042), TNFα — на 34% (р = 0,005), С-РБ — в 33 раза (р < 0,000), ЦП — на 73% (р = 0,008), ЛИИ — в 8,4 раза (р < 0,000), индекс нейтрофилы/лимфоциты — в 5 раз (р = 0,013). Интегральный показатель функции почек рСКФ снижается по мере увеличения содержания в сыворотке вышеперечисленных показателей. Таким образом IL1β, TNFα, С-РБ, ЦП, ЛИИ и индекс нейтрофилы/лимфоциты можно считать доступными и информативными показателями оценки воспалительного процесса, возрастающими по мере прогрессирования начальных стадий ХБП у больных СД1.
Ключевые слова: нейтрофилы, С-реактивный белок, IL1β, TNFα, сахарный диабет 1-го типа, хроническая болезнь почек, прогрессирование, церулоплазмин
Вклад авторов: М. В. Осиков, Л. А. Эфрос — планирование исследования, разработка концепции и дизайна исследования, анализ литературы, интерпретация данных, подготовка черновика рукописи; Л. Ю. Журавлева — сбор данных, статистическая обработка, интерпретация данных, подготовка рукописи; А. А. Федосов — анализ литературы, интерпретация данных, подготовка рукописи.
Соблюдение этических стандартов: исследование одобрено этическим комитетом ФГБОУ ВО ЮУГМУ Минздрава России (протокол № 5 от 10 июня 2024 г.); проведено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации.
Для корреспонденции: Людмила Юрьевна Журавлева
ул. Воровского, 70 (Медгородок), корпус 8, 454048, г. Челябинск, Россия; ur.iam@0161_analim
Сахарный диабет (СД) — одна из основных причин преждевременной смерти от хронических неинфекционных заболеваний, на его долю приходится около 1,5 млн смертей ежегодно. Общая численность пациентов с СД в РФ в 2023 г. составила 4,9 млн, или 3,31% населения, из них СД 1-го типа (СД1) — 277,1 тыс. Несмотря на достижения в диагностике и терапии наблюдается рост распространенности СД1 примерно на 2–3% в год, в 2022 г. она составила 191 случай на 100 тыс. [1].
Большая часть больных СД1 находится в наиболее трудоспособном возрасте (30–39 лет), средний возраст смерти при СД1 составляет 53,2 года. Одно из частых микрососудистых осложнений СД — диабетическая нефропатия, она возникает в среднем у 40% больных, ее частота при СД1 составляет 50% через 10 лет и 75% через 20 лет [2]. По информации Организации Объединенных Наций, хроническая болезнь почек (ХБП) требует особого внимания и является одним из показателей прогресса в достижении мировых целей по уменьшению преждевременной смертности от неинфекционных заболеваний к 2030 г. [1, 3]. Подчеркивается важность выявления факторов риска для предотвращения прогрессирования ХБП с учетом ее возрастающего влияния на здоровье населения [4]. Доказано, что целенаправленные вмешательства на ранней стадии ХБП при СД1 эффективно предотвращают прогрессирование почечной недостаточности и улучшают результаты лечения пациентов, регулярный скрининг на ХБП является основополагающим принципом ведения пациентов с СД [5]. До настоящего времени окончательный патогенез ХБП при СД не ясен и включает такие механизмы как эндотелиальная дисфункция, хроническое воспаление и тромбоз, дисфункция митохондрий и окислительный стресс, гиперметилирование гистонов, метилирование ДНК, атерогенная дислипидемия и артериальная гипертензия и др., а понимание синергичных молекулярно-клеточных механизмов при СД и ХБП имеет решающее значение для оценки прогрессирования ХБП при СД, разработки эффективных диагностических и терапевтических подходов [3, 6].
Воспаление — типовой патологический процесс, лежащий в основе многих заболеваний и синдромов, в том числе СД и ХБП. Особое внимание уделяется системному хроническому низкоинтенсивному воспалению и его маркерам: провоспалительным цитокинам (интерлейкину 1β (IL1β) и фактору некроза опухоли — (TNFα), IL6 и др.), реактантам острой фазы (высокочувствительному С-реактивному белку (С-РБ), сывороточному амилоиду А, церулоплазмину (ЦП) и др.) [7, 8]. Хроническое воспаление рассматривают как ключевой фактор в патогенезе макро- и микрососудистых осложнений СД, включая ХБП [9]. В то же время в клинических условиях наиболее доступным методом оценки выраженности воспалительного и острофазового ответа остается подсчет лейкоцитарной формулы (увеличение молодых форм нейтрофилов) и ее производных (лейкоцитарный индекс интоксикации (ЛИИ), индекс нейтрофилы/лимфоциты), что весьма информативно в прогностическом плане долгосрочной выживаемости, летальности и для ранжирования факторов, способствующих сердечно-сосудистым болезням [10]. Большая часть информации о взаимосвязи воспалительных маркеров в крови с развитием и ухудшением диабетической нефропатии была собрана у пациентов, страдающих СД2, что обусловлено высокой его распространенностью.
Цель работы — исследовать показатели воспалительного процесса и их взаимосвязь со скоростью клубочковой фильтрации у больных СД1 на начальных стадиях хронической болезни почек.
ПАЦИЕНТЫ И МЕТОДЫ
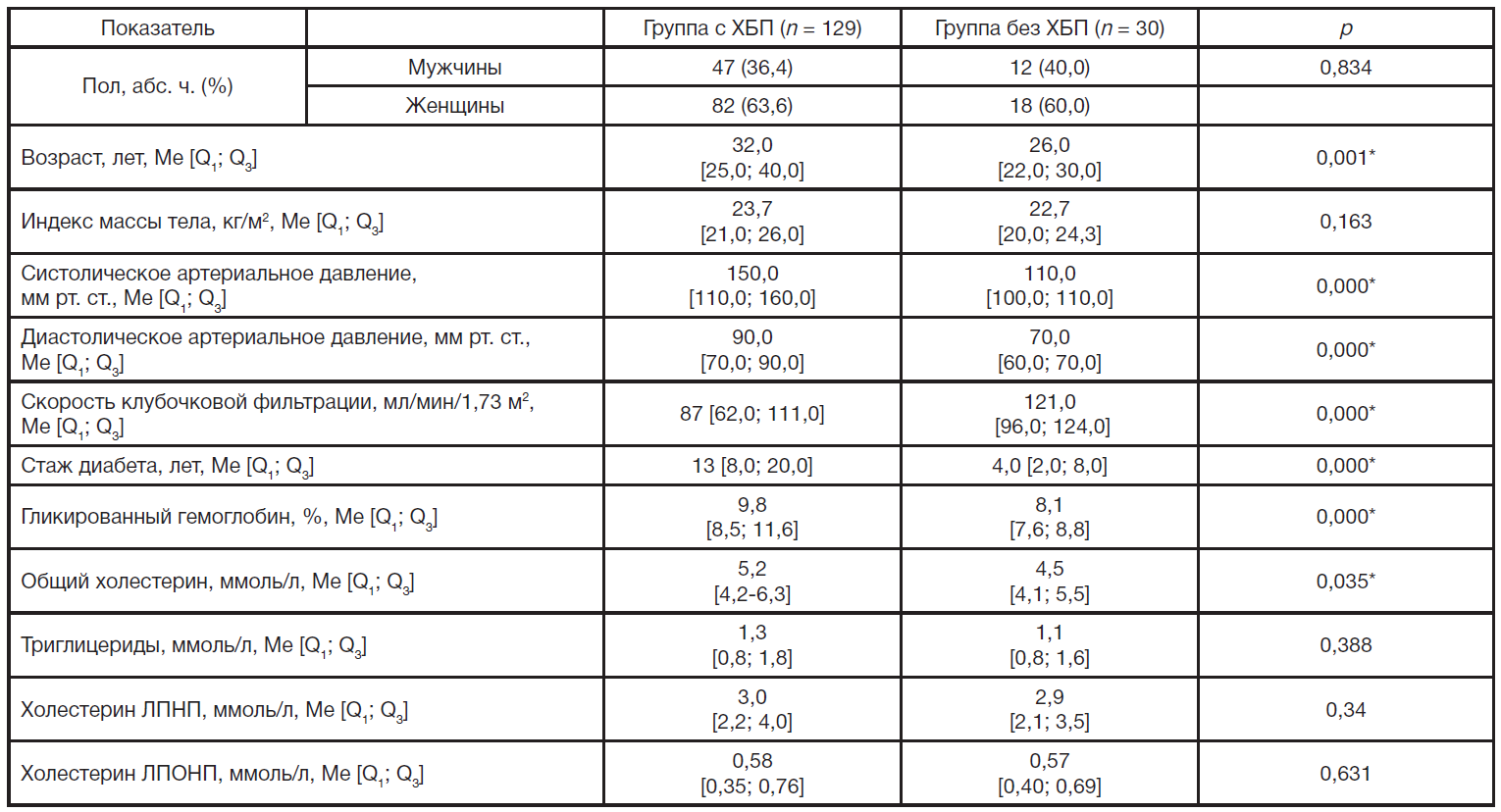
Исследование выполнено на базе ГБУЗ «Челябинская областная клиническая больница», ФГБОУ ВО ЮУГМУ Минздрава России. В исследовании принимали участие женщины в возрасте от 18 до 54 лет, мужчины в возрасте от 18 до 60 лет. Критерии включения: 1) наличие СД1 более 6 месяцев в соответствии с национальными клиническими рекомендациями [11]; 2) информированное согласие на участие в исследовании. Критерии исключения: 1) возраст старше 60 лет; 2) рСКФ ≤ 29 мл/мин/1,73 м2; 2) наличие СД2 и других эндокринологических заболеваний; 3) тяжелые сопутствующие заболевания печени, легких, туберкулез, ревматологические заболевания, аутоиммунные заболевания почек, постменопаузальный остеопороз, онкологические заболевания; 4) прием глюкокортикоидов, цитостатиков, препаратов витамина D, фосфатбиндеров; 5) пациенты с воспалительными заболеваниями почек, а также других органов и систем. Группа 1 представлена клинически здоровыми людьми, сопоставима по возрасту и полу с основной группой (n = 14): мужчин 42,9%, женщин 57,1%, средний возраст 30,6 ± 4,2 лет, показатели индекса массы тела, систолического и диастолического артериального давления, липидограммы в пределах нормальных значений. Группа 2 включает больных СД1 без признаков ХБП (n = 30). Группа 3 представлена больными СД1 с признаками ХБП (n = 129), в том числе 1-я стадия ХБП (группа 3.1; n = 60), 2-я стадия ХБП (группа 3.2; n = 38), 3а стадия ХБП (группа 3.3; n = 21), 3б стадия ХБП (группа 3.3; n = 10). Стадию ХБП устанавливали в соответствии с национальными клиническими рекомендациями [12]. Больные СД1 находились в состоянии компенсации (n = 12; 7,5%), субкомпенсации и декомпенсации при поступлении в стационар, на фоне терапии в стационаре достигнута компенсация, маркеры воспаления брали перед выпиской (n = 147; 92,5%). Клиническая характеристика групп пациентов СД1 с ХБП и без ХБП представлена в табл. 1.
Анализ результатов показал, что в группе пациентов с ХБП достоверно ниже рСКФ, чем у пациентов с отсутствием ХБП (р = 0,037). Стаж диабета в группе пациентов с ХБП составил 13 лет, тогда как в группе пациентов с отсутствием ХБП этот показатель был статистически значимо ниже (р = 0,000 ). Выявлены статистически значимые различия по среднему уровню гликированного гемоглобина у пациентов с наличием и отсутствием ХБП (9,8% и 8,1% соответственно). Величина среднего систолического и диастолического артериального давления в группе пациентов с ХБП была выше (р = 0,000), отмечены более высокие показатели общего холестерина в группе пациентов с ХБП (р = 0,035).
Анализ результатов показал, что более длительный стаж СД у пациентов с ХБП 1-й стадии, чем у пациентов с отсутствием ХБП (р < 0,001). Величина средних показателей систолического артериального давления в группе пациентов с ХБП 1-й стадии оказалась статистически значимо выше (р = 0,001). У больных СД1 с ХБП 2-й стадии в сравнении с пациентами с отсутствием ХБП рСКФ была ниже (р = 0,000). Стаж диабета был выше у пациентов с ХБП 2-й стадии (р = 0,000). У пациентов с ХБП 2-й стадии статистически значимо был выше средний показатель гликированного гемоглобина (р = 0,012) и средний уровень общего холестерина (р = 0,007). Значения среднего систолического и диастолического АД в группе с ХБП 2-й стадии оказались статистически значимо выше, чем в группе с отсутствием ХБП (р = 0,001 и р < 0,001). При сравнении группы пациентов с ХБП 3-й стадии и с отсутствием ХБП имелись статистически значимые различия. В группе пациентов с ХБП 3-й стадии средний возраст был выше (р = 0,015). Более длительный стаж диабета отмечен у пациентов с ХБП 3-й стадии (р = 0,001). Значения среднего систолического и диастолического АД оказались статистически значимо выше в группе пациентов с ХБП 3-й стадии (р < 0,001), уровень гликированного гемоглобина был выше у пациентов с ХБП 3-й стадии (р = 0,010). Результаты сравнительного анализа группы пациентов с ХБП 2-й стадии с группой пациентов с ХБП 3-й стадии показали статистически значимое снижение среднего уровня скорости клубочковой фильтрации (р < 0,001).
Показатели альбуминурии как маркеры ХБП представлены в табл. 2.
Отмечено, что достоверно больше при ХБП 1-й стадии пациентов с альбуминурией А1 стадии (р = 0,031), в то время как при ХБП 3а и Зб стадий — с альбуминурией А3 стадии (р = 0,022).
Для расчета СКФ по формуле СКD-ЕРI (рСКФ) определяли концентрацию креатинина в сыворотке кинетическим колориметрическим методом на анализаторе «Cobas Jntegra 400» (Швейцария) [2]. Общее число лейкоцитов в крови определяли на гематологическом анализаторе «CoulterLH 500» («BeckmanCoulter», США), лейкоцитарную формулу — при микроскопии окрашенных по Романовскому–Гимзе мазков крови с подсчетом 200 клеток. Лейкоцитарный индекс интоксикации (ЛИИ) рассчитывали по формуле:
формула
Кроме этого, определяли отношение количества в крови всех популяций нейтрофилов и лимфоцитов (нейтрофилы/лимфоциты). Концентрацию в сыворотке IL1β и TNFα определяли на автоматическом иммуноферментном анализаторе «Personal LAB» (Adaltis Italia, Италия) с помощью тест-систем АО «Вектор- Бест» (Новосибирск), результаты выражали в пг/мл. Концентрацию в сыворотке высокочувствительного С-РБ определяли на автоматическом иммуноферментном анализаторе «ChemWell 2910» (Awareness technology, США) с помощью тест-системы АО «Вектор-Бест» (Новосибирск), результаты выражали в МЕ/л. Концентрацию в сыворотке церулоплазмина (ЦП) определяли на спектрофотометре «СФ-56» («ЛОМО-Спектр», Россия) модифицированным методом по Ревину, основанным на окислении р-фенилендиамина, результаты выражали в мг/л [14]. Полученные результаты обрабатывали с помощью пакета «IBM SPSS Statistics v. 23» («SPSS: An IBM Company», США). Нормальность распределения количественных показателей в группе пациентов с ХБП 1-й стадии проверяли по критерию Колмогорова–Смирнова, в группах с ХБП 2-й, 3а и 3б стадиями, а также у здоровых людей и пациентов без ХБП — с помощью критерия Шапиро–Уилка. Данные представлены в виде Me (Q1; Q3), где Мe — медиана, Q1 и Q3 — значение нижнего (25) и верхнего (75) квартилей соответственно. Проверку статистических гипотез в группах проводили с использованием критерия Манна–Уитни. Для выявления взаимосвязей между исследуемыми параметрами использовали коэффициент корреляции Спирмена (R), для оценки силы связи — шкалу Чеддока.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
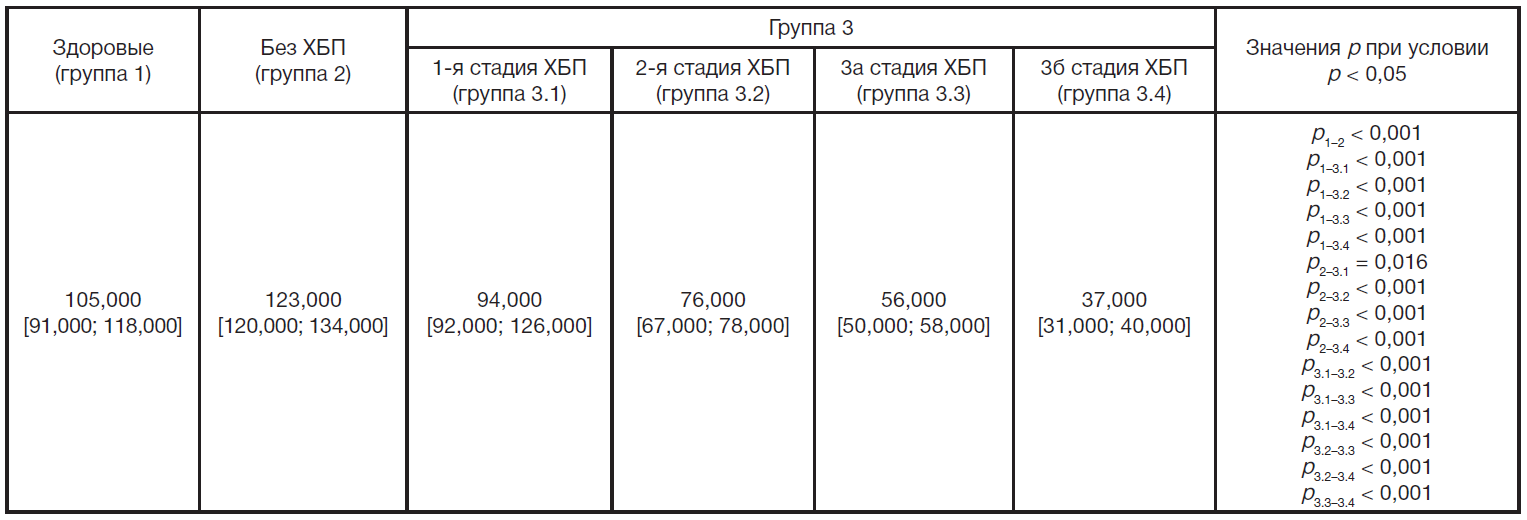
Значения рСКФ в исследуемых группах больных представлены в табл. 3. Обнаружено, что по сравнению с группой здоровых лиц рСКФ значимо повышается в группе больных с СД1 без признаков ХБП (группа 2) и закономерно снижается в группе больных с ХБП (группа 3). Причем в группе 2 повышение составляет 17% по медиане относительно значений в группе здоровых лиц, а снижение в группе 3.1 (ХБП 1-й стадии) — на 10%, в группе 3.2 (ХБП 2-й стадии) — на 28%, в группе 3.3 (ХБП 3а стадии) — на 46%, в группе 3.4 (ХБП 3б стадии) — на 65%. Кроме этого, в группах 3.1, 3.2, 3.3 и 3.4 рСКФ значимо снижается и по сравнению с группой 2. Значения рСКФ в группах 3.1, 3.2, 3.3 и 3.4 соответствуют критериям ХБП стадии 1, стадии 2, стадии 3а, стадии 3б соответственно [12]. Значение рСКФ у больных ХБП 2-й стадии значимо отличается от значений в группе больных ХБП 1-й стадии, у больных ХБП 3а стадии — от значений в группе больных ХБП 1-й и 2-й стадии, у больных ХБП 3б стадии — от значений в группе больных ХБП 1-й, 2-й и 3а стадии.
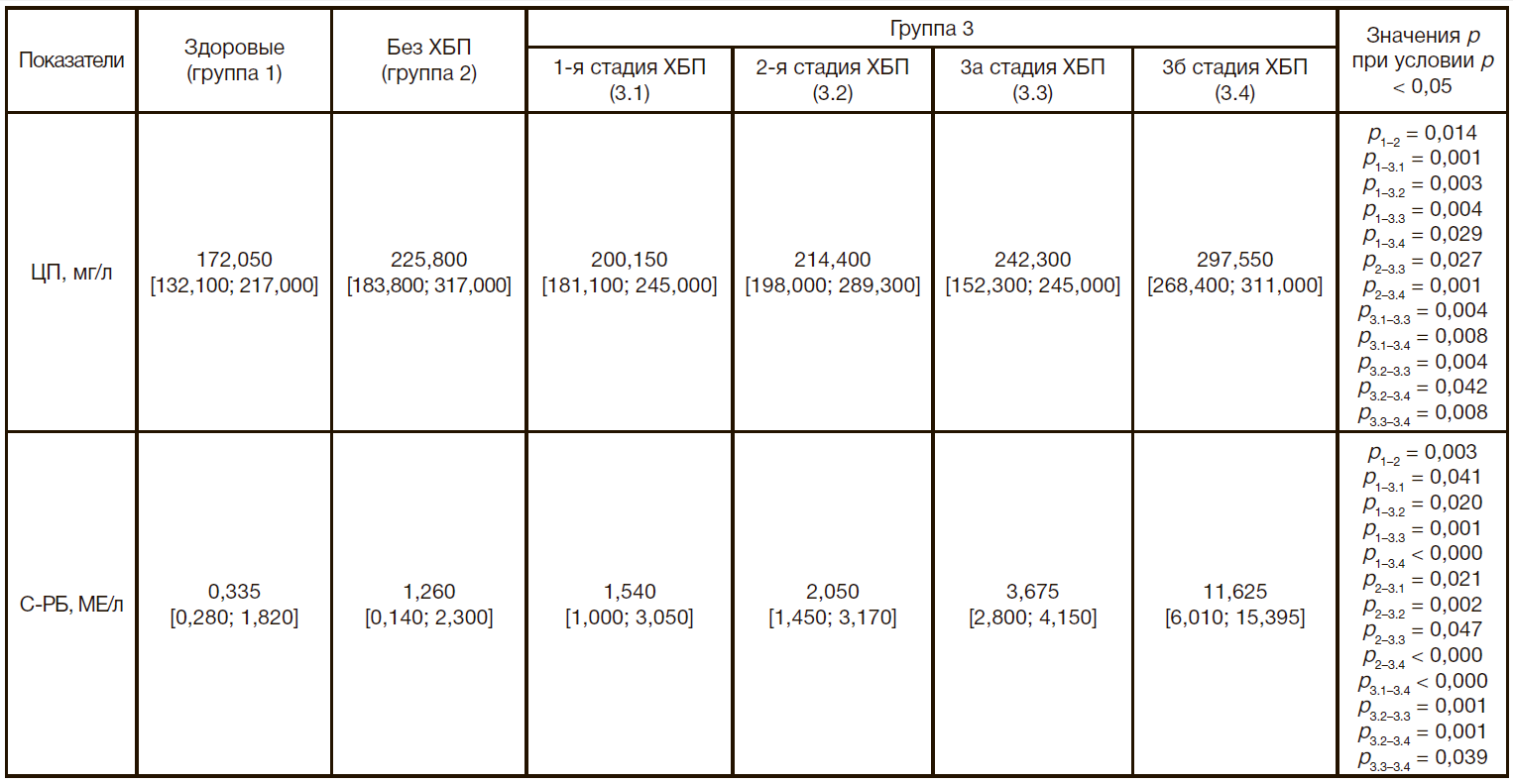
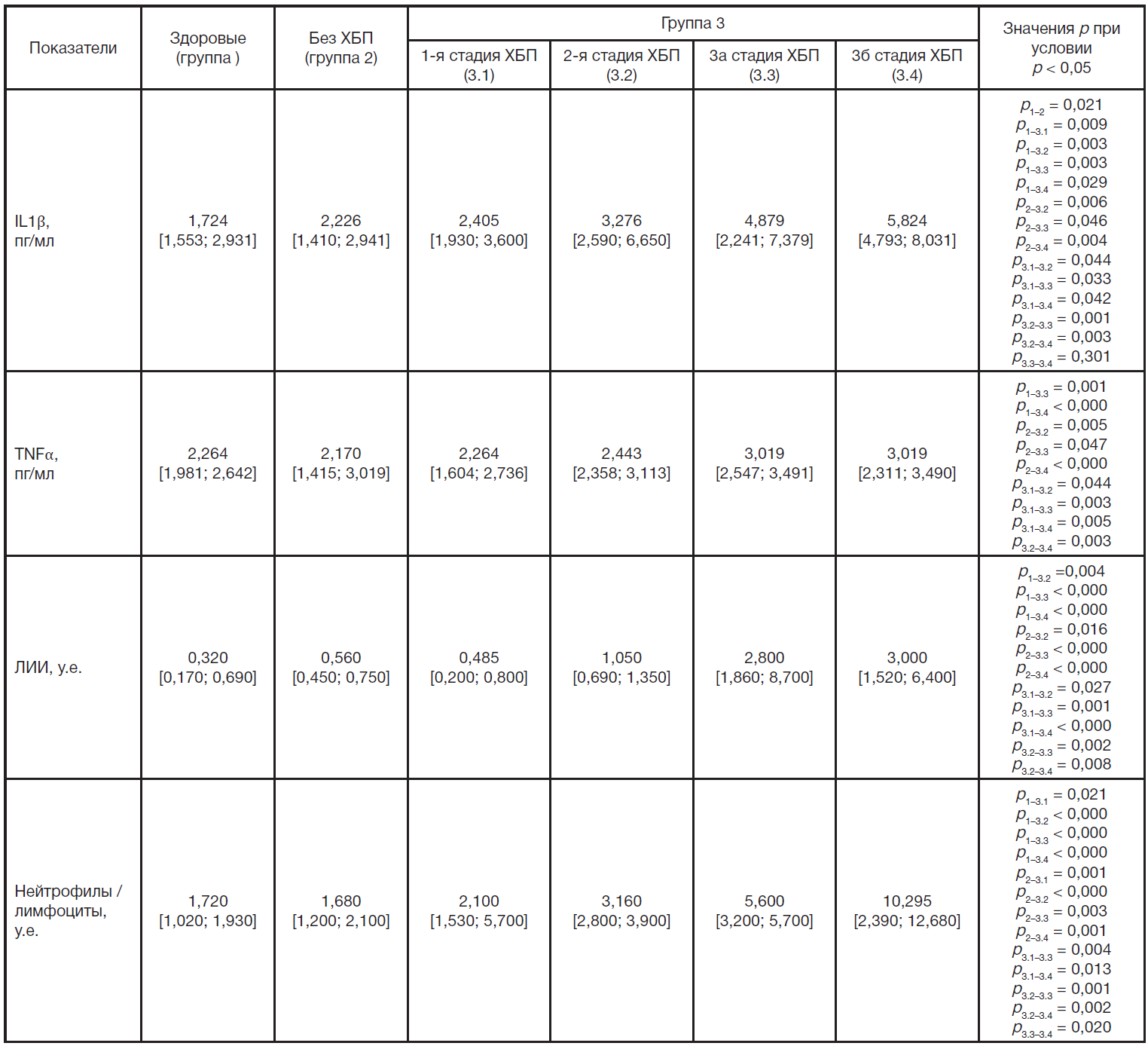
Результаты исследования выраженности воспалительного процесса у больных СД1 и ХБП приведены в табл. 4. Прежде всего следует отметить изменение концентрации в сыворотке провоспалительных цитокинов. Так, концентрация IL1β в группе больных с СД1 без признаков ХБП значимо увеличилась на 31% по медиане относительно значений в группе здоровых лиц; в группе больных с СД1 и ХБП концентрация IL1β прогрессивно возрастала от стадии 1 к стадии 3б: в группе 3.1 — на 40% по медиане относительно значений в группе здоровых лиц, в группе 3.2 — на 91%, в группе 3.3 — в 1,8 раза и в группе 3.4 — в 2,4 раза. Обнаружены достоверные изменения концентрации в сыворотке IL1β при ХБП 2-й, 3а и 3б стадии по сравнению с группой больных СД1 без признаков ХБП и группой больных с ХБП 1-й стадии, а также при ХБП 3а стадии — по сравнению с ХБП 2-й стадии, ХБП 3б стадии — по сравнению с ХБП 2-й и 3а стадии. Концентрация в сыворотке TNFα значимо не отличалась относительно данных в группе здоровых лиц у больных с СД1 без признаков ХБП и больных с СД1 и ХБП 1-й и 2-й стадии, а у больных с СД1 и ХБП 3а и 3б стадии увеличивалась на 34% по медиане. Выявлены изменения концентрации в сыворотке TNFα при ХБП 2-й, 3а и 3б стадии по сравнению с группой больных СД1 без признаков ХБП и группой больных с ХБП 1-й стадии, а также при ХБП 3б стадии — по сравнению с ХБП 2-й стадии.
Выраженность острофазового ответа при СД1, в том числе при сочетании с ХБП, включала изменение содержания популяций лейкоцитов в периферической крови, что, в частности, проявилось изменением ЛИИ и индекса нейтрофилы/лимфоциты. Так, ЛИИ значимо увеличивался в группах больных с СД1 и ХБП 2-й, 3а и 3б стадии соответственно в 2,3 раза, в 7,8 раза, в 8,4 раза по медиане относительно значений в группе здоровых лиц. Кроме этого, ЛИИ значимо увеличивался в группах больных с СД1 и ХБП 2-й, 3а и 3б стадии относительно больных с СД1 без признаков ХБП и с ХБП 1-й стадии. При СД1 и ХБП 3а и 3б стадии ЛИИ возрастал при сравнении с группой ХБП 2-й стадии. Более выраженные изменения популяционного спектра лейкоцитов в крови зафиксированы при оценке индекса нейтрофилы/лимфоциты. У больных с СД1 и ХБП индекс значимо возрастал по сравнению с группой здоровых лиц: в группе 3.1 — на 22% по медиане, в группе 3.2 — на 81%, в группе 3.3 — в 2,3 раза и в группе 3.4 — в 5 раз. Отмечено достоверное повышение индекса нейтрофилы/лимфоциты у больных с СД1 и ХБП 1-й, 2-й, 3а и 3б стадии по сравнению с группой больных с СД1 без признаков ХБП, а также у больных с СД1 и ХБП 3а и 3б стадии по сравнению с больными с СД1 и ХБП 1-й и 2-й стадии; у больных с СД1 и ХБП 3б стадии по сравнению с больными 3а стадии. Отмечено увеличение IL1β и TNFα с прогрессированием ХБП у пациентов с СД1, но в пределах нормальных показателей, что требует постоянного контроля за данными показателями.
На следующем этапе оценивали концентрацию в сыворотке реактантов острой фазы С-РБ и ЦП (табл. 5). Обнаружено увеличение концентрации С-РБ у больных СД1 без признаков ХБП, а также у больных СД1 и ХБП 1-й, 2-й, 3а и 3б стадии относительно группы здоровых лиц соответственно в 2,7 раза, в 3,5 раза, в 5,1 раза, в 9,9 раза, в 33 раза по медиане. Во всех группах больных с признаками ХБП содержание в сыворотке С-РБ увеличивалось по сравнению с группой больных СД1 без признаков ХБП; в группах с СД1 и ХБП 3а и 3б стадии по сравнению с СД1 и ХБП 1-й, 2-й стадии, в группе с СД1 и ХБП 3б стадии по сравнению с СД1 и ХБП 3а стадии. Выявлено повышение концентрации в сыворотке ЦП у больных СД1 без признаков ХБП, а также у больных СД1 и ХБП 1-й, 2-й, 3а и 3б стадии относительно группы здоровых лиц соответственно на 31%, 16%, 24%, 41% и 73% по медиане. Содержание в сыворотке ЦП увеличивалось в группах с СД1 и ХБП 3а и 3б стадии по сравнению с группой больных СД1 без признаков ХБП, а также СД1 и ХБП 1-й стадии; в группе с СД1 и ХБП 3а стадии по сравнению с СД1 и ХБП 2-й стадии; в группе с СД1 и ХБП 3б стадии по сравнению с СД1 и ХБП 3а стадии. Отмечено нарастание ЦП с увеличением стадии ХБП, но в пределах нормальных значений, в связи с чем необходимо динамическое наблюдение за этим маркером.
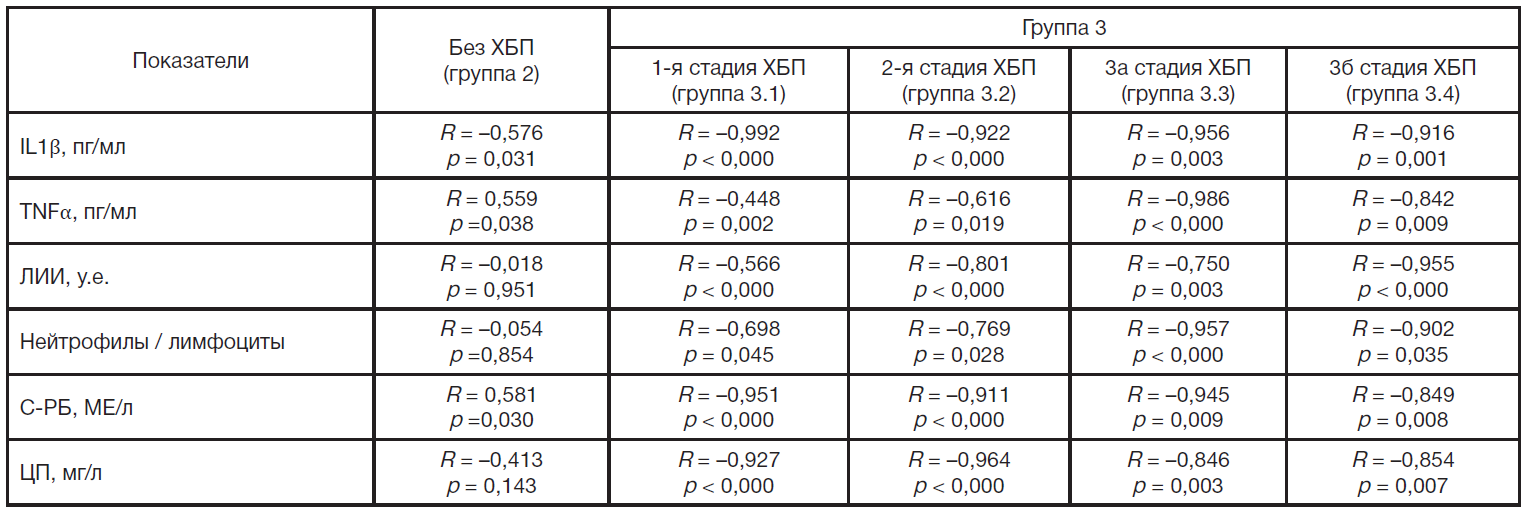
Нами проведен корреляционный анализ между рСКФ — одним из ключевых параметров функции почек, который необходим для оценки прогрессирования ХБП, установления ее стадии в соответствии с национальными и международными критериями и признаками воспалительного процесса у больных СД1 и начальными стадиями ХБП (табл. 6). При ХБП 1-й стадии выявлены в соответствии со шкалой Чеддока умеренная связь с концентрацией в сыворотке TNFα, заметная связь с ЛИИ и индексом нейтрофилы/лимфоциты, очень высокая связь с концентрацией в сыворотке IL1β, С-РБ и ЦП, все связи обратные. При ХБП 2-й стадии обнаружены заметная связь с концентрацией в сыворотке TNFα, высокая связь с ЛИИ и индексом нейтрофилы/лимфоциты, очень высокая связь с концентрацией в сыворотке IL1β, С-РБ и ЦП, при ХБП 2-й стадии все связи обратные. При ХБП 3а стадии обнаружены высокая связь с ЛИИ и концентрацией в сыворотке ЦП, очень высокая связь с концентрацией в сыворотке IL1β, TNFα, С-РБ и индексом нейтрофилы/ лимфоциты. При ХБП 3б стадии обнаружены высокая связь с концентрацией в сыворотке TNFα, С-РБ и ЦП, очень высокая связь с концентрацией в сыворотке IL1β, ЛИИ и индексом нейтрофилы/лимфоциты, обратная связь.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При оценке рСКФ выявлено ее повышение в группе больных СД1 без признаков ХБП (группа 2). Увеличение рСКФ и гиперфильтрация при СД1 (с максимальными значениями до 162 мл/мин/1,73 м2) встречаются у 10–67% пациентов и рассматриваются как результат компенсаторной гипертрофии и гиперфункции почек в ответ на гипергликемию, эффекты провоспалительных цитокинов и факторов роста, локального ангиотензина (II), дисбаланса вазоактивных факторов регуляции пре- и постгломерулярного кровотока, изменение реабсорбции натрия, глюкозы и Н+ в проксимальных участках нефрона [15, 16]. В настоящее время внутриклубочковую гиперфильтрацию рассматривают как один из основных механизмов возникновения и прогрессирования диабетической болезни почек (ДБП) [16, 17].
Патогенез обнаруженных нами у больных СД1 и ХБП признаков воспаления в виде увеличения концентрации в сыворотке IL1β, TNFα, С-РБ, ЦП, увеличения ЛИИ и индекса нейтрофилы/лимфоциты является многофакторным [18]. Механизм формирования флогогенного потенциала при СД включает, во-первых, гипергликемию, которая приводит к гликозилированию белков, образованию конечных продуктов гликирования, вызывающих повреждение тканей и активацию иммунных клеток, высвобождение провоспалительных цитокинов. Во-вторых, при СД избыточное количество глюкозы приводит к повышенному образованию реактивных форм кислорода, оксидативному стрессу, что дополнительно повреждает клетки почек и провоцирует воспаление. В-третьих, при диабетической нефропатии наблюдается гиперактивация ренин-ангиотензиновой системы, что не только способствует артериальной гипертензии, но и усиливает воспаление в почках за счет увеличения продукции провоспалительных цитокинов, таких как IL6 и TNFα. Наконец, в ответ на повреждение клеток почек активируется местный иммунный ответ, когда лимфоциты, макрофаги и другие клетки проникают в ткань почек, секретируют воспалительные медиаторы, что усугубляет повреждение почек.
В ответ на синтез, секрецию и повышение уровня в крови провоспалительных медиаторов, включая продемонстрированные нами IL1β, TNFα, происходит активация миелоидного ростка костного мозга с увеличением пролиферации и дифференцировки клеток-предшественниц, увеличением количества нейтрофилов, включая миелоциты и метамиелоциты, в периферической крови. Данный факт был зафиксирован нами в виде увеличения ЛИИ и индекса нейтрофилы/ лимфоциты. Нейтрофилы — наиболее распространенная популяция лейкоцитов у людей, их дегрануляция, фагоцитоз, генерация активных форм кислорода и азота, высвобождение внеклеточных ловушек инициируют и пролонгируют воспалительный процесс, участвуют в патогенезе ишемии миокарда, сердечной недостаточности инсульта и других заболеваний [19]. Полагают, что количество и функциональная активность нейтрофилов связаны с хроническим воспалением, формированием микро- и макроальбуминурии при СД, а повышение количества в крови является ранним маркером, наряду с микроальбуминурией и рСКФ, поражения почек при СД, прогрессирования (ДБП), а также имеет нелинейную связь с риском смерти при ДБП [10, 20]. По данным других исследователей, количество циркулирующих в крови нейтрофилов положительно коррелирует с протеинурией при ДБП [21].
Отношение нейтрофилов к лимфоцитам в крови указывает на системное воспаление и связано с распространенностью ДБП и сердечно-сосудистых заболеваний, смертностью от всех причин при СД [22, 23]. Индекс нейтрофилы/лимфоциты рассматривают в качестве надежной метрики выраженности системного воспаления с учетом роли нейтрофилов как неспецифических участников воспаления (врожденного иммунитета) и лимфоцитов как регуляторов всех воспалительных реакций и участников адаптивного иммунитета [24]. Показана положительная связь между индексом нейтрофилы/лимфоциты и концентрацией в сыворотке IL1β и С-РБ [25]. Результаты нескольких метаанализов клинических исследований показали более высокие значения индекса нейтрофилы/ лимфоциты у пациентов с диабетической нефропатией по сравнению с больными с СД без поражения почек, а также перспективы применения этого индекса в стратификации и прогнозировании риска смертности от всех причин, сердечно-сосудистой смертности [21, 26, 27]. В то же время наличие ХБП также может вызывать хроническое воспаление, которое усугубляет повреждение органов и тканей, приводит к эскалации воспалительных реакций [8]. Однако все эти данные посвящены роли нейтрофилов у больных СД2. Отметим также, что по сравнению с другими воспалительными маркерами ЛИИ и индекс нейтрофилы/лимфоциты имеют преимущества с точки зрения доступности, экономичности и информативности. По нашим данным, они показали высокую обратную связь с рСКФ при ХБП 2-й стадии и очень высокую связь при ХБП 3а и 3б стадии.
При повышении уровня провоспалительных цитокинов в крови в гепатоцитах запускается синтез реактантов острой фазы (РОФ) воспаления, включая С-РБ и ЦП как представителей соответственно РОФ первого эшелона (концентрация в крови повышается в первые 6–12 ч с максимумом через 24 ч) и РОФ третьего эшелона (максимум концентрации через 48–72 ч) [28]. РОФ широко используют в клинической практике для мониторинга течения воспалительных заболеваний и контроля лечения. С-РБ представлен нативной пентамерной и мономерной формами с плейотропной активностью, кроме маркерной роли выраженности воспалительного процесса и фактора риска сердечно-сосудистых заболеваний (для фракции высокочувствительного С-РБ), непосредственно участвует в патогенезе диабетической нефропатии за счет нескольких механизмов. Представлены данные о роли С-РБ в регуляции активации комплемента за счет подавления аутофагии подоцитов и ингибирования сигнализации оси C3a/C3aR, что показано в клинических и экспериментальных условиях при поражении почек в условиях СД [29]. Кроме того, при СД С-РБ активирует сигнальные пути TGFβ/SMAD и ядерного фактора κB, которые участвуют в реализации воспаления в почках и нефросклероза при диабетической нефропатии за счет индукции синтеза IL1β, TNFα, хемоаттрактантного белка моноцитов-1, TGFβ1 [27, 30]. При экспериментальном стрептозотоцин-индуцированном СД и клеточной линии человеческих нефроэпителиоцитов показано участие С-РБ в патогенезе диабетической нефропатии через взаимодействие с рецептором FcγRII на клетках почек, активацию сигнальных путей Wnt/β-катенина, ERK1/2 и нарушение эпителиально-мезенхимальных взаимодействий [31]. С-РБ через NF-κB и Smad3-зависимые механизмы может вызвать гибель клеток и прогрессирующий фиброз почек [32]. Экспериментально-индуцированный дефицит С-РБ ингибирует развитие диабетической нефропатии [29]. Уровень С-РБ в сыворотке ассоциирован с микрососудистыми осложнениями, включая поражение почек, при СД2 [33, 34]. С использованием двухступенчатой регрессивной модели у более 2000 больных СД2 с оценкой однонуклеотидных генетических полиморфизмов гена С-РБ на хромосоме 1 (1q21–q23) показана причинно-следственная связь высокого уровня С-РБ в сыворотке и возникновения диабетической нефропатии [34]. По мнению некоторых исследователей, индекс С-РБ/альбумин сыворотки является более информативным независимым предиктором формирования диабетической нефропатии при СД2 [35]. Кроме того, уровень С-РБ в сыворотке ассоциирован с отношением альбумин/креатинин в моче у больных СД2 [36].
Церулоплазмин не только отражает острое и хроническое воспаление в организме, но и является металлопротеином с антиоксидантными свойствами благодаря своей ферроксидазной активности, а в условиях окислительного стресса может действовать как прооксидант, участвуя в образовании АФК и окисленных ЛПНП; именно с последним фактом связывают его патогенетическую роль в формировании осложнений при СД. Показано, что при диабетической нефропатии у пациентов с СД2 и микроальбуминурией наблюдаются повышенные потери меди в составе ЦП с мочой, что приводит с снижению синтеза Cu, Zn-супероксиддисмутазы и формированию окислительного стресса [37]. Повышенный уровень ЦП зафиксирован при СД1 и СД2, в том числе в условиях диабетической нефропатии [:lit_38, 39;]. ЦП рассматривают как перспективный чувствительный биомаркер при СД2, принимающий участие в формировании окислительного стресса, инсулинорезистентности, нарушений метаболизма липидов при данной патологии [40]. Установлена роль сывороточного ЦП как независимого прогностического фактора при прогрессировании диабетической нефропатии у пациентов с СД2. Нами убедительно показано повышение концентрации ЦП в сыворотке у больных с ХБП в условиях СД1, прогрессирующее от 16% прироста по медиане при ХБП 1-й стадии от значений в группе здоровых людей до 73% прироста при ХБП 3б стадии. Доказана обратная высокой силы связь ЦП со стадией ХБП по показателю рСКФ. Определение концентрации ЦП в сыворотке не представлено широко в клинической практике, однако оно может быть полезно в качестве маркера диабетической нефропатии при многократном определении и нарастании в динамике, особенно в отсутствии альбуминурии.
Важно отметить, что хронический воспалительный процесс в почках приводит к повреждению мелких сосудов и клубочков, протеинурии и снижению фильтрационной способности почек. Кроме этого, хроническое воспаление сопровождается активацией фибробластов и продукцией компонентов экстрацеллюлярного матрикса, что вызывает интерстициальный фиброз и утрату почечных функций. Эти механизмы, а также механизмы инициации воспалительного процесса при СД и ХБП взаимосвязаны, усиливают друг друга, создавая порочные круги, приводят к прогрессированию диабетической нефропатии и утрате функции почек, необходимости заместительной терапии. Понимание патофизиологии воспаления при диабетической нефропатии открывает перспективы для разработки эффективных методов диагностики и лечения этого серьезного состояния. Проблема поиска чувствительных и специфичных биомаркеров диабетической нефропатии актуальна для практической медицины в отношении диагностики, контроля лечения и прогрессирования ХБП при СД [41]. Первостепенное значение имеют используемые в настоящее время клинические биомаркеры, такие как рСКФ, протеинурия, альбуминурия, — важнейшие предикторы прогрессирования заболеваний почек, сердечно-сосудистых осложнений и смертности у пациентов с диабетической нефропатией [42]. По результатам проведенного исследования, на роль перспективных биомаркеров инициации и прогрессирования поражения почек у больных СД1 и начальными стадиями ХБП претендуют уровень в сыворотке IL1β, TNFα, С-РБ и ЦП, ЛИИ, индекс нейтрофилы/лимфоциты.
ВЫВОДЫ
У больных СД1 и начальными стадиями ХБП в сыворотке повышается концентрация IL1β, TNFα, С-РБ и ЦП, увеличиваются ЛИИ, индекс нейтрофилы/лимфоциты. Наиболее значимыми показателями воспалительной активности у пациентов с СД1 и начальными стадиями ХБП являются уровень IL1β в сыворотке, соотношение нейтрофилов и лимфоцитов, а также концентрация С-РБ и ЦП. Имеет смысл измерять их в динамике, при наличии компенсации диабета и отсутствии активных воспалительных процессов у пациента, начиная с ХБП 1-й стадии. Выраженность воспалительного процесса и острофазового ответа у больных с СД1 и начальными стадиями ХБП прогрессирует и максимальна при 3б стадии ХБП, когда наблюдалось увеличение концентрации в сыворотке IL1β в 2,4 раза, концентрации TNFα — на 34%, концентрации С-РБ — в 33 раза, концентрации ЦП — на 73%, ЛИИ — в 8,4 раза, индекса нейтрофилы/лимфоциты — в 5 раз. Установлено, что у больных СД1 с начальными стадиями ХБП интегральный показатель функции почек — рСКФ — снижается по мере увеличения содержания в сыворотке воспалительных маркеров. Наибольшее количество связей и их сила обнаружены при 3а и 3б стадии ХБП у больных СД1, преимущественно между рСКФ и концентрацией в сыворотке IL1β и С-РБ. Представленные результаты расширяют имеющиеся представления о роли воспалительного процесса и ответа острой фазы в патогенезе ХБП у больных СД1, являются предпосылкой для проведения дальнейших более масштабных по количеству пациентов и продолжительности исследований в различных регионах РФ с учетом возраста, пола, конституциональных особенностей, сопутствующей патологии, вида терапии и других факторов, а также модернизации диагностических и прогностических критериев, совершенствованию профилактических и терапевтических мероприятий у больных с СД1 и начальными стадиями ХБП.

- Дедов И. И., Шестакова М. В., Викулова О. К., Железнякова А. В., Исаков М. А., Сазонова Д. В., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. Сахарный диабет. 2023; 26 (2): 104–23. DOI: 10.14341/DM13035.
- Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2022 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2022; 102 (5S): S1–S127. DOI: 10.1016/j.kint.2022.06.008.
- Patidar K, Deng JH, Mitchell CS, Ford Versypt AN. Cross-Domain Text Mining of Pathophysiological Processes Associated with Diabetic Kidney Disease. Int J Mol Sci. 2024; 25(8): 4503. DOI: 10.3390/ijms25084503.
- Eckardt KU, Delgado C, Heerspink HJL, Pecoits-Filho R, Ricardo AC, Stengel B, et al. Trends and perspectives for improving quality of chronic kidney disease care: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int. 2023; 104 (5): 888–903. DOI: 10.1016/j.kint.2023.05.013.
- Vyas DA, Eisenstein LG, Jones DS. Hidden in Plain Sight — Reconsidering the Use of Race Correction in Clinical Algorithms. N Engl J Med. 2020; 383 (9): 874–82. DOI: 10.1056/NEJMms2004740.
- Fan X, Yang M, Lang Y, Lu S, Kong Z, Gao Y, et al. Mitochondrial metabolic reprogramming in diabetic kidney disease. Cell Death Dis. 2024; 15: 442. DOI:10.1038/s41419-024-06833-0.
- Furman D, Campisi J, Verdin E, Carrera-Bastos P, Targ S, Franceschi C et al. Chronic inflammation in the etiology of disease across the life span. Nat Med. 2019; 25 (12): 1822–32. DOI: 10.1038/s41591-019-0675-0. PubMed PMID: 31806905.
- Rayego-Mateos S, Rodrigues-Diez RR, Fernandez-Fernandez B, Mora-Fernández C, Marchant V, Donate-Correa J, et al. Targeting inflammation to treat diabetic kidney disease: The road to 2030. Kidney Int. 2023; 103: 282–96. DOI: 10.1016/j.kint.2022.10.030.
- Varra FN, Varras M, Varra VK, Theodosis-Nobelos P. Molecular and pathophysiological relationship between obesity and chronic inflammation in the manifestation of metabolic dysfunctions and their inflammation-mediating treatment options (Review). Mol Med Rep. 2024; 29: 95. DOI: 10.3892/mmr.2024.13219.
- Xie R, Bishai DM, Lui DTW, Lee PCH, Yap DYH. Higher circulating neutrophil counts is associated with increased risk of all-cause mortality and cardiovascular disease in patients with diabetic kidney disease. Biomedicines. 2024; 12(8): 1907. DOI: 10.3390/biomedicines12081907. PubMed PMID: 39200371.
- Сахарный диабет 1 типа у взрослых: клинические рекомендации. Рубрикатор клинических рекомендаций [Электронный ресурс]. 2022 [дата доступа: 2024 октябрь 21]. Режим доступа: https://cr.minzdrav.gov.ru/recomend/286_2.
- Хроническая болезнь почек (ХБП): клинические рекомендации. Рубрикатор клинических рекомендаций [Электронный ресурс]. 2021 [дата доступа: 2024 октябрь 21]. Режим доступа: https://cr.minzdrav.gov.ru/schema/469_2.
- Островский В. К., Мащенко А. В., Янголенко Д. В. и др. Показатели крови и лейкоцитарного индекса интоксикации в оценке тяжести и определении прогноза при воспалительных, гнойных и гнойно-деструктивных заболеваниях. Клин. лаб. диагностика. 2006; 6: 50–3.
- Камышников В. С. Клинико-биохимическая лабораторная диагностика. Минск: Изд-во «Интерпрессервис», 2003; 495 с.
- Tonneijck L, Muskiet MH, Smits MM, van Bommel EJ, Heerspink HJ, van Raalte DH, Joles JA. Glomerular Hyperfiltration in Diabetes: Mechanisms, Clinical Significance, and Treatment. J Am Soc Nephrol. 2017; 28 (4): 1023–39. DOI: 10.1681/ASN.2016060666.
- Kanbay M, Copur S, Guldan M, Ozbek L, Hatipoglu A, Covic A, Mallamaci F, Zoccali C. Proximal tubule hypertrophy and hyperfunction: a novel pathophysiological feature in disease states. Clin Kidney J. 2024; 17 (7): sfae195. DOI: 10.1093/ckj/sfae195.
- Jin L, Wang X, Liu Y, Xiang Q, Huang R. High levels of blood glycemic indicators are associated with chronic kidney disease prevalence in non-diabetic adults: Cross-sectional data from the national health and nutrition examination survey 2005–2016. J Clin Transl Endocrinol. 2024; 36: 100347. DOI: 10.1016/j.jcte.2024.100347.
- Rayego-Mateos S, Morgado-Pascual JL, Opazo-Ríos L, Guerrero-Hue M, Garcia-Caballero C, Vazquez-Carballo C, et al. Pathogenic pathways and therapeutic approaches targeting inflammation in diabetic nephropathy. Int J Mol Sci. 2020; 21 (11): 3798. DOI: 10.3390/ijms21113798.
- Shirakawa K, Sano M. Neutrophils and neutrophil extracellular traps in cardiovascular disease: an overview and potential therapeutic approaches. Biomedicines. 2022; 10: 1850. DOI: 10.3390/biomedicines10081850.
- Zhang R, Chen J, Xiong Y, Wang L, Huang X, Sun T, et al. Increased neutrophil count Is associated with the development of chronic kidney disease in patients with diabetes. J Diabetes. 2022; 14: 442–54. DOI: 10.1111/1753-0407.13292.
- Zeng G, Lin Y, Xie P, Lin J, He Y, Wei J. Relationship of the Neutrophil-Lymphocyte Ratio with All-Cause and Cardiovascular Mortality in Patients with Diabetic Kidney Disease: A Prospective Cohort Study of NHANES Study. J Multidiscip Healthc. 2024; 17: 2461–73. DOI: 10.2147/JMDH.S465317. PubMed PMID: 38799017.
- Wan H, Wang Y, Fang S, Chen Y, Zhang W, Xia F, et al. Associations between the neutrophil-to-lymphocyte ratio and diabetic complications in adults with dabetes: a cross-sectional study. J Diabetes Res. 2020; 2020: 1–9. DOI: 10.1155/2020/6219545
- Gao JL, Shen J, Yang LP, Liu L, Zhao K, Pan XR, et al. Neutrophil-to-lymphocyte ratio associated with renal function in type 2 diabetic patients. World J Clin Cases. 2024; 12 (14): 2308–15. DOI: 10.12998/wjcc.v12.i14.2308. PubMed PMID: 38765748.
- Ko HL, Jung J, Lee J, Lim JH, Im DW, Kim YC, et al. Dynamic nature and prognostic value of the neutrophil-to-lymphocyte ratio in critically ill patients with acute kidney injury on continuous renal replacement therapy: A multicenter cohort study. Front Med (Lausanne). 2023; 10: 1162381. DOI: 10.3389/fmed.2023.1162381.
- Karava V, Kondou A, Dotis J, Taparkou A, Farmaki E, Kollios K, et al. Exploring systemic inflammation in children with chronic kidney disease: correlates of interleukin 6. Pediatr Nephrol. 2024; 39: 1567–76. DOI:10.1007/s00467-023-06234-z.
- Liu J, Liu X, Li Y, Quan J, Wei S, An S, et al. The association of neutrophil to lymphocyte ratio, mean platelet volume, and platelet distribution width with diabetic retinopathy and nephropathy: a meta-analysis. Biosci Rep. 2018; 38: 2–19. DOI: 10.1042/BSR20180172.
- Lau LFS, Ng JK, Fung WWS, Chan GCK, Mei-Shan Cheng, Chow KM, et al. Relationship between serial serum neutrophil-lymphocyte ratio, cardiovascular mortality, and all-cause mortality in Chinese peritoneal dialysis patients. Kidney Blood Press Res. 2023; 48 (1): 414–23. DOI: 10.1159/000530554
- Messias BA, Botelho RV, Saad SS, Mocchetti ER, Turke KC, Waisberg J. Serum C-reactive protein is a useful marker to exclude anastomotic leakage after colorectal surgery. Sci Rep. 2020; 10 (1): 1687. DOI: 10.1038/s41598-020-58780-3.
- Zhang L, Li W, Gong M, Zhang Z, Xue X, Mao J et al. C-reactive protein inhibits C3a/C3aR-dependent podocyte autophagy in favor of diabetic kidney disease. FASEB J. 2022; 36(6): e22332. DOI: 10.1096/fj.202200198R. PubMed PMID: 35503088.
- Wang Y, Guo J, Shao B, Chen H, Lan H. The Role of TGF-β1/ SMAD in diabetic nephropathy: mechanisms and research development. Sichuan Da Xue Xue Bao Yi Xue Ban. 2023; 54 (6): 1065–73. Chinese. DOI: 10.12182/20231160108. PubMed PMID: 38162063.
- Zhang L, Shen ZY, Wang K, Li W, Shi JM, Osoro EK, et al. C-reactive protein exacerbates epithelial-mesenchymal transition through Wnt/β-catenin and ERK signaling in streptozocin-induced diabetic nephropathy. FASEB J. 2019; 33 (5): 6551–63. DOI: 10.1096/fj.201801865RR. PubMed PMID: 30794428.
- Li J, Chen J, Lan HY, Tang Y. Role of C-Reactive protein in Kidney Diseases. Kidney Dis (Basel). 2022; 9 (2): 73–81. DOI: 10.1159/000528693. PubMed PMID: 37065607.
- Geng T, Zhu K, Lu Q, Wan Z, Chen X, Liu L, et al. Healthy lifestyle behaviors, mediating biomarkers, and risk of microvascular complications among individuals with type 2 diabetes: A cohort study. PLoS Med. 2023; 20 (1): e1004135. DOI: 10.1371/journal.pmed.1004135. PubMed PMID: 36626356.
- Tang M, Cao H, Wei XH, Zhen Q, Liu F, Wang YF, et al. Association between high-sensitivity C-Reactive protein and Diabetic Kidney Disease in patients with type 2 diabetes mellitus. Front Endocrinol (Lausanne). 2022; 13: 885516. DOI: 10.3389/fendo.2022.885516. PubMed PMID: 35784528.
- Lin CC, Li CI, Liu CS, Liao LN, Yang CW, Lin CH, et al. Association of high-sensitivity C-reactive protein and diabetic nephropathy in patients with type 2 diabetes: a Mendelian randomization study. BMJ Open Diabetes Res Care. 2023; 11 (1): e003197. DOI: 10.1136/bmjdrc-2022-003197. PubMed PMID: 36828641.
- Aktas G. Serum C-reactive protein to albumin ratio as a reliable marker of diabetic neuropathy in type 2 diabetes mellitus. Biomol Biomed. 2024; 24 (5): 1380–6. DOI: 10.17305/bb.2024.10426. PubMed PMID: 38635449.
- Kumari S, Singh B. Assessment of correlation of serum high-sensitive C-Reactive protein, urinary albumin-to-creatinine ratio, and lipid profile in diabetics. J Pharm Bioallied Sci. 2021; 13 (2): S1569–S1572. DOI: 10.4103/jpbs.jpbs_290_21. PubMed PMID: 35018031.
- Al-Bayati MA, Jamil DA, Al-Aubaidy HA. Cardiovascular effects of copper deficiency on activity of superoxide dismutase in diabetic nephropathy. N Am J Med Sci. 2015; 7(2): 41–6.
- Lee MJ, Jung CH, Kang YM, Jang JE, Leem J, Park JY, et al. Serum ceruloplasmin level as a predictor for the progression of diabetic nephropathy in korean men with type 2 diabetes mellitus. Diabetes Metab J. 2015; 39 (3): 230–9. DOI: 10.4093/dmj.2015.39.3.230. PubMed PMID: 26124993.
- de Paula Silva L, de Moraes Rego FG, Picheth G, Müller-Santos M, Alberton D. Prospection of plasma proteins as biomarkers for diabetes mellitus monitoring. J Diabetes Metab Disord. 2021; 20 (1): 611–20. DOI: 10.1007/s40200-021-00788-1. PubMed PMID: 34222081.
- Wang S, Lu Z, Wang Y, Zhang T, He X. Metalloproteins and apolipoprotein C: candidate plasma biomarkers of T2DM screened by comparative proteomics and lipidomics in ZDF rats. Nutr Metab (Lond). 2020; 17: 66. DOI: 10.1186/s12986-020-00488-2. PubMed PMID: 32817751.
- Swaminathan SM, Rao IR, Shenoy SV, Prabhu AR, Mohan PB, Rangaswamy D, et al. Novel biomarkers for prognosticating diabetic kidney disease progression. Int Urol Nephrol. 2023; 55 (4): 913–28. DOI: 10.1007/s11255-022-03354-7. PubMed PMID: 36271990.
- Jung CY, Yoo TH. Pathophysiologic Mechanisms and Potential Biomarkers in Diabetic Kidney Disease. Diabetes Metab J. 2022; 46 (2): 181–97. DOI: 10.4093/dmj.2021.0329.