ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Оценка эффективности этиотропной терапии линезолидом и бактериофагом на мышиной модели стафилококковой инфекции
1 Федеральный научно-клинический центр физико-химической медицины имени Ю. М. Лопухина Федерального медико-биологического агентства, Москва, Россия
2 Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора, Оболенск, Россия
Staphylococcus aureus — возбудитель широкого спектра инфекций, включая тяжелые системные заболевания, и часто характеризуется множественной лекарственной устойчивостью. В условиях растущей антибиотикорезистентности перспективным методом лечения стафилококковых инфекций является применение бактериофагов, особенно в сочетании с антибиотиками. Целью работы было оценить синергетический эффект линезолида и бактериофага vB_SauM-515A1 при лечении системной инфекции у мышей BALB/c. С использованием 36 животных были подобраны оптимальный способ введения и инфицирующая доза микроорганизма (внутривенно 5 × 108 КОЕ/мышь), а также установлены пороговые концентрации антимикробных агентов при монотерапии. Оценку проводили по результатам исследования обсемененности внутренних органов (почки, селезенка) и крови. Для оценки комбинированного эффекта этиотропного действия линезолида (10 мг/кг массы животного) и фага (2 × 107 БОЕ/мышь) эксперимент проводили на контрольной и экспериментальных группах (по 12 особей в группе), получавших внутрибрюшинно монотерапию и комбинированное лечение через 2, 8, 18, 24 ч после заражения. Комбинированная терапия продемонстрировала более выраженный эффект: снижение бактериальной нагрузки в почках на два–три порядка по сравнению с монотерапией в первые сутки терапии. Таким образом, совместное использование линезолида и бактериофагов перспективно для лечения инфекций, вызванных S. aureus, и может повысить эффективность лечения и снизить риск побочных эффектов применения высоких доз антибиотиков.
Ключевые слова: множественная лекарственная устойчивость, Staphylococcus aureus, фаговая терапия, бактериофаги, мышиные модели, линезолид, комбинированная терапия, синергизм антибиотиков и бактериофагов, синергизм
Финансирование: исследование выполнено за счет гранта Российского научного фонда № 22-15-00443, https://rscf.ru/project/22-15-00443/
Вклад авторов: М. А. Корниенко, В. В. Кузин — план исследований, набор и обработка данных, написание статьи; Н. К. Абдраймова — набор и обработка данных, Р. Б. Городничев — план исследований, набор и обработка данных; Е. А. Шитиков — план исследований, обработка данных, написание статьи.
Соблюдение этических стандартов: исследование одобрено этическим комитетом ФБУН ГНЦ ПМБ (ветеринарный протокол № 3-2024 от 10 июня 2024 г.), выполнено в соответствии с требованиями Федерального закона от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств»; Приказа Минздравсоцразвития России от 23.08.2010 № 708Н «Об утверждении правил лабораторной практики»; СанПиН 3.3686-21 «Санитарно- эпидемиологические требования по профилактике инфекционных болезней».
Для корреспонденции: Мария Андреевна Корниенко
ул. Малая Пироговская, д. 1а, г. Москва, 119435, Россия; moc.liamg@ayiramokneinrok
Staphylococcus aureus является ведущим возбудителем как госпитальных, так и внебольничных инфекций, вызывая широкий спектр заболеваний [1, 2]. По данным за 2019 г., S. aureus стал причиной более 1 млн смертей во всем мире, что в значительной мере связано с антибиотикорезистентностью штаммов этого вида [3]. Наибольшее клиническое значение имеют метициллин- устойчивые штаммы S. aureus (MRSA), которые не восприимчивы к бета-лактамным антибиотикам и часто обладают множественной лекарственной устойчивостью (МЛУ) [2].
В последнее время вирулентные бактериофаги, или фаги, привлекают интерес как средство лечения инфекций, вызванных устойчивыми бактериями [4]. Одним из наиболее перспективных направлений использования фагов является их комбинированное применение с антибиотиками. Такой подход позволяет повысить эффективность этиотропного лечения, снизить дозу антибиотиков, минимизировать их побочные эффекты и уменьшить вероятность развития устойчивости у патогенов за счет взаимодополняющих эффектов антимикробных агентов [4]. Выделяют два типа таких эффектов: аддитивный эффект и синергизм. Аддитивный эффект определяется как совокупное действие препаратов, равное сумме их раздельных эффектов. Синергизм — это усиление антимикробного эффекта, которое превышает аддитивное действие. Однако возможен и антагонизм, при котором активность препаратов в сочетании ниже, чем при раздельном использовании [5, 6].
Исследования in vitro показали, что комбинированное использование стафилофагов с большинством антибиотиков приводит преимущественно к синергизму [4]. Особую актуальность представляют исследования комбинированного использования линезолида и стафилофагов семейства Herelleviridae. Фаги этого семейства отличаются широким литическим спектром, что делает их перспективными для терапевтических целей [7–9]. Линезолид относится к препаратам для терапии стафилококковых инфекций, в частности характеризующимся устойчивостью к ванкомицину [10].
Механизм действия линезолида основан на ингибировании синтеза белка за счет нарушения формирования функционально активного комплекса для инициации трансляции [10]. Однако его применение связано с рядом ограничений. Так, при длительной терапии антибиотик может вызывать серьезные побочные эффекты [11]. Кроме того, использование линезолида против микроорганизмов, для подавления роста которых требуется концентрация препарата 4 мкг/мл и выше, может приводить к снижению клинической эффективности [10], что связано с особенностями его введения и возможными колебаниями концентрации в плазме крови [12]. Таким образом, комбинированная терапия линезолидом и стафилофагами способна повысить эффективность лечения и снизить риск побочных эффектов благодаря уменьшению дозы антибиотика, что делает этот подход перспективным для клинической практики.
Синергетический эффект комбинации линезолида и бактериофагов семейства Herelleviridae был ранее продемонстрирован in vitro в нашей [13] и других работах [14, 15]. Взаимодополняющее действие также было подтверждено на моделях стафилококковой инфекции у мышей [16–18]. Тем не менее наличие антагонистического эффекта описано для фагов и линезолида в нескольких исследованиях [19, 20] и, вероятно, связано с концентрацией антибиотика, а также в случае биопленок с последовательностью обработки агентами.
Целью настоящего исследования было расширение ранее полученных данных о синергизме линезолида и бактериофага vB_SauM-515A1 (семейство Herelleviridae) [13] за счет оценки раздельного и комбинированного действия линезолида и бактериофага при лечении системной стафилококковой инфекции у мышей линии BALB/с. Полученные данные могут стать ключевыми для оптимизации комбинированной терапии инфекций, вызванных MRSA, и способствовать повышению ее эффективности в клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы, фаги, условия хранения и культивирования
В исследовании использовали ранее описанный штамм S. aureus SA413 из коллекции Федерального государственного бюджетного учреждения «Федерального научно-клинического центра физико-химической медицины имени академика Ю. М. Лопухина Федерального медико-биологического агентства». Штамм был выделен из гнойного отделяемого мягких тканей и относился к метициллин-чувствительным S. aureus сиквенс-типа 8; минимальная подавляющая концентрация линезолида для него составляла 8 мкг/мл. Выбор штамма для исследования обусловлен ранее продемонстрированным in vitro синергетическим эффектом бактериофага и линезолида, наблюдаемым при воздействии на данную бактериальную культуру [13]. Культивирование штамма проводили на питательной среде «Мясо-пептонный агар» (МПА) (ФБУН ГНЦ ПМБ, Оболенск, Россия).
Бактериофаг vB_SauM-515A1 был ранее выделен из коммерческого фагового препарата «Бактериофаг стафилококковый» серии P332 («Микроген»; Россия). Детальная характеристика фага представлена ранее. Бактериофаг наращивали на штамме S. aureus SA413 в среде LB (от англ. lysogeny broth) в модификации Миллера (Oxoid; Великобритания) при температуре 37 °С. Затем фаговый лизат пропускали через шприцевой фильтр 0,22 мкм с гидрофильной полиэфирсульфоновой мембраной (Millipore; США) и очищали методом ультрацентрифугирования в градиенте сахарозы, как описано ранее [7]. После очистки бактериофаг растворяли в физиологическом растворе. Титр бактериофага в препарате оценивали на основании стандартной методики титрования по Грациа [22]. Препарат бактериофага хранился при температуре 4 °C.
Животные
В качестве модельных животных использовали самок мышей линии BALB/c массой 18–22 г, возрастом 6–8 недель, полученных из питомника лабораторных животных ФГБУН «Научный центр биомедицинских технологий федерального медико-биологического агентства» филиал «Столбовая» (Сертификат серии № 20353 от 30.05.2024). Мышей содержали группами в стандартных условиях в соответствии с международными нормами и требованиями, с обеспечением свободного доступа к воде и корму («Лабораторкорм»; Россия). Эвтаназию проводили методом СО2-ингаляции.
У павших мышей исследовали паренхиматозные органы (селезенку, печень) на наличие стафилококковой инфекции способом отпечатков на поверхность плотной питательной среды «Стафилококкагар» (ФБУН ГНЦ ПМБ; Россия).
Моделирование стафилококковой инфекции у мышей
Для моделирования стафилококковой инфекции тестировали различные инфицирующие дозы штамма S. aureus SA413 и два типа введения: внутривенный и внутрибрюшинный. Бактериальный инокулят выращивали в жидкой питательной среде до оптической плотности OD620 = 0,75 (5 × 109 КОЕ/мл) и разводили физиологическим раствором до нужной концентрации. Животные были разделены на шесть групп (по три мыши): группа 1 — внутривенное введение 5 × 106 КОЕ/мышь; группа 2 — внутривенное введение 5 × 107 КОЕ/мышь; группа 3 — внутривенное введение 5 × 108 КОЕ/мышь; группа 4 — внутрибрюшинное введение 5 × 106 КОЕ/мышь; группа 5 — внутрибрюшинное введение 5 × 107 КОЕ/мышь; группа 6 — внутрибрюшинное введение 5 × 108 КОЕ/мышь. Инокулят вводили в объеме 200 мкл (внутрибрюшинно) и 100 мкл (внутривенно). Животных наблюдали в течение трех суток для учета летальных случаев. На третий день у выживших животных оценивали бактериальную обсемененность паренхиматозных органов и крови.
Подбор доз антимикробных агентов
Для оценки терапевтических и минимальных пороговых доз линезолида и бактериофага vB_SauM-515A1 мышей разделили на 6 групп (по три мыши). Через 2, 8, 18 и 24 ч после инфицирования мышам вводили либо линезолид (Sigma- Aldrich; США) в концентрациях 10 мг/кг массы животного или 40 мг/кг массы животного, либо бактериофаг vB_SauM-515A1 в дозах 2 × 105, 2 × 106 и 2 × 107 БОЕ/мышь. Для получения препаратов необходимых концентраций использовали физиологический раствор. Контрольным животным без лечения вводили физиологический раствор по вышеуказанной схеме. Препараты вводили внутрибрюшинно в объеме 200 мкл. Животных наблюдали в течение трех суток, после чего проводили эвтаназию и забор паренхиматозных органов (селезенка, почки) и крови для оценки бактериальной обсемененности и содержания фага. Кровь (1 мл) извлекали методом пункции из сердца. Отобранную кровь перемещали в стерильные вакуумные пробирки с натрия гепарином (без геля) (Improvacuter; Китай), предназначенные для исследования плазмы крови.
Оценка эффективности комбинированного воздействия линезолида и бактериофага
Для оценки эффективности комбинированного воздействия антибактериальные агенты использовали в минимальных пороговых дозах. Исследование проводили на четырех экспериментальных группах животных (по 12 мышей), инфицированных штаммом S. aureus SA413 в дозе и способом, выбранным по результатам предварительных экспериментов. Животные получали препараты через 2, 8, 18 и 24 ч после заражения внутрибрюшинно в объеме 200 мкл в случае монотерапии; при комбинированной терапии — сначала антибиотик в объеме 200 мкл в одну сторону брюшины, затем сразу фаг в объеме 200 мкл в другую сторону брюшины. Первой группе мышей проводили терапию линезолидом; второй группе — терапию бактериофагом; третьей группе — комбинированную терапию бактериофагом и линезолидом; четвертой группе, контрольной, проводили инъекции физиологического раствора. В дальнейшем осуществляли эвтаназию трем мышам из каждой группы на первые и вторые сутки и шести мышам — на третьи сутки для анализа бактериальной обсемененности и содержания фага в органах и крови.
Оценка бактериальной обсемененности и наличия бактериофагов в паренхиматозных органах и крови
Органы гомогенизировали в стерильных ступках, добавляя 1 мл физиологического раствора на орган. Далее кровь и образцы суспензий десятикратно разводили в физиологическом растворе и высевали на плотную питательную среду «Стафилококкагар» (ФБУН ГНЦ ПМБ; Россия). Параллельно в суспензиях оценивали содержание бактериофага методом титрования по Грациа на среде «Стафилококкагар» (ФБУН ГНЦ ПМБ) с использованием 100 мкл серийных разведений образца. Исследование проводили в пяти технических повторах.
Представление данных и статистический анализ
Статистический анализ выполняли с помощью программного обеспечения Prism (GraphPad Software 8; США): нормальность распределения данных подтверждали на основании критерия Шапиро–Уилка, для сравнения средних значений между группами использовали t-тест Стьюдента. Различия считали значимыми при р < 0,05.
Заявление о соблюдении этических стандартов
Все эксперименты с лабораторными животными были одобрены комиссией по биоэтике ФБУН ГНЦ ПМБ и проведены в соответствии с «Руководством по уходу и использованию лабораторных животных» («Guide for the Care and Use of Laboratory Animals») [23].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Отработка модели стафилококковой инфекции
Для построения адекватной модели стафилококковой инфекции на лабораторных животных были проведены предварительные исследования по подбору заражающей дозы, обеспечивающей обсемененность паренхиматозных органов (селезенки, почек) и крови штаммом S. aureus SA413 на третьи сутки после заражения без гибели животных от бактериальной инфекции.
Согласно результатам, при внутрибрюшинном введении бактерий в дозе 5 × 108 КОЕ/мышь происходила гибель всех животных уже на первые сутки после заражения, что, предположительно, связано с высокой концентрацией исследуемого штамма в области введения и последующим токсическим шоком. При внутрибрюшинном введении бактериальной культуры в концентрациях 5 × 106 и 5 × 107 КОЕ/мышь, а также при внутривенном введении в любых исследуемых концентрациях гибели мышей не наблюдалось в течение трех суток после инфицирования. При этом только мыши, получившие дозу 5 × 108 КОЕ/мышь внутривенно, демонстрировали угнетенное состояние (снижение двигательной активности и сонливость), взъерошенную шерсть и гиперемию век, что указывает на развитие инфекционного процесса.
Патологоанатомическое вскрытие мышей на третьи сутки показало наличие стафилококков в почках (8,9 × 105 – 3,6 × 106 КОЕ/орган/мл) и небольшое количество возбудителя в селезенках (37 – 52 КОЕ/орган/мл) и крови (3,4 × 102 – 1,3 × 103 КОЕ/мл) при внутривенном заражении в дозе 5 × 108 КОЕ/мышь. При более низких дозах в обоих способах заражения наблюдали отсутствие или единичные бактериальные колонии.
Определение минимальных пороговых и терапевтических доз линезолида и бактериофага для лечения стафилококковой инфекции
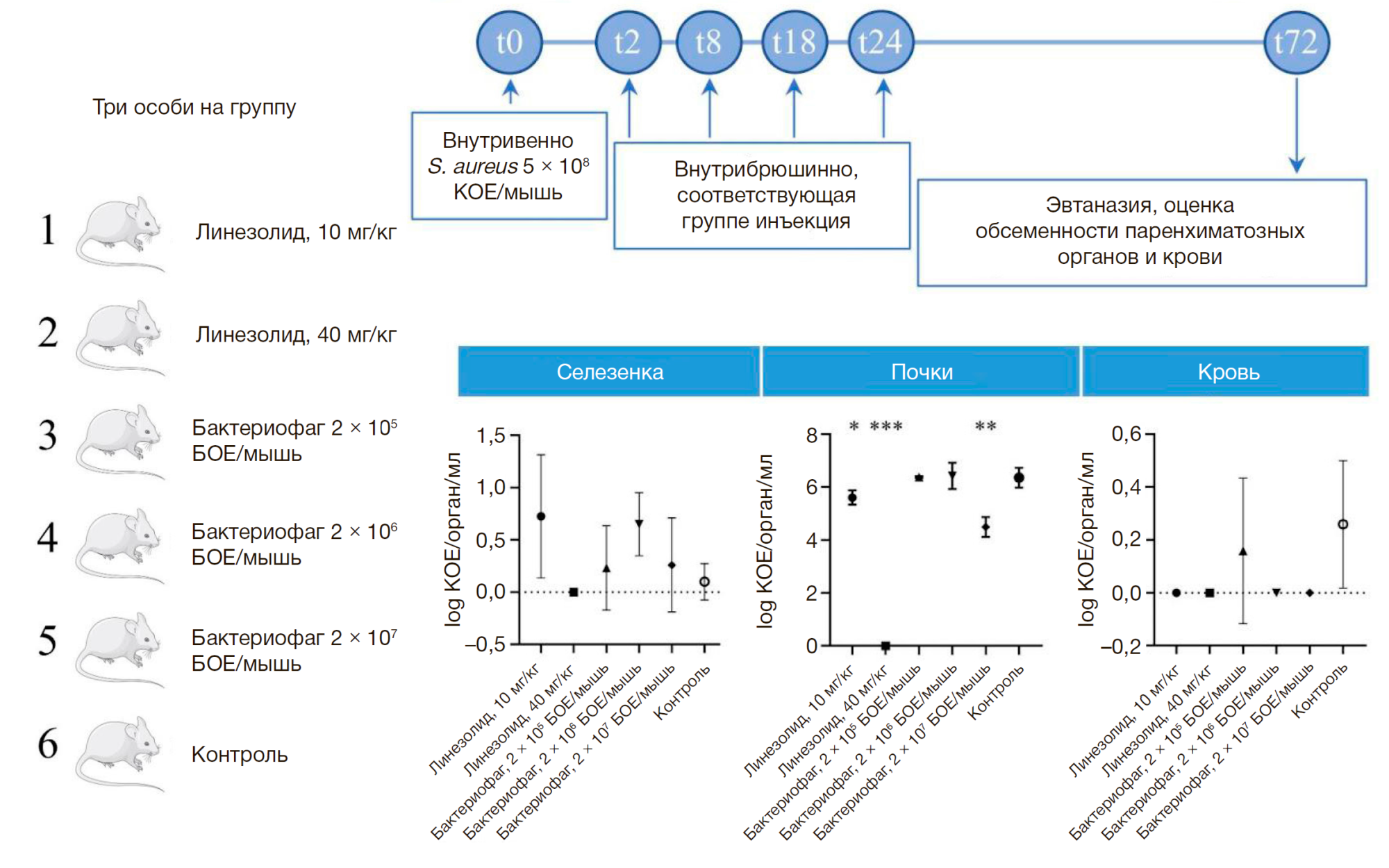
Оценка минимальных пороговых и терапевтических доз антимикробных агентов проведена для двух концентраций линезолида и трех вариантов доз бактериофага с использованием 18 мышей (рис. 1).
Визуальный осмотр показал угнетенное состояние, взъерошенную шерсть и гиперемию век у мышей в контрольной и четырех из пяти опытных групп (линезолид 10 мг/кг массы животного и все дозы бактериофага). Гибели животных на протяжении всего времени эксперимента не происходило. Животные, получавшие лечение линезолидом в дозе 40 мг/кг массы животного, вышеуказанных признаков не имели.
Патологоанатомическое вскрытие на третьи сутки выявило низкую обсемененность селезенок (0–25 КОЕ/орган/мл) во всех группах и отсутствие бактерий в крови, за исключением контрольной группы (0–3 КОЕ/мл) и группы, получавшей бактериофаг 2 × 105 БОЕ/мышь. Наиболее показательными были данные по обсемененности почек. Доза линезолида 40 мг/кг массы животного обеспечивала элиминацию патогена из почек и являлась, по всей видимости, терапевтической. Доза 10 мг/кг массы животного приводила к снижению обсемененности на один порядок, что определяло ее как пороговую. Дозы бактериофага 2 × 105 и 2 × 106 БОЕ/мышь не показали значимых различий по сравнению с контролем и были приняты за неэффективные. Бактериофаг в дозе 2 × 107 БОЕ/мышь снижал обсемененность почек на один порядок и был признан минимальной пороговой дозой; терапевтическая доза выявлена не была.
Фаговые частицы удалось обнаружить только в почках мышей, получавших дозу 2 × 107 БОЕ/мышь (30–70 БОЕ/ орган). В крови и селезенках животных бактериофагов выявлено не было.
Оценка эффективности комбинированного воздействия линезолида и бактериофага
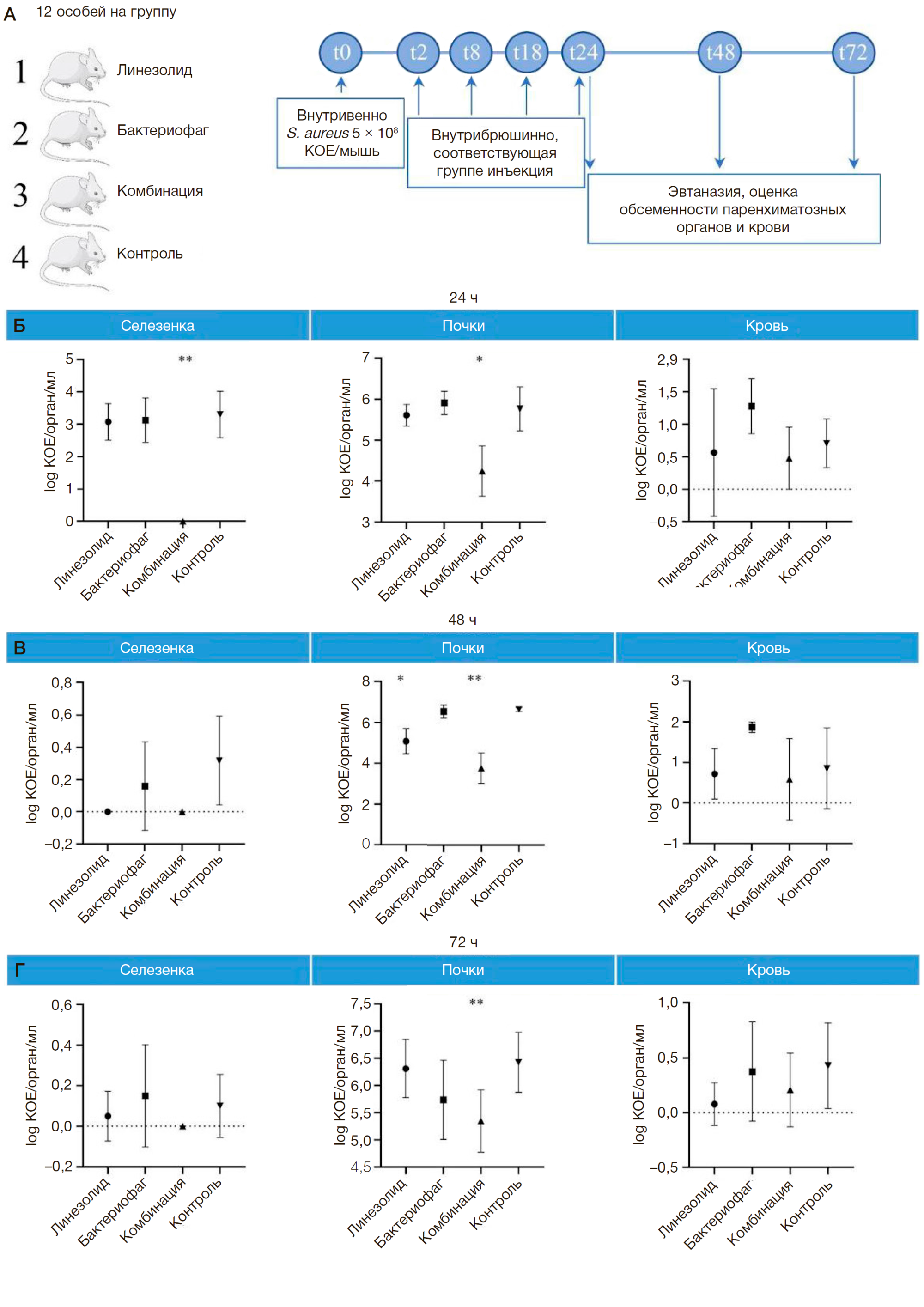
Оценка комбинированного воздействия антимикробных агентов в пороговых концентрациях (линезолид: 10 мг/кг массы животного; бактериофаг: 2 × 107 БОЕ/мышь) проведена с использованием 48 мышей (рис. 2).
По визуальным показателям состояние животных во всех группах свидетельствовало о наличии инфекционного процесса и характеризовалось описанным в предыдущем эксперименте угнетенным состоянием.
На первые сутки не было выявлено различий в обсемененности паренхиматозных органов между группами, получившими монотерапию, и контрольной группой (рис. 2Б). В группе с комбинированной терапией отмечено снижение обсемененности селезенок практически до нулевых значений (p = 0,0014) и снижение обсемененности почек на один-два порядка по сравнению с контролем (p = 0,0318), тогда как обсемененность крови сохранялась на уровне контрольной группы.
Результаты, полученные на вторые сутки, представлены на рис. 2В. В селезенках животных всех групп, кроме получавших линезолид, наблюдалось незначительное присутствие стафилококков. В группе с линезолидом бактерии в селезенках отсутствовали. Обсемененность почек в группе лечения бактериофагом оставалась на уровне контрольной группы, в группе с антибиотиком достоверно снизилась менее чем на порядок (p = 0,0127), а при комбинированной терапии она снижалась на два-три порядка относительно контроля (p = 0,0028). Обсемененность крови во всех группах сохранялась на уровне до 102 КОЕ/мл.
На третьи сутки после заражения отмечалось лишь незначительное присутствие стафилококков в посевах из гомогенатов селезенок во всех исследуемых группах, что говорит о самостоятельной элиминации патогена из данного органа (рис. 2Г). Обсемененность почек мышей, получавших лечение линезолидом, вернулась к показателям контрольной группы, тогда как у мышей, пролеченных бактериофагом, оставалась на уровне контроля. В случае комплексного лечения линезолидом и бактериофагом обсемененность оказалась на порядок ниже контрольных значений (p = 0,0079). Обсемененность крови во всех группах сохранялась на уровне контрольной.
Определение содержания бактериофага показало его незначительное присутствие в ходе всего эксперимента (20–250 БОЕ/орган/мл) в почках животных, получавших дозу 2 × 107 БОЕ/мышь как в виде монотерапии, так и в случае комбинированного применения. Достоверных различий между группами выявлено не было. В селезенках и крови бактериофаг не обнаружен.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Комплексная терапия бактериофагами и антибиотиками представляется одним из наиболее перспективных решений для борьбы с патогенами с МЛУ. Многочисленные in vitro исследования показывают многообещающие результаты, демонстрируя синергетический эффект этих агентов. Однако для подтверждения их эффективности и практического потенциала важно проведение in vivo экспериментов. Исследования на животных моделях позволяют оценить возможности и ограничения такой терапии в условиях, приближенных к клинической практике, и дают возможность выявить аспекты, которые требуют дальнейшего изучения перед полноценным внедрением в медицину.
Для оценки эффективности совместного использования бактериофага vB_SauM-515A1 и линезолида была выбрана модель системной инфекции с использованием мышей BALB/c, что соответствует подходам, применяемым в аналогичных исследованиях [24, 25]. При этом основное внимание в предварительных экспериментах уделялось выбору метода введения, подбору инфицирующей дозы и установлению пороговых концентраций действующих агентов. В ранее опубликованных работах было показано, что инфицирующая доза S. aureus меняется в зависимости от штамма в пределах от 106 до 108 КОЕ/мышь [24, 26, 27]. Например, доза 106 КОЕ/мышь была выбрана для штамма USA300, известного своей высокой вирулентностью, наблюдение в данном случае ограничивалось периодом в 24 ч [28]. В то же время доза 108 КОЕ/мышь, применяемая в исследованиях на штаммах с МЛУ, приводила к частичной гибели мышей в течение 10–24 ч и, в отдельных случаях, к третьим суткам [24, 27]. В нашем исследовании для штамма SA413, относящегося к сиквенс-типу 8 — одному из наиболее распространенных и ассоциированных с госпитальными инфекциями по всему миру, — оптимальной была выбрана доза 5 × 108 КОЕ/мышь при внутривенном введении. Соответствующая доза позволяла достичь стабильной обсемененности органов по истечении трех суток, что обеспечивало адекватные условия для наблюдения за эффектами от терапии. При этом именно внутривенное введение показало наиболее воспроизводимые результаты, что также согласуется с данными других авторов [27, 29].
Выбор пороговых концентраций антимикробных агентов, не вызывающих при монотерапии элиминации патогена, продемонстрировал, что линезолид в концентрации 10 мг/кг массы животного является наиболее подходящим для дальнейших исследований. Соответствующая концентрация антибиотика обеспечивала минимальное снижение бактериальной обсемененности, что также согласуется с результатами, полученными другими исследователями [10]. В то же время концентрация 40 мг/кг массы животного полностью устраняла бактерии из почек к третьему дню эксперимента, что также подтверждается данными других авторов [29]. Следует отметить, что линезолид и бактериофаг вводили внутрибрюшинно, чтобы избежать повреждения сосудов и риска кровоизлияний, связанных с повторными инъекциями. В частности, эффективность внутрибрюшинного введения бактериофагов ранее была продемонстрирована при стафилококковой инфекции у мышей К-подобным фагом ɸSA039 [30].
Согласно опубликованным данным по терапевтическому использованию бактериофагов на мышиных моделях, количество антимикробного агента меняется от 106 до 1010 БОЕ/мышь [27, 31]. В рамках нашего исследования минимальная пороговая доза бактериофага составила 2 × 107 БОЕ/мышь. При терапии инфицированных мышей этой дозой наблюдалось лишь частичное снижение обсемененности почек, что подчеркивает необходимость использования высоких концентраций бактериофагов при монотерапии. Более того, отсутствие фагов в крови и селезенке указывает на возможные ограничения системного распространения фагов, что еще раз подчеркивает необходимость применения комплексного подхода в терапии.
Комбинированное применение линезолида и бактериофага в пороговых дозах продемонстрировало более выраженный эффект по сравнению с монотерапией: уменьшение обсемененности почек на два-три порядка по сравнению с контролем в первые сутки подтверждает потенциальную синергию антимикробных агентов. В то же время к третьим суткам снижение бактериальной обсемененности в группе комбинированного лечения было менее выраженным, чем на первых стадиях, что может свидетельствовать о необходимости более длительного курса лечения для достижения полного терапевтического эффекта.
Полученные данные о большей эффективности комбинированной терапии по сравнению с монотерапией согласуются с рядом исследований эффективности совместного применения линезолида и бактериофагов семейства Herelleviridae на моделях других типов инфекций, вызванных S. aureus. Ранее на мышиной модели стафилококковой инфекции диабетической стопы было продемонстрировано, что однократное введение фага семейства Herelleviridae приводит к сопоставимой эффективности терапии линезолидом, при этом комбинированная терапия была гораздо эффективнее в купировании всего инфекционного процесса (бактериальная нагрузка, количество поражений, активность миелопероксидазы стопы и гистопатологический анализ), а также ускорении всего процесса заживления тканей [16]. В исследовании эффективности комплексной терапии линезолида и бактериофага MR-5 (семейство Herelleviridae) на мышиной модели кожной инфекции также было показано значительное снижение бактериальной нагрузки при их совместном применении, что привело к более быстрому разрешению инфекции [17]. Кроме того, описано успешное применение комбинированного подхода в модели инфекции, вызванной S. aureus, после артропластики. Мышам имплантировали проволоку, покрытую фагом (109 БОЕ/мл) и/или линезолидом в интрамедуллярный канал бедренной кости с последующей инокуляцией MRSA. Применение комплексного покрытия при имплантации привело к снижению бактериальной адгезии и более быстрому восстановлению двигательной функции конечности [18].
ВЫВОДЫ
Проведенное исследование подтвердило перспективность комбинированной терапии линезолидом и бактериофагом vB_SauM-515A1 для лечения системных инфекций, вызванных S. aureus. Установлено, что использование пороговых доз антибиотика и бактериофага позволяет добиться значительного снижения бактериальной обсемененности паренхиматозных органов, что свидетельствует о синергетическом эффекте. Результаты демонстрируют, что комбинированная терапия более эффективна по сравнению с монотерапией, особенно на ранних стадиях эксперимента, и может способствовать снижению дозировки антибиотика, что минимизирует возможные побочные эффекты.
- Cheung GYC, Bae JS; Otto M. Pathogenicity and Virulence of Staphylococcus Aureus. Virulence 2021; 12: 547–69, DOI: 10.1080/21505594.2021.1878688.
- Guo Y, Song G, Sun M, Wang J, Wang Y. Prevalence and Therapies of Antibiotic-Resistance in Staphylococcus Aureus. Front Cell Infect Microbiol. 2020; 10: 107, DOI: 10.3389/fcimb.2020.00107.
- Ikuta KS, Swetschinski LR, Robles Aguilar G, Sharara F, Mestrovic T, et al. Global Mortality Associated with 33 Bacterial Pathogens in 2019: A Systematic Analysis for the Global Burden of Disease Study 2019. The Lancet. 2022; 400: 2221–48, DOI: 10.1016/S0140-6736(22)02185-7.
- Łusiak-Szelachowska M, Międzybrodzki R, Drulis-Kawa Z, Cater K Knežević P, Winogradow C, Amaro K, et al. Bacteriophages and Antibiotic Interactions in Clinical Practice: What We Have Learned so Far. J Biomed Sci. 2022; 29: 23, DOI: 10.1186/s12929-022-00806-1.
- Dickey J, Perrot V. Adjunct Phage Treatment Enhances the Effectiveness of Low Antibiotic Concentration against Staphylococcus Aureus Biofilms in Vitro. PLoS ONE. 2019; 14: e0209390, DOI: 10.1371/journal.pone.0209390.
- Kumaran D, Taha M, Yi Q, Ramirez-Arcos S, Diallo J-S, Carli A, et al. Does Treatment Order Matter? Investigating the Ability of Bacteriophage to Augment Antibiotic Activity against Staphylococcus Aureus Biofilms. Front Microbiol. 2018; 9: 127, DOI: 10.3389/fmicb.2018.00127.
- Kornienko M, Kuptsov N, Gorodnichev R, Bespiatykh D, Guliaev A, Letarova M, et al. Contribution of Podoviridae and Myoviridae Bacteriophages to the Effectiveness of Anti-Staphylococcal Therapeutic Cocktails. Sci Rep. 2020; 10: 18612, DOI: 10.1038/s41598-020-75637-x.
- Leskinen K, Tuomala H, Wicklund A, Horsma-Heikkinen J, Kuusela P, Skurnik M, et al. Characterization of vB_SauM-fRuSau02, a Twort-Like Bacteriophage Isolated from a Therapeutic Phage Cocktail. Viruses. 2017; 9: 258, DOI: 10.3390/v9090258.
- Abatángelo V, Peressutti Bacci N, Boncompain CA, Amadio AF, Carrasco S, Suárez CA, et al. Correction: Broad-Range Lytic Bacteriophages That Kill Staphylococcus Aureus Local Field Strains. PLoS ONE. 2017; 12: e0187387, DOI: 10.1371/journal.pone.0187387.
- Liu C, Bayer A, Cosgrove SE, Daum RS, Fridkin SK, Gorwitz RJ, et al. Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children: executive summary. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2011; 52 (3): 285–92. Available from: https://doi.org/10.1093/cid/cir034.
- Bozdogan B, Appelbaum PC. Oxazolidinones: Activity, Mode of Action, and Mechanism of Resistance. International Journal of Antimicrobial Agents. 2004; 23: 113–9. DOI: 10.1016/j.ijantimicag.2003.11.003.
- Hui L-A, Bodolea C, Vlase L, Hiriscau EI, Popa A. Linezolid Administration to Critically Ill Patients: Intermittent or Continuous Infusion? A Systematic Literature Search and Review. Antibiotics. 2022; 11: 436. DOI: 10.3390/antibiotics11040436.
- Абдраймова Н. К., Корниенко М. А. Беспятых Д. А., Купцов Н. С., Городничев Р. Б., Шитиков Е. А. Комбинированное воздействие бактериофага VB_SAUM-515A1 и антибиотиков на клинические изоляты Staphylococcus aureus. Вестник РГМУ. 2022; DOI: 10.24075/vrgmu.2022.052.
- Kaur S, Harjai K, Chhibber S. Bacteriophage Mediated Killing of Staphylococcus Aureus In Vitro on Orthopaedic K Wires in Presence of Linezolid Prevents Implant Colonization. PLoS ONE. 2014; 9: e90411. DOI:10.1371/journal.pone.0090411.
- Wang B, Xu Y, Zhao H, Wang X, Rao L, Guo Y, et al. Methicillin- Resistant Staphylococcus Aureus in China: A Multicentre Longitudinal Study and Whole-Genome Sequencing. Emerging Microbes & Infections. 2022; 11: 532–42. DOI: 10.1080/22221751.2022.2032373.
- Chhibber S, Kaur T. Sandeep Kaur Co-Therapy Using Lytic Bacteriophage and Linezolid: Effective Treatment in Eliminating Methicillin Resistant Staphylococcus Aureus (MRSA) from Diabetic Foot Infections. PLoS ONE. 2013; 8: e56022. DOI: 10.1371/journal.pone.0056022.
- Kaur S, Chhibber S. A Mouse Air Pouch Model for Evaluating the Anti-Bacterial Efficacy of Phage MR-5 in Resolving Skin and Soft Tissue Infection Induced by Methicillin-Resistant Staphylococcus Aureus. Folia Microbiol. 2021; 66: 959–72, DOI: 10.1007/s12223-021-00895-9.
- Kaur S, Harjai K, Chhibber S. In Vivo Assessment of Phage and Linezolid Based Implant Coatings for Treatment of Methicillin Resistant S. Aureus (MRSA) Mediated Orthopaedic Device Related Infections. PLoS ONE. 2016; 11: e0157626, DOI: 10.1371/journal.pone.0157626.
- Berryhill BA, Huseby DL, McCall IC, Hughes D, Levin BR. Evaluating the Potential Efficacy and Limitations of a Phage for Joint Antibiotic and Phage Therapy of Staphylococcus Aureus Infections. Proc Natl Acad Sci USA. 2021; 118, e2008007118. DOI: 10.1073/pnas.2008007118.
- Kumaran D, Taha M, Yi Q, Ramirez-Arcos S, Diallo J-S, Carli A, Abdelbary H. Does Treatment Order Matter? Investigating the Ability of Bacteriophage to Augment Antibiotic Activity against Staphylococcus Aureus Biofilms. Front Microbiol. 2018; 9: 127. DOI: 10.3389/fmicb.2018.00127.
- Kornienko M, Fisunov G, Bespiatykh D, Kuptsov N, Gorodnichev R, Klimina K, et al. Transcriptional Landscape of Staphylococcus Aureus Kayvirus Bacteriophage vB_SauM-515A1. Viruses. 2020; 12: 1320. DOI: 10.3390/v12111320.
- Mazzocco A, Waddell TE, Lingohr E, Johnson RP. Enumeration of Bacteriophages Using the Small Drop Plaque Assay System. In: Clokie MRJ, Kropinski AM, editors. Bacteriophages. Methods in Molecular Biology. Humana Press: Totowa, NJ. 2009; p. 81–85.
- Guide for the Care and Use of Laboratory Animals. National Academies Press: Washington, D.C., 2011.
- García P, Moscoso M, Fernández MC, Fuentes-Valverde V, Pérez A, Bou G. Comparison of the in Vivo Efficacy of Ceftaroline Fosamil, Vancomycin and Daptomycin in a Murine Model of Methicillin-Resistant Staphylococcus Aureus Bacteraemia. International Journal of Antimicrobial Agents. 2023; 62: 106836. DOI: 10.1016/j.ijantimicag.2023.106836.
- Suligoy CM, Díaz RE, Gehrke A-K, Ring N, Yebra G, Alves J, et al. Acapsular Staphylococcus Aureus with a Non-Functional Agr Regains Capsule Expression after Passage through the Bloodstream in a Bacteremia Mouse Model. Sci Rep. 2020; 10: 14108 DOI: 10.1038/s41598-020-70671-1.
- Kim HK, Missiakas D, Schneewind O. Mouse Models for Infectious Diseases Caused by Staphylococcus Aureus. Journal of Immunological Methods. 2014; 410: 88–99, DOI: 10.1016/j.jim.2014.04.007.
- Oduor JMO, Onkoba N, Maloba F, Arodi WO, Nyachieo A. Efficacy of Lytic Staphylococcus Aureus Bacteriophage against Multidrug-Resistant Staphylococcus Aureus in Mice. J Infect Dev Ctries. 2016; 10: 1208–13. DOI: 10.3855/jidc.7931.
- Sharma-Kuinkel BK, Zhang Y, Yan Q, Ahn SH, Fowler VG. Host Gene Expression Profiling and In Vivo Cytokine Studies to Characterize the Role of Linezolid and Vancomycin in Methicillin- Resistant Staphylococcus Aureus (MRSA) Murine Sepsis Model. PLoS ONE. 2013; 8: e60463. DOI: 10.1371/journal.pone.0060463.
- Gordon O, Dikeman DA, Ortines RV, Wang Y, Youn C, Mumtaz M, et al. The Novel Oxazolidinone TBI-223 Is Effective in Three Preclinical Mouse Models of Methicillin-Resistant Staphylococcus Aureus Infection. Microbiol Spect. 2022; 10: e02451-21, DOI: 10.1128/spectrum.02451-21.
- Fujiki J, Nakamura T, Nakamura K, Nishida K, Amano Y, Watanabe Y, et al. Biological properties of Staphylococcus virus –SA012 for phage therapy. Scientific reports. 2022; 12 (1): 21297. Available from: https://doi.org/10.1038/s41598-022-25352-6.
- Plumet L, Ahmad-Mansour N, Dunyach-Remy C, Kissa K, Sotto A, Lavigne J-P, et al. Bacteriophage Therapy for Staphylococcus Aureus Infections: A Review of Animal Models, Treatments, and Clinical Trials. Front Cell Infect Microbiol. 2022; 12: 907314. DOI: 10.3389/fcimb.2022.907314.