ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Повышенная физическая нагрузка в условиях нормоксии вызывает идиопатическую кахексию у Heterocephalus glaber
1 Научно-исследовательский институт физико-химической биологии имени А. Н. Белозерского, Московский государственный университет имени М. В. Ломоносова, Москва, Россия
2 Научно-технологический университет «Сириус», Сириус, Россия
3 Институт биоорганической химии имени М. М. Шемякина и Ю. А. Овчинникова Российской академии наук, Москва, Россия
4 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени В. И. Кулакова, Москва, Россия
Обогащение среды обитания живущих в неволе грызунов Heterocephalus glaber (голых землекопов), позволившее им реализовать врожденный поведенческий паттерн рытья плотного грунта, неизвестным образом привело к появлению в колонии необычных животных с признаками кахексии, отличавшихся от остальных животных сниженным индексом массы тела на фоне уменьшения доли подкожного жира. Сами животные демонстрировали при этом агрессивное пищевое поведение, но не набирали веса даже после прекращения рытья при отсоединении камеры с грунтом. Целью работы было выяснить патогенетический механизм наблюдаемого явления. Для этого из колонии изъяли животных с признаками кахексии (одна самка и два самца возрастом 4–5 лет), а также животных, не имеющих данных признаков (две самки и один самец возрастом 4–5 лет) в качестве контрольных. При гистологическом анализе тканей были выявлены гипертрофия сердца и гиперлипофусциноз печени. На гипетрофию сердца также указывали результаты биоинформатического анализа секвенирования микроРНК сердца животных, который показал повышенный уровень микроРНК, ответственных за повышение активности деления клеток, и снижение активности апоптоза в сердце. Эти данные свидетельствуют о том, что животные, находясь в среде обитания с повышенным для них содержанием кислорода (21% против 8% в естественной среде обитания под землей), при выполнении физических нагрузок испытали сильный окислительный стресс, что привело к нарушению работы регуляторных систем организма, подъему метаболизма в покое, перегрузке работы сердечно-сосудистой системы и повреждению органов и тканей. Таким образом, голые землекопы могут вести нормальную для них физическую активность только в условиях низкого содержания кислорода.
Ключевые слова: физическая нагрузка, окислительный стресс, голый землекоп, кахексия, липофусциноз, метаболизм в состоянии покоя, гипероксия
Финансирование: работа была выполнена при поддержке гранта РНФ №22-14-00160 «Сравнительный анализ возрастных сигнатур у долго- и короткоживущих представителей Heterocephalus glaber: каст-специфичность поведенческих, биохимических и транскриптомных профилей».
Вклад авторов: М. А. Адрианов — автор рукописи, проведение экспериментов с животными; М. Ю. Бобров, И. З. Мамедов — анализ биоинформатических данных, секвенирование микроРНК; В. Н. Манских — гистологичеcкое исследование тканей; А. А. Рачкова — автор рукописи, анализ биоинформатических данных, пробоподготовка и выделение РНК; А. М. Шелехова, О. А. Аверина — проведение экспериментов с животными; Ч. М. Эльдаров — анализ биоинформатических данных; М. Ю. Высоких — дизайн эксперимента, создание концепции, написание рукописи.
Соблюдение этических стандартов: исследование одобрено этическим комитетом НИИ ФХБ имени А. Н. Белозерского МГУ (протокол № 2/20 от 16 ноября 2022 г.).
Для корреспонденции: Михаил Андреевич Адрианов
Ленинские горы, д. 1, стр. 40, 119992, Москва, Россия; moc.liamg@hcstil.ay
Голые землекопы (Heterocephalus glaber) — подземные грызуны, проживающие на территории Африканского Рога (Сомали, Эфиопия) — очень интересны для изучения. Одна из их отличительных особенностей — эусоциальность, а другая — аномально высокая продолжительность жизни. Так, при относительно малом весе (30–80 г) голые землекопы могут прожить до 37 лет в лабораторных условиях [1], в то время как грызун с тем же весом, например, домовая мышь Mus musculus, доживает в лабораторных условиях до 3 лет, а в природе — до 1,5 лет [2].
Создание условий содержания лабораторных животных, схожих с теми, которые присутствуют в их естественном ареале, — необходимая часть исследований, использующих их в изучении разных биологических процессов. При работе с голыми землекопами необходимо поддерживать высокую температуру и влажность, однако наиболее трудоемким процессом в их содержании является создание имитации подземного лабиринта, в котором будут обитать голые землекопы, находясь в лаборатории [3]. Сам лабиринт состоит из цилиндров и соединяющих их тоннелей, выполненных из акрилового стекла. Такая система содержания, однако, не дает возможности животным проявлять полностью всю свою физическую активность, так как цилиндры полностью не заполнены субстратом, который они могли бы копать. Известно, что из-за низкой физической активности иногда изменяется структура скелетных мышц, что может привести к неправильной интерпретации результатов исследований при сравнении с другими модельными объектами [4]. В связи с этим в лаборатории было принято решение для обогащения среды обитания голых землекопов установить дополнительный отсек, наполненный глиной, близкой по плотности к грунту Африканского рога.
Голые землекопы почти сразу начали копать туннели в грунте, что мы посчитали нормальной реакцией животных. Однако через полгода мы начали замечать внешние изменения некоторых особей. Они начали худеть, черты их морды обострялись, что напоминало состояние других животных, страдающих кахексией [5]. Мы считали, что причина тому — истощение их подкожной жировой клетчатки, при этом стоит отметить, что данные животные приходили самыми первыми к пище, которую они не перемещали в гнездо, что должны были сделать, будучи рабочими особями, а сразу на месте съедали, что указывало на их большую потребность в пище. Было принято решение убрать отсек с глиной и следить за их индексом массы тела в течение трех лет, с последующим изучением микроРНК в органах, которые могли пострадать: сердце, почки, печень, скелетная мышца. Кроме того, для выяснения причин такого аномального состояния животных были приготовлены гистологические препараты исследуемых тканей и органов.
Решение об изучении микроРНК было вызвано тем, что голые землекопы на данный момент мало изучены в области транскриптома, а микроРНК является эволюционно высококонсервативной структурой, которая участвует в регуляции экспрессии схожих генов у разных видов [6]. Целью данной работы было установление причин такого состояния животных.
МАТЕРИАЛЫ И МЕТОДЫ
Содержание и уход за животными
Колония голых землекопов (n = 11), полученная из Leibniz Institute for Zoo and Wildlife Research (IZW) (Берлин, Германия), была размножена в НИИ Физико-химической биологии имени А. Н. Белозерского МГУ до начала исследования до 54 особей. Каждое животное имеет индивидуальный RFID-чип, введенный под кожу, для их идентификации в колонии. Колонию содержали в пластиковых контейнерах цилиндрической формы, соединенных между собой пластиковыми трубами, при температуре 27 ± 1 °С и влажности 50 ± 10% с режимом дня и ночи 12 : 12 ч (10:00–22:00 — день). Питание состояло из яблок, батата, моркови, злаковых, которые предоставлялись ежедневно. Питьевой режим для животных не требуется, так как изза их физиологии они могут получать воду только из твердого корма. Для обогащения среды проживания голых землекопов в колонии был установлен прямоугольный контейнер с глиной высокой плотности, имитирующей почву, характерную для естественной среды обитания животных. Контейнер был сразу убран после появления у 9 (3 самки и 6 самцов возрастом 2–6 лет) из 54 особей признаков кахексии. Для контроля состояния этих животных каждые 4–5 месяцев проводился мониторинг их индекса массы тела с контрольными животными схожего возраста (n = 9; 4 самки и 5 самцов). Эвтаназию животным проводили методом декапитации после введения в наркоз с помощью ингаляции изофлурана (Laboratorios Karizoo. S.A., Испания) 5% в потоке 0,4 л/мин в установке R500 (RWD, Китай).
Опытные группы животных для гистологического исследования и секвенирования микроРНК
Для исследования были отобраны две группы голых землекопов: здоровые животные (n = 3, одна самка и два самца) с температурой тела 30 °С, индексом масссы тела 0,33 и животные с астеническим телосложением (n = 3, две самки и один самец) с температурой тела 27 °С, индексом массы тела 0,25.
Расчет индекса массы тела животных
Индекс массы тела (ИМТ, г/см2) рассчитывали по следующей формуле: ИМТ = масса животного, г / (длина животного, см)2.
Гистологический анализ
Образцы печени животных фиксировали 10%-м формалином на 0,1М фосфатном буфере (pH = 7,4). Дегидратировали в пяти порциях изопропилового спирта («Биовитрум», Россия) по 2 ч в каждой. Пропитывали в двух порциях парафиновой среды Гистомикс («Биовитрум», Россия) по 2 ч в каждой и заливали в парафиновые блоки. Срезы толщиной 3 мкм готовили на ротационном микротоме (Leika, Германия) и окрашивали гематоксилином Карацци и эозином по рутинному протоколу. Препараты изучали с помощью микроскопа AxioScope A1 (Karl Zeiss, Германия). Фотографирование осуществляли цифровой камерой MRc.5 (Karl Zeiss, Германия).
Выделение и секвенирование микроРНК
После эвтаназии у каждого животного были взяты образцы печени, почки, сердца, скелетной мышцы. Из образцов тканей с использованием коммерческих наборов miRNEasy (Qiagen, США) были выделены фракции РНК, содержащие микроРНК. Полученные образцы использовали далее для создания библиотек кДНК и последующего секвенирования. Качество выделенных фракций оценивали при помощи микроэлектрофореза на чипах Bioanalyzer (Agilent, США). Для секвенирования были отобраны образцы, имеющие индекс целостности РНК RIN (RNA integrity number) не меньше 8.
Секвенирование проводили на платформе NextSeq (Illumina, США) с использованием реагентов и расходных материалов NextSeq 500/550 High Output v2 kit (Illumina, США). Библиотеки кДНК из выделенных образцов РНК готовили с использованием наборов NEBnext (NEB, США), по методикам, рекомендованным производителем. Качественный и количественный анализ библиотек проводили при помощи микроэлектрофореза Bioanalyzer (Agilent, США) и флуорометрии на Qubit (ThermoFisher, США). Качество секвенирования оценивали при помощи сервиса BaseSpace (Illumina, США) по следующим параметрам: плотность кластеров, интенсивность сигнала в каналах детекции, доля кластеров, прошедших фильтр, по выходу выровненных прочтений. Все параметры не выходили за пределы допустимых значений.
Биоинформатический анализ данных секвенирования микроРНК
Полученные в результате секвенирования последовательности нуклеотидов (риды) проходили обязательную оценку качества с помощью программы fastqc, для дальнейшего исследования были отфильтрованы риды высокого качества (>30). Адаптеры были удалены с помощью программы cutadapt. После удаления адаптеров для дальнейшего исследования были выбраны только последовательности длиной 18–31 нуклеотид, соответствующие малым РНК.
Поиск микроРНК был произведен с помощью алгоритма mirDeep2 на основе генома голого землекопа и с помощью информации о родственном геноме (Mus musculus). Далее из общего списка последовательностей были удалены случайные-и/или неспецифические последовательности. Для дальнейшего изучения отбирали только последовательности, которые присутствовали в более чем 60% образцов своей подгруппы (опытная или контрольная группа соответствующей ткани или органа) и проходили при этом все фильтры по качеству.
Аннотация и анализ микроРНК
Для прошедших все фильтры микроРНК был проведен поиск человеческих ортологов с помощью программы blastn, в качестве базы данных для сравнения использовали базу микроРНК человека Mirbase v.22 (https://mirbase.org/).
Для поиска возможных мишеней микроРНК использовали базу данных микроРНК-таргетных взаимодействий Mirtarbase v 9.0 (https://mirtarbase.cuhk.edu.cn/~miRTarBase) и miRDB (https://mirdb.org/mirdb). Из базы данных Mirtarbase отбирали только те взаимодействия, что были подтверждены так называемыми «сильными» доказательствами — с помощью количественного ПЦР, блоттинга или использования репортерного гена. Из базы данных miRDB отбирали только мишени микроРНК с target score больше 80.
Для отобранных таким методом взаимодействий пар микроРНК–мишень было проведено обогащение по различным базам данных, таким как GO, KEGG, Reactome, Wikipathways с помощью платформы STRING (https:// string-db.org/) для выявления наиболее вовлеченных метаболических путей и процессов.
Статистическая обработка данных
Данные обрабатывали в ПО IBM® SPSS® 24 (IBM, США) с использованием U-критерия Манна–Уитни. Статистически значимыми различия считали при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Внешний вид животных
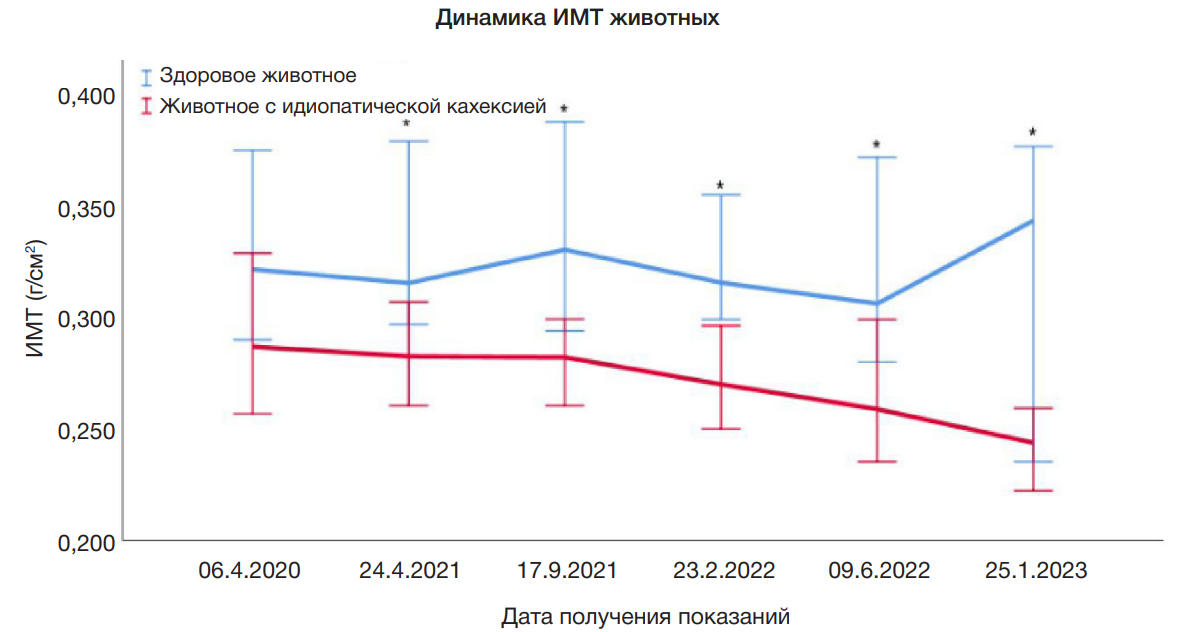
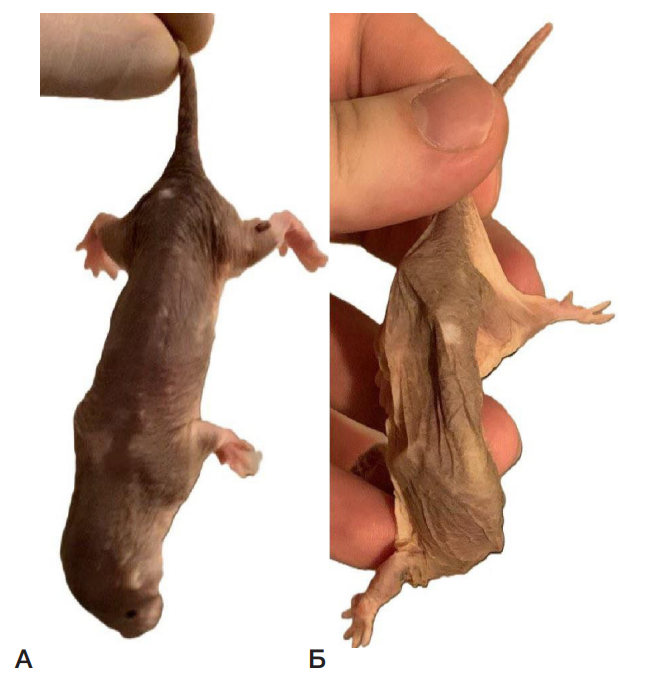
В конце иследования у животных с признаками кахексии статистически значимо снизился ИМТ на 15% в сравнении с контрольными животными из этой же колонии (рис. 1). Внешний вид животных, страдающих кахексией, очень сильно отличался от внешнего вида контрольных животных. У них были впалые бока, обострившиеся черты морды (рис. 2).
Гистологическое исследование печени
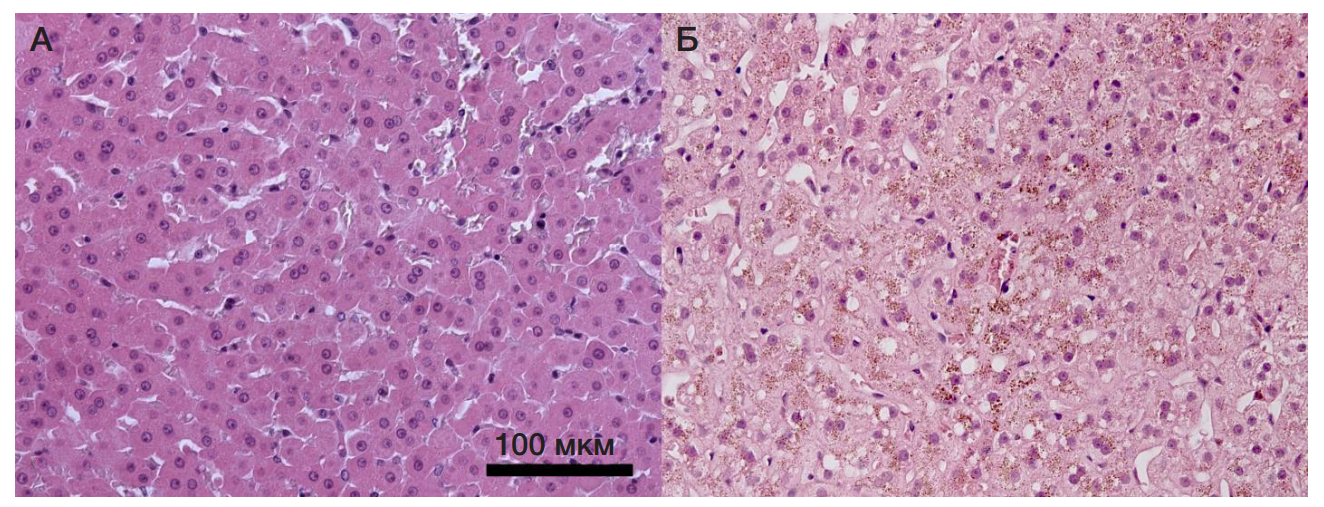
При извлечении печени после эвтаназии животных, страдающих кахексией, печень имела глубокий бурый цвет, в отличие от контрольных животных (рис. 3). При гистологическом исследовании печени был выявлен комплекс своеобразных и ранее не описанных у землекопа изменений. У всех особей со спонтанной идиопатической кахексией наблюдалось накопление в гепатоцитах большого количества светло-коричневого пигмента — липофусцина. У некоторых животных этот пигмент распределялся более или менее равномерно среди гепатоцитов печеночной дольки. У других наблюдалось накопление его преимущественно в перицентральных зонах с развитием резко выраженной жировой дистрофии гепатоцитов. При этом в перипортальных областях обнаружена гипертрофия клеток печени с резким увеличением размеров клеток и ядер и появлением в цитоплазме множества крупных эозинофильных гранул (митохондрий). У отдельных особей наблюдали явления экстрамедуллярного гематопоэза и эритрофагоцитоза гепатоцитами. У здоровых животных липофусцин и дистрофические измнения в гепатоцитах отстуствовали (рис. 4).
Как известно, липофусцин образуется из остатков мембран внутриклеточных органелл после их деградации в аутофагосомах. Поэтому накопление липофусцина в гепатоцитах является морфологическим проявлением интенсификации процесса аутофагии и «старения» клеток печени.
Аннотация микроРНК голого землекопа
После фильтрации полученных в результате секвенирования последовательностей по их длине и качеству были получены последовательности микроРНК из печени, почки, сердца и скелетной мышцы голого землекопа. Общий пул всех выявленных последовательностей был аннотирован по аналогии с человеческими ортологами в базе данных Mirbase. Впервые была создана база микроРНК голого землекопа (приложение 1). Описаны 162 новых последовательности, на 90–100% идентичные человеческим аналогам. Более того, для 22 последовательностей малых РНК голого землекопа не было выявлено аналогов у человека. Исходя из этого, логично предположить, что для землекопа характерна дополнительная специфическая регуляция экспрессии генов. Ее адаптивное значение может быть выяснено в дальнейшем путем изучения спектра микроРНК генетически и экологически близких к голому землекопу видов (Mus Musculus, Cavia porcellus, Ellobius talpinus, Cryptomys damarensis).
Для выявленных в печени, почке, сердце и скелетной мышце микроРНК были проанализированы их потенциальные мишени и проведено обогащение по базам данных GO, KEGG, Reactome, Wikipathways (приложение 2–5). Анализ сигнальных путей и процессов, связанных с выявленными микроРНК и их генами-мишенями, показал, что существует множество разнонаправленных и определяющих большое количество клеточных и даже надклеточных функций, которые вовлекаются в нормальную физиологию и спонтанную идиопатическую кахексию голого землекопа. В частности, затрагиваются такие дистанцированные друг от друга процессы, как образование анатомических структур в процессе развития (Anatomical structure development) и связывание двухцепочечной ДНК (Double-stranded DNA binding). Особенно стоит отметить наличие микроРНК в сердце голых землекопов, которые ответственны за регуляцию экспрессии генов, подавляющих апоптоз, но индуцирующих деление клеток.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Внешний вид и изменение ИМТ животных, страдающих кахексией, свидетельствует о том, что данные животные по неопределенной причине не могли набрать вес, хотя они при этом демонстрировали то же самое пищевое поведение, что и другие представители колонии, даже проявляя себя более агрессивно по отношению к еде, так как, будучи рабочими особями, не несли ее в гнездовой отсек, а сразу съедали в кормовом.
Возможно, это связано с тем, что у данных животных затраты энергии в покое были намного выше, чем у контрольных животных, например, как при индукции гипертиреоза у крыс [7]. Это соответствует данным, полученным из результатов секвенирования микроРНК. У животных, страдающих кахексией, повышена доля микроРНК, ответственных за повышение активности деления клеток и снижение активности программируемой клеточной гибели и апоптоза в сердце, что указывает на повышение пролиферации клеток в миокарде с последующей его гипертрофией и также ассоциируется с индуцируемым гипертиреодизмом у мышей [8]. Данная гипертрофия необходима для повышения сердечного выброса и при повышении частоты сердечных сокращений приведет к повышению скорости метаболизма, что вероятно демонстрировали животные при невозможности набрать вес при прежнем питании. Эти изменения в сердце могут привести к его недостаточности, наблюдаемой у людей, также страдающих гипертиреоидизмом, что приведет к меньшей продолжительности жизни страдающих кахексией животных по сравнению с их здоровыми собратьями [9].
Данное кахексичное состояние животных было также отражено на печени животных. Сама печень была ярко бурого, почти черного цвета. Это можно связать с большими отложениями липофусцина в ее ткани, что было продемонстрировано при гистологическом исследовании. Возможно, в ткани печени активно происходили процессы ремоделлинга митохондрий, в котором активно участвуют процессы аутофагии, что было вызвано активным окислительным стрессом [10], так как данные животные в естественной среде обитания существуют при низком процентном содержании кислорода (8–15%) [11], а в лабораторных условиях содержатся при 21%, т. е. в гипероксичной для них среде. У животных, страдающих кахексией, отягощающим фактором является их повышенный уровень метаболизма в состоянии покоя на фоне гиперактивации сердечно-сосудистой системы, которая за собой влечет активную работу дыхательной системы, что еще сильнее нагружает организм голого землекопа, страдающего кахексией, излишним уровнем кислорода в крови, который и мог вызвать данные проявления в печени [12] и сердце.
ВЫВОДЫ
Принимая в рассмотрение изложенные факты, можно предположить, что данное состояние голых землекопов было вызвано усилением физической нагрузки в состоянии гипероксии, что могло привести к поражению печени изза хронического окислительного стресса, вследствие чего у данных особей уменьшилась продолжительность жизни и развилось патологическое состояние. Такой эффект показывает возможную уязвимость голых землекопов к повышенному содержанию кислорода в окружающем воздухе, что подтверждает их физиологическую предрасположенность к жизни именно при низком содержании кислорода. Однако остается неясной причина повышения уровня метаболизма в покое у животных даже в тот момент, когда провоцирующий фактор был убран. Возможно, это связано с необратимыми последствиями долговременного окислительного стресса на организм, из-за которого была нарушена регуляция клеток и интегративных систем. Чтобы выяснить это, необходимо провести дальнейшие исследования данных животных, в частности провести транскриптомный анализ и изучить экспрессию мишеней дифференциально экспрессированных микроРНК.
- Lee BP, Smith M, Buffenstein R, Harries LW. Negligible senescence in naked mole rats may be a consequence of well-maintained splicing regulation. GeroScience. 2020; 42: 633–51. Available from: https://doi.org/10.1007/s11357-019-00150-7.
- Gorbunova V, Bozzella MJ, Seluanov A. Rodents for comparative aging studies: from mice to beavers. AGE. 2008; 30: 111–9. Available from: https://doi.org/10.1007/s11357-008-9053-4.
- Smith M, Buffenstein R. Managed Care of Naked Mole-Rats. In: Buffenstein R, Park TJ, Holmes MM, editors. The Extraordinary Biology of the Naked Mole-Rat, vol. 1319. Cham: Springer International Publishing, 2021; p. 381–407.
- Holloway GP, Holwerda AM, Miotto PM, Dirks ML, Verdijk LB, Van Loon LJC. Age-Associated Impairments in Mitochondrial ADP Sensitivity Contribute to Redox Stress in Senescent Human Skeletal Muscle. Cell Reports. 2018; 22: 2837–48. Available from: https://doi.org/10.1016/j.celrep.2018.02.069.
- DeBoer MD. Animal models of anorexia and cachexia. Expert Opinion on Drug Discovery. 2009; 4: 1145–55. Available from: https://doi.org/10.1517/17460440903300842.
- Bartel DP. MicroRNAs. Cell. 2004; 116: 281–97. Available from: https://doi.org/10.1016/S0092-8674(04)00045-5.
- Iossa S, Liverini G, Barletta A. Relationship between the resting metabolic rate and hepatic metabolism in rats: effect of hyperthyroidism and fasting for 24 hours. Journal of Endocrinology. 1992; 135: 45–51. Available from: https://doi.org/10.1677/joe.0.1350045.
- Parletta AC, Cerri GC, Gasparini CRB, Panico K, Vieira-Junior DN, Zacarias-Rodrigues LM, et al. Cardiac hypertrophy that affects hyperthyroidism occurs independently of the NLRP3 inflammasome. Pflugers Arch — Eur J Physiol. 2024; 476: 1065–75. Available from: https://doi.org/10.1007/s00424-024-02965-6.
- Osuna PM, Udovcic M, Sharma MD. Hypothyroidism and the Heart. Methodist DeBakey Cardiovascular Journal. 2017; 13: 60. Available from: https://doi.org/10.14797/mdcj-13-2-60.
- Wang X, Song X, Si Y, Xia J, Wang B, Wang P. Effect of autophagy-associated proteins on the arecoline-induced liver injury in mice. Exp Ther Med. 2018. Available from: https://doi. org/10.3892/etm.2018.6564.
- McNab BK. The Metabolism of Fossorial Rodents: A Study of Convergence. Ecology. 1966; 47: 712–33. Available from: https://doi.org/10.2307/1934259.
- Rogers LK, Tipple TE, Britt RD, Welty SE. Hyperoxia exposure alters hepatic eicosanoid metabolism in newborn mice. Pediatr Res. 2010; 67: 144–9. Available from: https://doi.org/10.1203/ PDR.0b013e3181c2df4f.