ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Синергическая эффективность низкоинтенсивной экстракорпоральной ударно-волновой терапии и обогащенной тромбоцитами плазмы при эректильной дисфункции
1 Отделение сестринского ухода, Больница Медицинского университета Тайбея, Тайбей, Тайвань
2 Академический институт клинической медицины, Школа медицины, Медицинский колледж, Медицинский университет Тайбея, Тайбей, Тайвань
3 Отделение урологии, Больница Медицинского университета Тайбея, Тайбей, Тайвань
4 Научно-исследовательский центр урологии и нефрологии, Медицинский университет Тайбея, Тайбей, Тайвань
5 Victory Biotechnology Co., Ltd., Тайбей, Тайвань
6 Программа для руководителей по управлению здравоохранением, Индийский институт менеджмента Лакхнау, Лакхнау, Индия
7 Медицинский колледж Чандаули Бабы Кинарама, Уттар-Прадеш, Индия
8 Институт традиционной медицины, Школа медицины, Национальный университет Ян Мин Цзяо Дун, Тайбей, Тайвань
9 Хирургическое отделение, Городская больница Тайбея, филиал Рен-Ай, Тайбей, Тайвань
10 Институт микробиологии и иммунологии, Национальный университет Ян Мин Цзяо Дун, Синьчжу, Тайвань
11 Научно-клинический центр, Больница Медицинского университета Тайбея, Тайбей, Тайвань
12 Стоматологический колледж, Медицинский университет Тайбея, Тайбей, Тайвань
Эректильная дисфункция (ЭД) — патологическое состояние репродуктивной системы, при котором нарушается способность достижения или поддержания эрекции. Оно губительно сказывается на взаимоотношениях, уверенности в себе и эффективности. Метод лечения ЭД — низкоинтенсивная ударно-волновая терапия (низкоинтенсивная УВТ). Однако ее применение связано с нежелательными явлениями, такими как синяки, покраснения и боль. В ходе настоящего исследования применяли обогащенную тромбоцитами плазму (PRP) — полученный из крови биоматериал, содержащий большое количество факторов роста, для повышения терапевтической эффективности низкоинтенсивной УВТ при ЭД. Оценивали синергический эффект PRP и низкоинтенсивной УВТ, при этом низкоинтенсивную УВТ применяли экстракорпорально одновременно с PRP. Оценку клинических показателей проводили через 22 ± 2, 50 ± 2 и 78 ± 2 дней. Статистический анализ выполняли с помощью непараметрического критерия Фридмана для повторных измерений (альтернатива дисперсионному анализу (ANOVA)). Фиксировали показатели Международного индекса эректильной функции (МИЭФ-5) и показатели твердости полового члена при эрекции (EHS). Показатель по шкале МИЭФ-5 до лечения составил 8,36 ± 1,44 баллов. Через 22 ± 2 дня комбинированного лечения с применением PRP и низкоинтенсивной УВТ показатель составил 14,45 ± 2,12 баллов (p < 0,028), а в дальнейшем увеличился до 15,45 ± 1,93 (p < 0,008) и 16,18 ± 1,48 (p < 0,001) баллов — через 50 ± 2 и 78 ± 2 дней лечения соответственно. Средний показатель по шкале EHS до лечения составил 1,64 ± 0,20 (p < 0,002). Он увеличился до 2,81 ± 0,26 (p < 0,002), 3,09 ± 0,25 (p < 0,0002) и 3,18 ± 0,12 (p < 0,000) через 22 ± 2, 50 ± 2 и 78 ± 2 дней соответственно. Комбинированное лечение с применением PRP и низкоинтенсивной УВТ продемонстрировало мощный синергический эффект, улучшив показатели МИЭФ-5 и EHS. Однако для достижения консенсуса необходимы широкомасштабные клинические исследования механизмов этого явления.
Ключевые слова: эректильная дисфункция, низкоинтенсивная УВТ, обогащенная тромбоцитами плазма (PRP), МИЭФ-5, EHS
Благодарности: авторы благодарят TCM Biotech International Corp. (Новый Тайбэй, Tайвань) за предоставленную установку VertePLT Plus Platelet Concentrate Separator (VertePLT) для приготовления PRP для последующего применения в терапевтических целях у пациентов с ЭД.
Вклад авторов: Й. Ч. Ли, Т. Д. Янг — идея исследования, методология, анализ данных, проверка, валидация, написание рукописи (# вклад авторов равнозначный); У. Ч. Чен, Н. К. Дуби, Х. Чатурведи, А. Ч. Хуанг, Ч. Х. Чанг, Ч. Ч. Лин — анализ данных, проверка, валидация; М. Ч. Лю — анализ данных, проверка, валидация, написание литературного обзора, редактирование, общее руководство.
Соблюдение этических стандартов: исследование одобрено объединенным институциональным наблюдательным советом Медицинского университета Тайбея (IRB № N201907013) и Управлением по надзору за качеством пищевых продуктов и лекарственных средств Тайваня (TFDA: дело № 1086614281), зарегистрировано на ClinicalTrials.gov (дата обращения 04 июня 2020 г.) (NCT04416802). Информированное согласие подписали все участники.
Для корреспонденции: Минг-Че Лю
Тайбей, Тайвань 11031; wt.ude.umt@200790402d
Эректильная дисфункция (ЭД) — это патологическое состояние репродуктивной системы, при котором нарушается способность достижения или поддержания эрекции [1]. Оно может серьезно влиять на сексуальное здоровье и половую активность, оказывая отрицательное воздействие на межличностные взамоотношения, психологическое состояние и качество жизни [1, 2]. Эрекцию регулирует парциальное давление кислорода. Его снижение приводит к уменьшению трабекулярного гладкомышечного компонента пещеристого тела, в результате чего возникают венозная утечка, окислительный стресс, воспаление, структурные изменения интерстиция полового члена и нейронных структур, причинами которых являются вазоконстрикция, эндотелиальная дисфункция, веноокклюзионная болезнь. В долгосрочной перспективе они могут привести к возникновению и прогрессированию ЭД [3].
Согласно прогнозам, к 2025 г. заболеваемость населения ЭД может достичь 322 млн случаев [1, 4]. Данные недавнего проспективного эпидемиологического исследования позволяют предположить, что распространенность ЭД может варьировать между 32% и 80%, в зависимости от возраста [5]. С возрастом риск и заболеваемость ЭД также увеличиваются, особенно в возрастной группе 40–70 лет [5]. На сегодняшний день, несмотря на применение различных традиционных методов лечения ЭД, включая медикаментозные и хирургические методы, результаты показывают недостаточную эффективность либо имеют место нежелательные явления. По этой причине срочно необходимо комплексное терапевтическое решение.
Низкоинтенсивная ударно-волновая терапия (низкоинтенсивная УВТ) представляет собой метод лечения, обладающий потенциалом с точки зрения регенерации эндотелия, клеток гладкой мускулатуры, а также нервных волокон, в которых вырабатывается нейронная NO-синтаза [6]. Ударные волны представляют собой звуковые волны с частотой 16–20 МГц и периодом до 10 мкс, направленные на участок, который может представлять собой ткань или орган-мишень для терапии [7]. Низкоинтенсивные ударные волны — это низкоэнергетические волны с плотностью потока энергии ниже 0,1 мДж/мм2, однако нет единого мнения о диапазоне плотности потока энергии [8]. Изменения включают в себя пролиферацию Т-лимфоцитов, вовлечение стволовых клеток, увеличение количества связей на поверхности эндотелия капилляров, регенерацию нервных клеток и аксонов, изменения коллагенового матрикса, а также уменьшение воспаления и окислительного стресса [9].
Обогащенная тромбоцитами плазма (PRP) представляет собой продукт крови, богатый факторами роста, такими как фактор роста эндотелия сосудов (VEGF), основной фактор роста фибробластов (bFGF), трансформирующий фактор роста β1 (TGF-β1), тромбоцитарные факторы роста (PDGF), гепатоцитарный фактор роста (HGF), инсулиноподобный фактор роста 1 (IGF-1), эпидермальный фактор роста (EGF) и различные цитокины. Эти факторы задействованы в процессах роста и заживления тканей через активацию пролиферации фибробластов, гладкомышечных клеток и нейтрофилов, а также дифференцировку мезенхимальных стволовых клеток [1, 10]. PRP содержит также биомолекулы, такие как аденозинтрифосфат, аденозиндифосфат, дофамин, серотонин, гистамин, и ионы Ca+2, которые играют ключевую роль в поддержании тканевого гомеостаза [11]. Во время применения описанных выше терапевтических мер изучают потенциал PRP в отношении лечения ЭД. Однако показано, что терапевтическую эффективность PRP можно повысить путем комбинирования с другими, альтернативными методами лечения, такими как низкоинтенсивная ударноволновая терапия (низкоинтенсивная УВТ). Более того, доклинические и клинические исследования ограничивают их широкое применение для лечения ЭД. По этой причине мы исследовали синергический эффект PRP и лечения с применением низкоинтенсивной УВТ при ЭД.
ПАЦИЕНТЫ И МЕТОДЫ
Пациенты
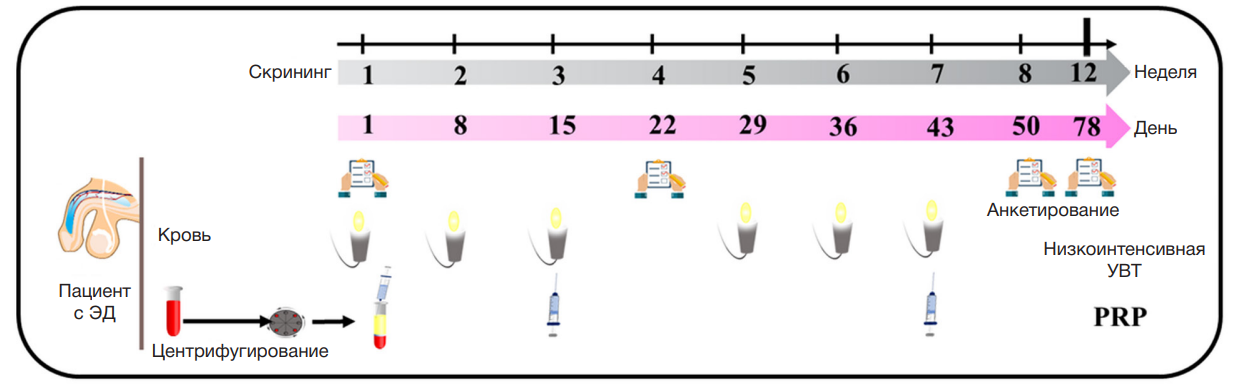
С 20 мая 2020 г. по 22 февраля 2022 г. 11 пациентов с ЭД проходили комбинированное лечение с применением низкоинтенсивной УВТ и PRP в течение 78 ± 2 дней. Всех пациентов подробно проинформировали о комбинированном лечении с применением низкоинтенсивной УВТ и PRP, как показано на схеме дизайна исследования (рис. 1).
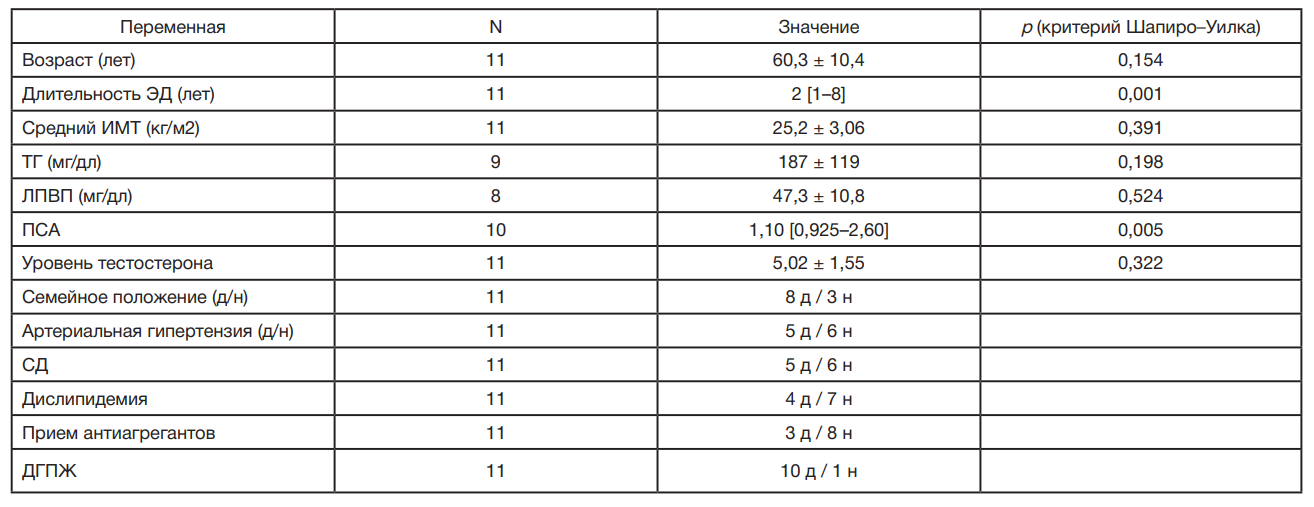
Выполнена оценка демографических данных пациентов, таких как возраст, материальное положение, длительность ЭД, среднее значение индекса массы тела (ИМТ), а также уровни триглицеридов, липопротеинов высокой плотности (ЛПВП), простатического специфического антигена (ПСА) и тестостерона. Помимо этого зафиксированы факты наличия артериальной гипертензии, сахарного диабета, доброкачественной гиперплазии предстательной железы, дислипидемии, а также применения антиагрегантных средств.
Критерии включения и критерии исключения
В исследование были включены пациенты, страдавшие импотенцией более 3 месяцев, с показателями Международного индекса эректильной функции (МИЭФ-5) меньше или равными 21, показателями жесткости полового члена при эрекции (EHS) 0, ≤ 3, в возрасте старше 30 лет. При этом пациентов исключали при наличии у них гипогонадизма, склонности к кровотечениям, при невозможности лечения, при наличии СПИДа, сифилиса, кондилом, радикальной простатэктомии в анамнезе, рака простаты или злокачественных опухолей малого таза, дисфункции половых желез, деформации полового члена, протеза полового члена, психических заболеваний, заболеваний нервной системы (множественной миеломы, атрофии головного мозга и т. д.), кардиостимулятора. Пациентов также исключали в случаях несоответствия критериям настоящего исследования по результатам обследования, злоупотребления алкоголем или наркотиками.
Применение низкоинтенсивной УВТ
Низкоинтенсивную УВТ с использованием аппарата PiezoWave 2 (Richard Wolf GmbH, Knittlingen; Германия) проводили на 1-й, 8-й, 15-й, 29-й, 36-й и 43-й день. Во время каждого сеанса лечения применяли 2000 ударных импульсов (УИ) (0,16 мДж/мм2, 6–8 герц (Hz)) на стволе полового члена и 2000 УИ на пещеристом теле в промежности.
Получение и введение человеческой обогащенной тромбоцитами плазмы (PRP)
Для получения PRP мы использовали специализированный сепаратор компонентов крови, содержащий ACD-A в качестве антикоагулянта и специфический гель-сепаратор для отделения тромбоцитов от плазмы и предупреждения образования примесей других компонентов крови, в том числе эритроцитов и лейкоцитов. В стерильных условиях 7 мл аутологичной периферической крови человека забирали в сепаратор PLTenus PLUS Platelet Concentrate Separator (TCM Biotech International Corp., Тайбей, Тайвань) посредством венепункции. Затем кровь центрифугировали при 500~1200 G в течение 8 мин. После этого около 4 мл плазмы с тромбоцитами, сохранившимися над слоем тиксотропного геля, отбирали в пластиковую пробирку для терапевтического применения. Затем по 0,5 мл PRP вводили интракавернозно в шесть участков ствола полового члена. Терапевтическую эффективность оценивали по показателям МИЭФ-5 и EHS.
Оценка исходов
Исход лечения оценивали, основываясь на показателях по шкалам МИЭФ-5 и EHS. МИЭФ-5 представляет собой анкету для оценки эректильной функции и тяжести ЭД [12]. Она содержит пять блоков для оценки эректильной функции, сексуального желания, оргазмической функции, удовлетворения от полового акта и общего удовлетворения. Жесткость полового члена при эрекции оценивали по шкале EHS — 4-балльной шкале самооценки из одного блока [13]. Эта надежная шкала демонстрирует также прямую связь между твердостью полового члена при эрекции и половым актом. Показатели, полученные до начала лечения, сравнивали с показателями после лечения, чтобы оценить эффективность комбинированного лечения. Показатели после лечения были получены через 22 ± 2, 50 ± 2 и 78 ± 2 дней.
Статистический анализ
Статистический анализ выполняли с помощью непараметрического критерия Фридмана для повторных измерений, представляющего собой альтернативу дисперсионному анализу (ANOVA), подходящую для данных, распределение которых отличается от нормального, и небольших выборок. Помимо этого в качестве апостериорного анализа было выполнено попарное сравнение с применением критерия Дарбина-Коновара (альтернатива t-критерию Стьюдента). Результаты считали значимыми, только когда они не превышали 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Демографические данные пациентов
В исследовании приняли участие 11 пациентов, которым провели низкоинтенсивную УВТ в комбинации с PRP. Как показано в табл. 1, между пациентами не было значимых различий по возрасту, ИМТ, уровням ЛПВП, ПСА и тестостерона. При этом имели место значимые различия по длительности ЭД. Из 11 пациентов восемь (72,73%) были женаты, а пятеро (45,46%) страдали артериальной гипертензией и сахарным диабетом. Три пациента (27,27%) принимали антиагреганты. После лечения была выполнена оценка показателей МИЭФ-5 и EHS.
Влияние PRP и низкоинтенсивной УВТ на показатели по шкале МИЭФ-5
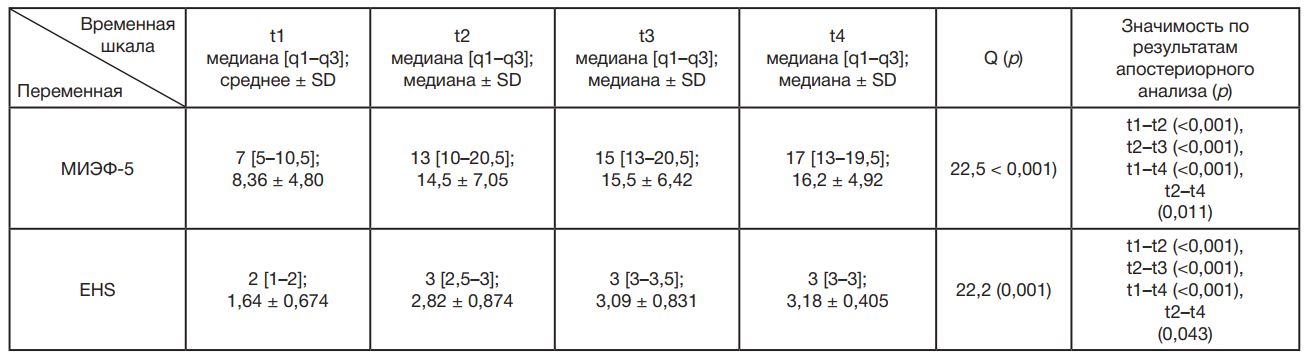
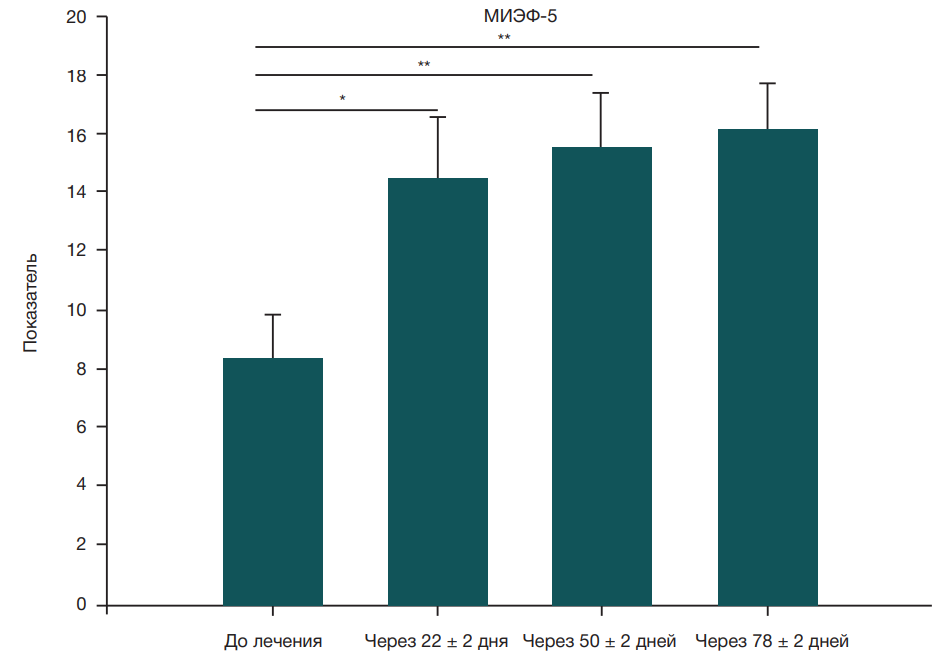
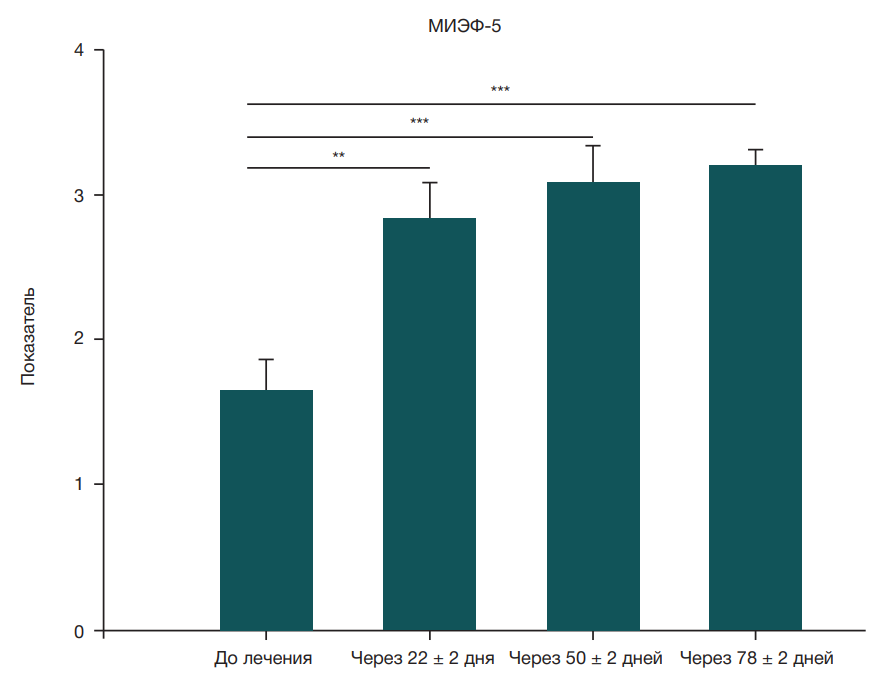
Медианные [q1–q3] и средние (± стандартное отклонение) показатели по шкале МИЭФ-5 (рис. 2) для двух групп, полученные в разное время (до начала лечения и после лечения PRP в комбинации с низкоинтенсивной УВТ), представлены в табл. 2. В группе, получавшей PRP в комбинации с низкоинтенсивной УВТ, медианные [q1–q3] показатели по шкале МИЭФ-5 значимо выросли на временных отрезках t1-t2, t1–t3 и t1-t4 (p < 0,001).
Влияние PRP и низкоинтенсивной УВТ на жесткость полового члена при эрекции
Показатели твердости полового члена при эрекции (EHS) (рис. 3) демонстрировали схожую тенденцию: медианные [q1-q3] показатели значимо выросли на временных отрезках t1-t2, t1–t3 и t1-t4 (p < 0,001), продемонстрировав эффективность применения PRP в комбинации с низкоинтенсивной УВТ в отношении увеличения твердости полового члена при эрекции, составляющей основной компонент эректильной функции.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Низкоинтенсивную УВТ считают более безопасным методом лечения ЭД, особенно в случаях легкой васкулогенной ЭД или сниженной восприимчивости к лечению ингибиторами PDE-5 [6]. Она способствует неоангиогенезу, улучшает кровоснабжение пещеристых тел, уменьшает воспаление и стресс [14]. У пациентов, страдающих сахарным диабетом, низкоинтенсивная УВТ имитирует механическое раздражение, влияет на проницаемость мембран и регулирует сигнальные каскады, что приводит к подавлению воспалительного ответа, выделению оскида азота, мобилизации эндотелиальных и стволовых клеток и улучшению состояния нервных волокон, в которых вырабатывается нейронная NO-синтаза, в пещеристых телах и состояния эндотелия артерий и синусов пещеристых тел [15]. Основываясь на этих данных, можно ожидать усиления всех терапевтических эффектов, прежде всего неоваскуляризации, при добавлении PRP.
PRP содержит большое количество трофических факторов роста и обладающих регенеративными свойствами молекул, которые могут способствовать вовлечению стволовых клеток, ангиогенезу, синтезу оксида азота и регенерации нервных волокон пещеристых тел. В мышиной модели PRP продемонстрировала нейропротекторное и нейрорегенеративное действие, в основе которого лежит снижение экспрессии каспазы-3 и TGF-β1, приводящее в снижению уровня PDGF [16]. Содержащиеся в PRP VEGF и BDNF способствуют регенерации нервных волокон, повышению выработки нейрональной NO-синтазы и росту аксонов [17]. Низкоинтенсивная УВТ также индуцирует экспрессию VEGF и его рецептора Flt-1 (рецептор фактора роста эндотелия сосудов 1) [18], которая может быть усилена с помощью содержащегося в PRP VEGF. Помимо этого BDNF активирует путь JAK-STAT (преобразователи сигналов янускиназы и активаторы транскрипции), способствующий росту нейритов в области тазовых нервных узлов [17, 19]. Содержащиеся в PRP BDNF, IGF-1, VEGF и bFGF эффективно восстанавливали гемодинамику полового члена у модельных животных в ходе доклинических исследований [20].
В нашем исследовании у ряда пациентов имели место артериальная гипертензия, диабет и высокий уровень триглицеридов (табл. 1). Установлено, что 25% и 60% пациентов, проходивших лечение по поводу артериальной гипертензии и диабета, страдали ЭД [21]. С возрастом снижается уровень тестостерона, уменьшается количество гладкомышечных клеток полового члена и эластичных волокон белочной оболочки пещеристых тел, что приводит к ЭД [22]. Эндотелиальная дисфункция вследствие
дислипидемии является значимой причиной ЭД [23]. Помимо этого установлена связь между ЭД и как минимум одним сопутствующим заболеванием, таким как депрессия (11,1%), сахарный диабет (20,2%), гиперлипидемия (42,4%) и артериальная гипертензия (41,6%). Таким образом, наличие у наших пациентов перечисленных выше признаков/демографических особенностей связано с ЭД.
Исследование предполагало применение низкоинтенсивной УВТ в комбинации с лечением PRP для оценки синергического эффекта комбинированного лечения. Исходы лечения, а именно эректильную функцию и твердость полового члена при эрекции, оценивали по показателям МИЭФ-5 и EHS (табл. 2). Медиана изменения показателя по шкале МИЭФ-5 при применении низкоинтенсивной УВТ у пациентов с ЭД составила +3,5 (p = 0,0049) и +1 (p = 0,046) через месяц и год после лечения [24]. Применение низкоинтенсивной УВТ обеспечивало увеличение исходного показателя по шкале МИЭФ-5 с 8,27 ± 2,741 до 10,43 ± 8,43 после месяца лечения, при этом терапевтический эффект сохранялся на том же уровне в течение 6 месяцев [25]. Другое рандомизированное клиническое исследование показало, что еженедельное применение низкоинтенсивной УВТ в течение пяти недель улучшало показатели EHS и МИЭФ-5. Показатель по шкале EHS увеличился на 0,35 и 0,50 балла, а показатель МИЭФ-5 — на 2,40 и 3,45 баллов после 4 и 12 недель лечения [26]. Применение низкоинтенсивной УВТ в течение 14 недель (раз в неделю) с перерывом на 4 недели после 5 недель лечения улучшало показатели по шкале МИЭФ-ЭФ от исходного значения 11,5 баллов до 13 и 12,6 баллов после 5 и 10 сеансов соответственно [27]. Описанные выше исследования продемонстрировали улучшение показателей МИЭФ-5 и EHS в диапазоне между 2–5 и 0,3–2 баллами соответственно. Однако в ходе нашего исследования был зафиксирован прирост на 6–8 баллов по сравнению с исходным показателем по шкале МИЭФ-5 (8,36 ± 1,44), который значимо увеличился до 14,45 ± 2,12, 15,45 ± 1,93 и 16,18 ± 1,48 баллов через 22 ± 2, 50 ± 2 и 78 ± 2 дней лечения соответственно. Аналогичным образом исходный показатель по шкале EHS (1,64 ± 0,20) увеличился до 2,81 ± 0,26, 3,09 ± 0,25 и 3,18 ± 0,12 баллов через 22 ± 2, 50 ± 2 и 78 ± 2 дней лечения соответственно. Эти данные свидетельствуют об улучшении эректильной функции при применении низкоинтенсивной УВТ в комбинации с PRP, что представляет собой лучший результат по сравнению с ранее описанным применением низкоинтенсивной УВТ в качестве монотерапии.
Усиление терапевтического воздействия может быть обусловлено применением PRP, способствующей естественному выздоровлению. При их применении для лечения ЭД показатели по шкале МИЭФ улучшаются без каких-либо нежелательных явлений [28]. Проспективное исследование продемонстрировало значительную эффективность PRP в отношении увеличения показателей по шкале МИЭФ после лечения (p = 0,02) [1]. Однако на вентральной стороне в центральной части ствола полового члена возникает фибротическая бляшка. При этом время интравагинальной задержки семяизвержения значимо улучшилось благодаря комбинированному лечению. Эффективность регенеративной терапии PRP при различных заболеваниях хорошо изучена, она связана с присутствием в PRP факторов роста и других биоактивных молекул. VEGF, представляющий собой компонент PRP, продемонстрировал способность эффективно восстанавливать эректильную функцию в животных моделях повреждения ЧН [29]. Кроме того, двойное слепое рандомизированное плацебо-контролируемое клиническое исследование показало, что благодаря PRP после 6 месяцев лечения была достигнута минимальная клинически значимая разница (MCID) в показателях по шкале МИЭФ-ЭФ (блок об эрекции) [30]. Кроме того, произошел очевидный рост удовлетворения по поводу отсутствия каких-либо нежелательных явлений геморрагического характера.
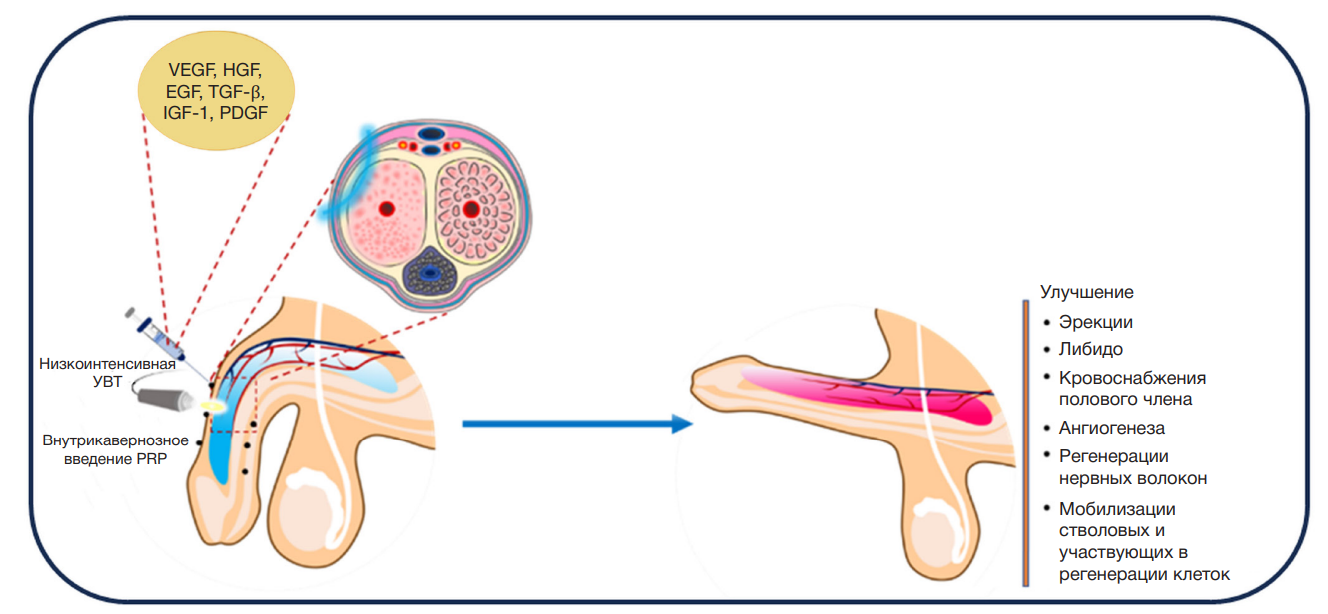
Показано, что PRP улучшает эректильную функцию в крысиной модели диабета за счет ингибирования атрофии гладкомышечных клеток пещеристого тела, защиты пещеристого тела и регенерации волокон ЧН [16]. Кроме того, PRP восстанавливает ткани, улучшает все параменты эректильной функции и обеспечивает регенерацию миелинизированных нервных волокон у крыс с сахарным диабетом [16]. Таким образом, PRP может эффективно минимизировать связанные с сахарным диабетом послеоперационные осложнения при лечении ЭД. Помимо этого лечение PRP значимо улучшает интракавернозное давление, среднее артериальное давление, уровни IGF-1, BDNF и VEGF у крыс с ЭД, ассоциированной с гиперлипидемией [31]. Лечение PRP также улучшает состояние клеток эндотелия, выработку нейронной NO-синтазы и эндотелиальной NO-синтазы клетками пещеристого тела, что приводит к снижению окислительного стресса и индекса апоптоза. Основываясь на полученных результатах, мы сделали вывод, что PRP может улучшить состояние пациентов с ЭД, проходящих лечение с применением низкоинтенсивной УВТ, благодаря ее ранозаживляющему потенциалу в отношении микротравм, полученных во время применения низкоинтенсивной УВТ (рис. 4).
Ограничения исследования
Помимо положительных результатов лечения наше исследование имело ряд ограничений, таких как отсутствие контрольной группы, получающей низкоинтенсивную УВТ, которая будет исследована в будущем. Однако проведенное ранее исследование применения низкоинтенсивной УВТ в качестве монотерапии [32] продемонстрировало эффективность и безопасность как у пациентов с ЭД, страдающих диабетом, так и у пациентов без диабета. Таким образом, ожидается, что применение низкоинтенсивной УВТ в комбинации с PRP обеспечит более высокую терапевтическую эффективность при ЭД. Оценку боли, связанной с инъекциями PRP, также не проводили — это тоже станет предметом наших дальнейших исследований. Еще одним ограничением исследования является малый размер выборок. Однако мы выполнили статистический анализ с применением непараметрического критерия Фридмана для повторных измерений, представляющего собой альтернативу дисперсионному анализу (ANOVA), подходящую для данных, распределение которых отличается от нормального, и небольших выборок. Затем в качестве апостериорного анализа было выполнено попарное сравнение с применением критерия Дарбина– Коновара (альтернатива t-критерию Стьюдента). Тем не менее, рекомендуется повторить исследование на большей выборке. Возраст тоже является значимым фактором поддержания здоровой сексуальной активности. Согласно эпидемиологическим данным, распространенность умеренной эректильной дисфункции (ЭД) и полной импотенции увеличивается с возрастом; показано, что распространенность ЭД составляет 5,1%, 14,8% и 44% у мужчин в возрасте 29–30, 40–59 и 60–69 лет соответственно [33]. Кроме того, ЭД диагностирована у 50% мужчин в возрасте старше 70 лет. По этой причине мы не указали максимальный возраст, однако в нашей выборке максимальный возраст составил 70–71 год, как и в более ранних исследованиях.
ВЫВОДЫ
Исследование продемонстрировало синергический потенциал PRP и низкоинтенсивной УВТ при применении для лечения ЭД, выраженный в увеличении показателей МИЭФ-5 и EHS. Однако усиливающий эффект PRP при применении вместе с низкоинтенсивной УВТ следует подтвердить в ходе широкомасштабных многоцентровых клинических исследований. Кроме того, ввиду отсутствия утвержденных протоколов необходимы дополнительные усилия для разработки эффективной процедуры регенеративного лечения для достижения наилучших клинических результатов.
- Taş T, Çakıroğlu B, Arda E, Onuk Ö, Nuhoğlu B. Early Clinical Results of the Tolerability, Safety, and Efficacy of Autologous Platelet-Rich Plasma Administration in Erectile Dysfunction. Sex Med. 2021; 9: 100313.
- Vance G, Zeigler-Hill V, Shackelford TK. Erectile Dysfunction and Sexual Coercion: The Role of Sperm Competition Risk. Archives of Sexual Behavior. 2022; 51 (6): 2781–90.
- Trebatický B, Žitňanová I, Dvořáková M, Országhová Z, Paduchová Z, Ďuračková Z, et al. Role of oxidative stress, adiponectin and endoglin in the pathophysiology of erectile dysfunction in diabetic and non-diabetic men. Physiol Res. 2019; 68: 623–31.
- Ayta I, McKinlay J, Krane R. The likely worldwide increase in erectile dysfunction between 1995 and 2025 and some possible policy consequences. BJU international. 1999; 84: 50–56.
- Colson MH, Cuzin B, Faix A, Grellet L, Huyghes E. Current epidemiology of erectile dysfunction, an update. Sexologies, 2018; 27: e7–e13.
- Geyik S. Comparison of the efficacy of low-intensity shock wave therapy and its combination with platelet-rich plasma in patients with erectile dysfunction. Andrologia. 2021; 53: e14197.
- Lei H, Liu J, Li H, Wang L, Xu Y, Tian W, et al. Low-Intensity Shock Wave Therapy and Its Application to Erectile Dysfunction. wjmh, 2013; 31: 208–14.
- Liu J, Zhou F, Li G-Y, Wang L, Li H-X, Bai G-Y, et al. Evaluation of the Effect of Different Doses of Low Energy Shock Wave Therapy on the Erectile Function of Streptozotocin (STZ)-Induced Diabetic Rats. International Journal of Molecular Sciences. 2013; 14: 10661–73.
- Sun D, Junger WG, Yuan C, Zhang W, Bao Y, Qin D, et al. Shockwaves Induce Osteogenic Differentiation of Human Mesenchymal Stem Cells Through ATP Release and Activation of P2X7 Receptors. Stem Cells; 2013; 31: 1170–80.
- Mijiritsky E, Assaf HD, Peleg O, Shacham M, Cerroni L, Mangani L. Use of PRP, PRF and CGF in Periodontal Regeneration and Facial Rejuvenation-A Narrative Review. Biology. 2021; 10: 317.
- Bos-Mikich A, de Oliveira R, Frantz N. Platelet-rich plasma therapy and reproductive medicine. Journal of Assisted Reproduction and Genetics. 2018; 35: 753–6.
- Mark KP, Arenella K, Girard A, Herbenick D, Fu J, Coleman E. Erectile dysfunction prevalence in the United States: report from the 2021 National Survey of Sexual Wellbeing. J Sex Med. 2024; 21: 296–303.
- Mulhall JP, Goldstein I, Bushmakin AG, Cappelleri JC, Hvidsten K. Validation of the Erection Hardness Score. The Journal of Sexual Medicine. 2007; 4: 1626–34.
- Sokolakis I, Dimitriadis F, Teo P, Hatzichristodoulou G, Hatzichristou D, Giuliano F. The Basic Science Behind Low-Intensity Extracorporeal Shockwave Therapy for Erectile Dysfunction: A Systematic Scoping Review of Pre-Clinical Studies. J Sex Med. 2019; 16: 168–94.
- Spivak L, Shultz T, Appel B, Verze P, Yagudaev D, Vinarov A. Low-Intensity Extracorporeal Shockwave Therapy for Erectile Dysfunction in Diabetic Patients. Sex Med Rev. 2021; 9: 619–27.
- Liao C-H, Lee K-H, Chung S-D, Chen K-C, Praveen Rajneesh C, Chen B-H, et al. Intracavernous Injection of Platelet-Rich Plasma Therapy Enhances Erectile Function and Decreases the Mortality Rate in Streptozotocin-Induced Diabetic Rats. International journal of molecular sciences. 2022; 23: 3017.
- Ding X-G, Li S-W, Zheng X-M, Hu L-Q, Hu W-L, Luo Y. The effect of platelet-rich plasma on cavernous nerve regeneration in a rat model. Asian journal of andrology. 2009; 11: 215–21.
- Vardi Y, Appel B, Jacob G, Massarwi O, Gruenwald I. Can low-intensity extracorporeal shockwave therapy improve erectile function? A 6-month follow-up pilot study in patients with organic erectile dysfunction. Eur Urol. 2010; 58: 243–8.
- Bella AJ, Lin G, Tantiwongse K, Garcia M, Lin CS, Brant W, et al. Brain–derived neurotrophic factor (BDNF) acts primarily via the JAK/STAT pathway to promote neurite growth in the major pelvic ganglion of the rat: Part I. The journal of sexual medicine. 2006; 3: 815–20.
- Huang Y-C, Wu C-T, Chen M-F, Kuo Y-H, Li J-M, Shi C-S. Intracavernous Injection of Autologous Platelet-Rich Plasma Ameliorates Hyperlipidemia-Associated Erectile Dysfunction in a Rat Model. Sexual Medicine. 2021; 9: 100317.
- Hafez ES, Hafez SD. Erectile dysfunction: anatomical parameters, etiology, diagnosis, and therapy. Arch Androl. 2005; 51: 15–31.
- Seftel AD. Erectile dysfunction in the elderly: epidemiology, etiology and approaches to treatment. J Urol. 2003; 169: 1999–2007.
- Miner M, Billups KL. Erectile Dysfunction and Dyslipidemia: Relevance and Role of Phosphodiesterase Type-5 Inhibitors and Statins. The Journal of Sexual Medicine. 2008; 5: 1066–78.
- Frey A, Sønksen J, Fode M. Low-intensity extracorporeal shockwave therapy in the treatment of postprostatectomy erectile dysfunction: a pilot study. Scand J Urol. 2016; 50: 123–7.
- Akande TO, Akinwunmi OM, Adebayo SA, Akinyinka AO, Shittu OB. Efficacy and safety of low-intensity extracorporeal shockwave therapy for treatment of vascular erectile dysfunction in nigerian men: Report of a study in Ibadan, South-West Nigeria. Ann Ib Postgrad Med. 2021; 19: 8–14.
- Ladegaard PBJ, Mortensen J, Skov-Jeppesen SM, Lund L. Erectile Dysfunction A Prospective Randomized Placebo-Controlled Study Evaluating the Effect of Low-Intensity Extracorporeal Shockwave Therapy (LI-ESWT) in Men With Erectile Dysfunction Following Radical Prostatectomy. Sex Med. 2021; 9: 100338.
- Fojecki GL, Tiessen S, Osther PJS. Effect of Low-Energy Linear Shockwave Therapy on Erectile Dysfunction—A DoubleBlinded, Sham-Controlled, Randomized Clinical Trial. The Journal of Sexual Medicine. 2017; 14: 106–12.
- Banno JJ, Kinnick TR, Roy L, Perito P, Antonini G, Banno D. 146 The Efficacy of Platelet-Rich Plasma (PRP) as a Supplemental Therapy for the Treatment of Erectile Dysfunction (ED): Initial Outcomes. The Journal of Sexual Medicine. 2017; 14: e59–e60.
- Chen KC, Minor TX, Rahman NU, Ho HC, Nunes L, Lue TF. The additive erectile recovery effect of brain–derived neurotrophic factor combined with vascular endothelial growth factor in a rat model of neurogenic impotence. BJU international. 2005; 95: 1077–80.
- Poulios E, Mykoniatis I, Pyrgidis N, Zilotis F, Kapoteli P, Kotsiris D, et al. Platelet-Rich Plasma (PRP) Improves Erectile Function: A Double-Blind, Randomized, Placebo-Controlled Clinical Trial. The Journal of Sexual Medicine. 2021; 18: 926–35.
- Huang Y-C, Wu C-T, Chen M-F, Kuo Y-H, Li J-M, Shi C-S. Intracavernous Injection of Autologous Platelet-Rich Plasma Ameliorates Hyperlipidemia-Associated Erectile Dysfunction in a Rat Model. Sexual medicine. 2021; 9: 100317.
- Geyik S. A single-centre result of two courses of low-intensity shockwave therapy (Li-SWT) in erectile dysfunction. Andrologia. 2022; 54: e14324.
- Pang K, Pan D, Xu H, Ma Y, Wang J, Xu P, et al. Advances in physical diagnosis and treatment of male erectile dysfunction. Front Physiol. 2022; 13: 1096741.