ОБЗОР
Биогенез и функционирование микроРНК: 30 лет после их открытия
1 Национальный медицинский исследовательский центр кардиологии им. ак. Е. И. Чазова, Москва
2 Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва
Описана роль микроРНК (малых некодирующих РНК) в регуляции экспрессии генов. Связываясь с мРНК-мишенями, микроРНК контролируют экспрессию кодирующих эти мРНК генов на посттранскрипционном уровне, участвуя в физиологических и патологических процессах от эмбриогенеза до опухолевых заболеваний. С момента открытия этих молекул в 1993 г. различные научные группы исследуют функции и механизмы действия микроРНК. В статье рассмотрены пути биогенеза микроРНК, способы взаимодействия микроРНК с мРНК-мишенями и механизмы подавления трансляции и деградации мРНК. Результаты многочисленных исследований показали, что микроРНК можно использовать в медицине в качестве биомаркеров в диагностических и прогностических целях. Разработки в области терапии с использованием микроРНК открывают перспективы для лечения заболеваний, при которых нарушение регуляции генов играет ключевую роль.
Ключевые слова: диагностика, микроРНК, терапия, регуляция экспрессии генов, биогенез микроРНК, прогноз течения заболеваний
Финансирование: исследование выполнено в рамках Государственного задания ФГБУ Национальный медицинский исследовательский центр кардиологии им. ак. Е. И. Чазова Минздрава России (№ 124020200013-3).
Вклад авторов: М. В. Писклова — сбор, анализ и систематизация литературных данных, планирование и написание первичного текста, подбор рисунков; Н. М. Баулина, О. О. Фаворова — планирование, структурирование текста статьи, редактирование; Н. А. Матвеева — анализ и систематизация литературных данных, написание статьи.
Для корреспонденции: Мария Владиславовна Писклова
ул. Академика Чазова, д. 15А, г. Москва, 121552, Россия; ur.liam@airam_avolksip
В 1993 г. была описана короткая РНК нематоды Caenorhabditis elegans, которая не кодировала белок, но играла ключевую роль в регуляции развития нематоды, подавляя трансляцию мРНК белка LIN-14 [1, 2]. Эта малая РНК, названная lin-4, стала первой обнаруженной короткой РНК с регуляторными свойствами. В 2000 г. у Caenorhabditis elegans обнаружили вторую короткую РНК — let-7 с аналогичным механизмом действия [3]. С этого момента началось бурное изучение нового типа малых некодирующих РНК длиной 21–24 нуклеотида, названных микроРНК (miRNA), открытие которых значительно повлияло на устоявшиеся представления о регуляции работы генов. Если до этого открытия были известны основные механизмы регуляции процессов транскрипции и сплайсинга РНК, осуществляемые специальными белками в ядре, то теперь к ним добавилось представление о последующем контроле экспрессии генов в цитоплазме с помощью микроРНК. Этот механизм имеет фундаментальное значение для развития и функционирования всех типов клеток и заключается в регуляции экспрессии генов-мишеней посредством взаимодействия с их мРНК на посттранскрипционном уровне. Присутствие молекул микроРНК обнаружено у разных видов эукариот, включая растения и животных, а также у некоторых вирусов [4]. В 2024 г. В. Эмбросу и Г. Равкану присуждена Нобелевская премия по физиологии или медицине «за открытие микроРНК и их роли в посттранскрипционной регуляции гена».
За прошедшие годы установлено, что многочисленные микроРНК регулируют практически все физиологические и патологические процессы: от первых стадий эмбриогенеза до старения и смерти организма. Рассмотрим современное состояние знаний о биогенезе и функционировании микроРНК.
Распространенность микроРНК и их номенклатура
По данным последней версии miRBase, базы данных последовательностей и аннотаций микроРНК, на 17.03.2024 всего у 271 вида найдено 48 860 зрелых микроРНК, из них 2654 идентифицированы в организме человека. Число обнаруженных микроРНК продолжает расти. Спектр микроРНК, присутствующих у того или иного организма, напрямую зависит от сложности его строения [5]. Эволюционно родственные микроРНК объединены в различные семейства (у человека их 267), члены которых имеют высокогомологичные последовательности и некоторые общие мишени. Показана высокая консервативность нуклеотидных последовательностей некоторых микроРНК (в первую очередь в области связывания с мРНК-мишенью) в филогенезе. В целом, эволюция микроРНК тесно связана с эволюцией геновмишеней [5].
МикроРНК нумеруют последовательно в порядке их открытия. Экспериментально подтвержденным зрелым микроРНК присваивают номер, который присоединяется к префиксу «miR» через дефис (например, miR-499). Перед «miR» может стоять трехбуквенное сокращение, указывающее на вид (например, для Homo sapiens — «hsa», для Mus musculus — «mmu»). К одинаковым по последовательности микроРНК, считывающимся с разных областей генома, добавляют числовой суффикс с порядковым номером, например, hsa-miR-219-1 и hsamiR-219-2. К названиям микроРНК, последовательности которых отличаются незначительно (на 1–2 нуклеотида), прибавляют буквенный суффикс, например, hsa-miR-130a и hsa-miR-130b; они формируют семейства. МикроРНК, гены которых физически расположены недалеко друг от друга и зачастую транскрибируются как единое целое, объединяют в кластеры, которые именуют либо по наименьшему номеру микроРНК в кластере (например, кластер miR-17), либо по наименьшему и наибольшему номерам микроРНК через дефис (кластер miR-17-92, состоящий из miR-17, miR-91, miR-18, miR-19, miR-19b, miR-20 и miR-92) [6].
Гены и биогенез микроРНК
Гены микроРНК в зависимости от их локализации относительно элементов генома можно отнести к межгенным, интронным и экзонным. Около 50% генов известных микроРНК расположены внутри белок-кодирующих и белок-некодирующих генов (гены-хозяева), по большей части в интронах и реже в экзонах. Гены микроРНК могут транскрибироваться как с самостоятельных промоторов, так и с промотора гена-хозяина [7]. Новые гены микроРНК образуются или в результате дупликации существующих генов микроРНК (так происходит в большинстве случаев), или de novo из шпилечных структур, расположенных внутри интронов или межгенных областей [8]. Структуры de novo возникают посредством различных механизмов: 1) инвертированной дупликации гена, который впоследствии станет мишенью микроРНК; 2) из генов транспозонов; 3) спонтанной эволюции из случайных последовательностей [8].
Наиболее распространенный путь биогенеза микроРНК получил название канонического. Помимо него, описаны другие пути образования микроРНК, в которых участвуют другие белки и пропущены один или несколько этапов канонического биогенеза; их называют неканоническими [9].
Канонический путь биогенеза микроРНК
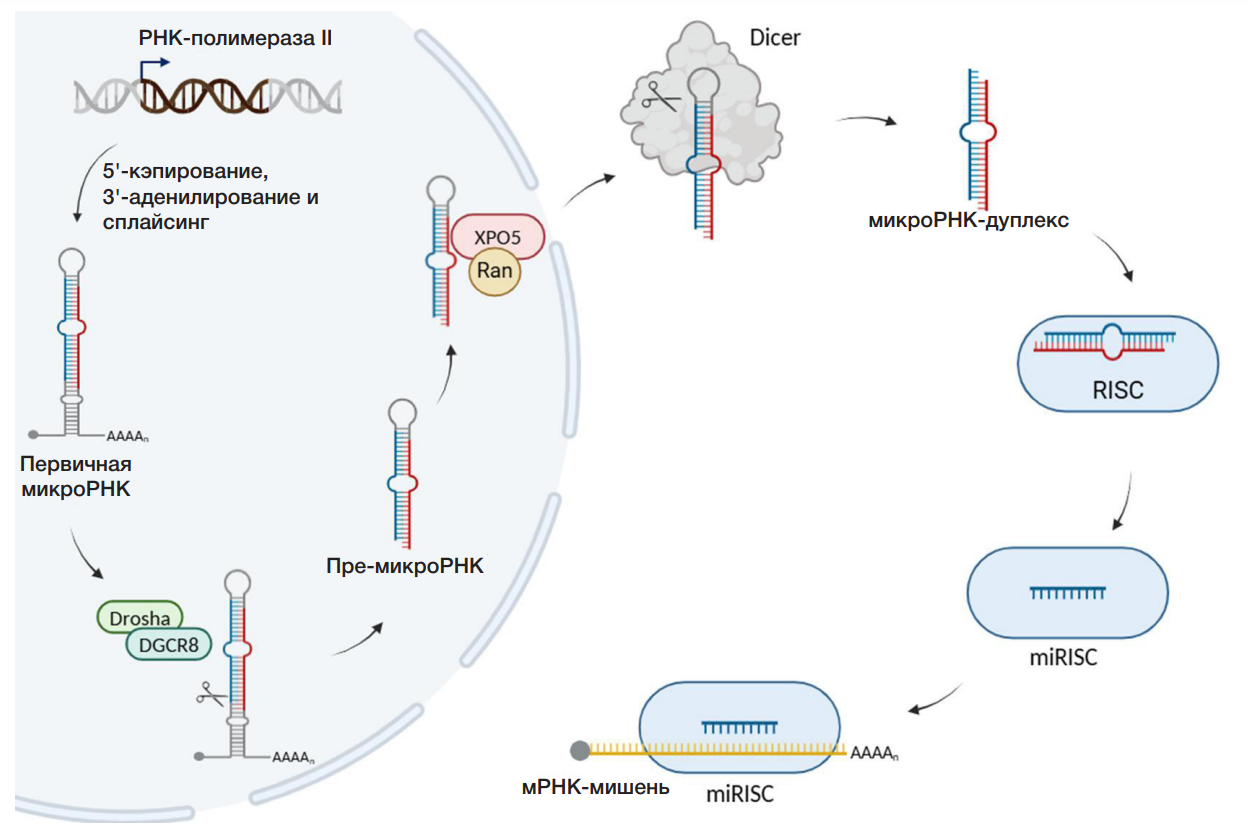
У животных в каноническом варианте с гена микроРНК с помощью РНК-полимеразы II транскрибируется первичная микроРНК (pri-miRNA, primary miRNA), которая затем подвергается 5'-кэпированию, 3'-полиаденилированию и сплайсингу (рис. 1).
Далее микропроцессорный комплекс, состоящий из рибонуклеазазы III (Drosha) и белка DGCR8 (DiGeorge Syndrome Critical Region 8, он же Pasha — Partner of Drosha), разрезает первичную микроРНК до пре-микроРНК (предшественник микроРНК, precursor miRNA, pre-miRNA) длиной 70–120 нуклеотидов. Пре-микроРНК представляет собой шпильку, состоящую из одноцепочечного участка (терминальная петля) и двуцепочечного стебля со свободно выступающими двумя нуклеотидами на 3'-конце. Выступающие нуклеотиды распознаются белком экспортином-5 (XPO5), который при участии ГТФсвязывающего белка Ran переносит пре-микроРНК из ядра в цитоплазму. В цитоплазме (рис. 1, справа) рибонуклеаза III Dicer вырезает из пре-микроРНК терминальную петлю, в результате чего образуется дуплекс из двух зрелых микроРНК длиной 21–24 нуклеотида [10]. В зависимости от положения зрелой цепи микроРНК в шпильке пре-микроРНК их названия сопровождаются суффиксами -3p или -5p (например, цепь hsa-miR-25-5p локализована на 5'-конце пре-микроРНК hsa-miR-25, а цепь hsa-miR25-3p — на 3'-конце). После вырезания терминальной петли дуплекс микроРНК связывается с белком семейства Argonaute (AGO) в составе комплекса RISC (RNA-induced silencing complex, РНК-индуцированный комплекс сайленсинга генов) — так образуется промежуточный пре-RISC-комплекс. Одна из двух цепей РНК-дуплекса диссоциирует и, как правило, подвергается деградации, а другая остается в составе комплекса miRISC. Цепь, оставшуюся в составе этого комплекса, называют направляющей, а диссоциирующую — пассажирской [10]. Далее происходит связывание направляющей цепи микроРНК в составе комплекса miRISC с мРНК-мишенью.
У растений канонический путь несколько отличается от такового у животных. При-микроРНК процессируется в ядре сразу до микроРНК-дуплекса с помощью белкагомолога Dicer, DICER-LIKE 1 (DCL1), который отвечает за оба события процессинга, необходимые для созревания микроРНК [4]. Предшественник стеблевой петли у растений длиннее и более изменчив. В отличие от билатеральных животных, у растений микроРНК подвергаются метилированию с помощью белка HEN1.
Неканонические пути биогенеза микроРНК
В процессинге при неканонических (альтернативных) путях созревания микроРНК принимают участие не все белки канонического пути. Выделяют Drosha- и DGSR8независимые (микропроцессор-независимые) и Dicerнезависимые пути биогенеза микроРНК. В большинстве Drosha-независимых путей предшественники микроРНК являются побочными продуктами процессинга других РНК (например, малой ядерной РНК или транспортной РНК) и не требуют гидролиза микропроцессорным комплексом [11]. При Dicer-независимом процессинге осуществляется гидролиз при-микроРНК микропроцессорным комплексом, но получающийся в итоге стебель шпилечной структуры слишком короток для узнавания Dicer. Вследствие этого предшественник микроРНК напрямую загружается на белок AGO, который надрезает одну из цепей микроРНК, а затем полученный при помощи poly(А)-специфичной рибонуклеазы (PARN) промежуточный продукт укорачивается до получения зрелой молекулы [10].
Выбор функционально активной цепи микроРНК
Выбор направляющей цепи между цепями -5p и -3p связан с термодинамической нестабильностью дуплекса и нуклеотидным составом микроРНК [12]. 5'-конец микроРНК-дуплекса встраивается в специальный карман, сформированный доменами MID и PIWI белка AGO. Эти домены чувствительны к нуклеотидному составу дуплекса и связывают урацил в два раза сильнее, чем аденин, и в 30 раз сильнее, чем цитозин или гуанин, т. е. предпочтение отдается цепи, богатой урацилом на 5'-конце. AGO также, по-видимому, предпочитает загружать ту цепь дуплекса, которая имеет более низкую относительную термодинамическую стабильность. Считается, что за термодинамическую стабильность отвечают первые четыре нуклеотида на каждом конце дуплекса, а разница в одну дополнительную водородную связь на одном из концов достаточна, чтобы повлиять на выбор направляющей и пассажирской цепей. Как правило, 5'-концы деградирующих пассажирских цепей богаты пиримидином, а направляющих цепей — пуринами [12].
Распознавание и связывание мРНК-мишени молекулой микроРНК
Комплекс miRISC, связанный с мРНК-мишенью, взаимодействует с белком GW182 (белок, содержащий глицин-триптофановый повтор 182 кДа). GW182 действует как молекулярный каркас для соединения белка AGO в составе комплекса miRISC и нижестоящих эффекторных комплексов, участвующих в микроРНК-опосредованной трансляционной репрессии мРНК-мишени [7].
Для облегчения распознавания и связывания мРНКмишеней белок AGO позиционирует направляющую цепь микроРНК в пространстве. Участок направляющей цепи микроРНК со второго по седьмой нуклеотид на 5′-конце называют затравочной областью (seed region); он отвечает за связывание мРНК-мишени и имеет решающее значение для ее распознавания [13]. В распознавании участвуют также нуклеотиды 8 и 13–16 последовательности микроРНК [10]. Обычно в молекуле мРНК-мишени сайт связывания с miRISC находится в 3'-нетранслируемой области (3'-UTR). Описаны достаточно редкие неканонические сайты связывания в кодирующей и 5'-UTR областях мРНК, взаимодействуя с которыми микроРНК также подавляют трансляцию мРНК. В ряде случаев микроРНК могут взаимодействовать с промоторной областью генов, активируя их транскрипцию [14].
Механизмы микроРНК-опосредованного подавления экспрессии генов
Как сказано выше, распознавание молекулой микроРНК мРНК-мишени, как правило, приводит к подавлению трансляции этой мРНК. При полной комплементарности, наблюдаемой преимущественно у растений, мРНК-мишень разрезается внутри miRISC белком AGO, обладающим эндонуклеазной активностью РНКазы Н, в участке, комплементарном нуклеотидам 10 и 11 направляющей цепи микроРНК (эндонуклеазное расщепление мРНК) [4, 15]. В большинстве клеток животных сайты связывания в мРНК не полностью комплементарны затравочной области микроРНК. В этом случае инициируются miRISCопосредованные репрессия трансляции и дестабилизация мРНК-мишени с ее последующей деградацией [7].
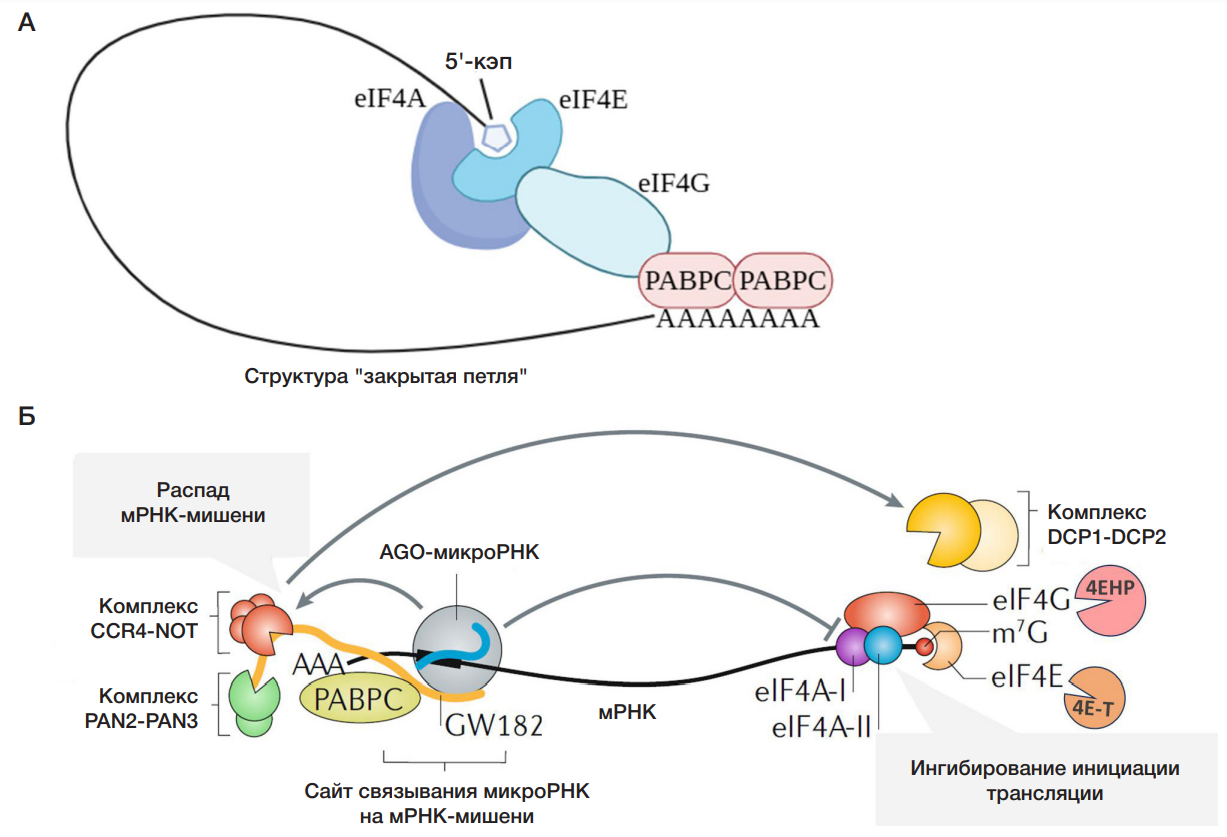
Хотя точные механизмы этих процессов у млекопитающих остаются предметом изучения, общепризнанно мнение, что поначалу происходит репрессия трансляции, а позже — дестабилизация и распад мРНК-мишени [16]. Описано несколько механизмов репрессии трансляции, один из которых — ингибирование формирования «закрытой петли» мРНК-мишени (рис. 2A). Белок PABPC, связанный с 3′-поли(A)-хвостом мРНК-мишени, стабилизирует взаимодействие 5′-кэпа с комплексом фактора инициации трансляции эукариот 4F, состоящего из eIF4A, eIF4G и eIF4E, посредством связывания с eIF4G. Концы мРНК сближаются, и образуется структура «закрытая петля», облегчающая инициацию трансляции и рециклинг рибосом.
Белок AGO в составе miRISC-комплекса вызывает диссоциацию белка PABPС, что приводит к нарушению формирования «закрытой петли» и ингибированию инициации трансляции. К другим механизмам относят ингибирование инициации трансляции мРНК за счет препятствия сборке комплекса фактора инициации трансляции эукариот 4F. Они включают привлечение miRISC-комплексом ингибиторов трансляции 4E-T и 4EHP с последующей диссоциацией eIF4E и eIF4G или диссоциацию субъединицы eIF4A (рис. 2Б, справа). Механизмы не являются взаимоисключающими и могут работать одновременно с разной скоростью. Преобладание конкретного механизма зависит от природы отдельных мРНК-мишеней и типа клеток [16]. После репрессии трансляции происходит дестабилизация мРНК-мишени, включающая деаденилирование и декэпирование с последующей экзонуклеолитической деградацией мРНК (микроРНК-опосредованный распад мРНК-мишени) (рис. 2Б, слева). Вначале белки семейства AGO рекрутируют белок GW182, который, взаимодействуя с поли(А)-связывающим белком РАВРC, вызывает его диссоциацию от поли(А)-хвоста мРНК. Это увеличивает доступность поли(А)-хвоста мРНК для деаденилаз CCR4NOT и PAN2-PAN3, которые также привлекаются белком GW182. В результате происходит деаденилирование мРНК. Кроме того, комплекс CCR4-NOT привлекает белки DCP1 и DCP2, декэпирующие мРНК-мишени, что делает их доступными для деградации экзонуклеазой XRN1 [16].
МикроРНК свойственна избыточность (или вырожденность): уровень экспрессии одной мРНК могут регулировать разные микроРНК, для которых есть свои сайты посадки. При этом микроРНК обладает плейотропностью: одна микроРНК может взаимодействовать с разными мРНК-мишенями. У животных за счет часто встречающейся неполной комплементарности у одной микроРНК гораздо больше мишеней, чем у растений [4]. Сочетание этих свойств приводит к формированию сложной микроРНКопосредованной регуляторной сети.
Локализация микроРНК в клетке
Ранее предполагалось, что микроРНК выполняет свою функцию только в цитоплазме. Однако недавние исследования показали, что цитоплазматический комплекс miRISC может быть импортирован в ядро [18]. Ядерный miRISC-комплекс по составу либо аналогичен цитоплазматическому, либо может существовать в виде отдельного комплекса AGO-микроРНК. Ядерный miRISC связывается с комплементарными ядерными транскриптами или, в отсутствие таковых, снова экспортируется в цитоплазму. Накопление микроРНК в цитоплазме или в ядре частично определяется локализацией ее мРНК-мишеней. В ядре микроРНК может выполнять ряд функций: 1) регуляцию экспрессии генов путем связывания с их промотором; 2) связывание и подавление функции длинных некодирующих РНК; 3) нарушение биогенеза микроРНК посредством связывания с при-микроРНК; 4) точную настройку экспрессии мРНКмишени за счет удержания микроРНК в ядре [19].
Известно, что микроРНК могут высвобождаться из клетки, переноситься с током крови и воздействовать на другие клетки организма, опосредуя межклеточную коммуникацию. Вне клетки микроРНК могут находиться в составе мембранных пузырьков — экзосом, микровезикул, а также в апоптотических тельцах, которые образуются в результате гибели клеток. Во внеклеточной среде большая часть микроРНК (90%) переносится белками AGO, остальные 10% циркулируют в комплексе с липопротеинами высокой плотности [20].
Вовлеченность микроРНК в физиологические и патологические процессы в клетке
МикроРНК регулируют практически все процессы в клетке: метаболизм, прохождение по клеточному циклу, пролиферацию, дифференцировку и апоптоз, поэтому нарушение их регуляторных свойств может приводить к различным заболеваниям [21]. Действительно, изменения в уровнях микроРНК у человека наблюдаются при широком спектре патологий: при опухолевых, сердечно-сосудистых, неврологических и аутоиммунных заболеваниях, воспалении, заболеваниях желудочно-кишечного тракта и скелетной мускулатуры [22]. С момента открытия микроРНК их роль активно исследуют в контексте различных патологий, и на данный момент накоплены сведения о том, уровни каких микроРНК наиболее часто изменяются в пораженных тканях при определенных состояниях, какие из микроРНК обладают протективным эффектом, а какие — наоборот, способствуют формированию патологического фенотипа.
МикроРНК изучают как непосредственно в образцах тканей пациентов, так и в экспериментах in vivo, in vitro, а также in silico, используя последний подход для построения предварительных гипотез. Среди всех биологических материалов пациентов для исследования роли микроРНК в этиопатогенезе лучше всего подходят биоптаты пораженных тканей, однако их получение связано с инвазивным вмешательством, и, как правило, они труднодоступны. В связи с этим чаще всего объектом исследования становятся циркулирующие микроРНК. Это микроРНК, которые в результате повреждения тканей, апоптоза, некроза или активной секреции из клеток высвобождаются во внеклеточное пространство и циркулируют в организме [7]. Такие микроРНК обнаруживаются в плазме и сыворотке крови, моче, слезах, слюне, в семенной, перитонеальной и спинномозговой жидкостях, грудном молоке и бронхиальных лаважах [7]. Они могут регулировать активность клеток-мишеней, выступая тем самым в качестве межклеточных сигнальных молекул. Например, секретируемые из эндотелия микроРНК регулируют активность гладкомышечных клеток сосудов, а онкогенные микроРНК в экзосомах увеличивают инвазивность клеток рака молочной железы [23, 24].
Циркулирующие микроРНК стабильны при высоких pH и температуре и устойчивы к деградации, поэтому представляются привлекательными кандидатами для использования в качестве биомаркеров. И действительно, имеются работы, в которых эти циркулирующие молекулы используют для дифференциальной диагностики, ранней диагностики, прогноза течения заболеваний, оценки тяжести патологии или для контроля ответа на терапию [25]. Поскольку микроРНК могут регулировать трансляцию нескольких мРНК-мишеней, некоторые авторы предлагают оценивать диагностическую способность не одной определенной микроРНК, а набора микроРНК (сигнатур), который будет более специфичным для заболевания [26]. Например, оценка уровня набора из трех микроРНК в моче при волчаночном нефрите позволяет выявить ранний фиброз почек и прогнозировать развитие почечной недостаточности [27].
Использование микроРНК для терапевтических целей основано либо на восполнении уровней необходимых микроРНК с помощью введения соответствующих синтетических аналогов (миметиков микроРНК), либо на ингибировании целевых микроРНК путем введения антисмысловых микроРНК или же микроРНК-губок (их еще называют «конкурирующие эндогенные РНК») — транскриптов псевдогенов, длинных некодирующих РНК, кольцевых РНК и мРНК, которые связывают пул микроРНК, конкурируя с их мишенями. Так, miR-34a подавляет экспрессию более 30 онкогенов, участвующих в уклонении опухолевых клеток от иммунной системы. Поскольку экспрессия этой микроРНК часто снижена при различных злокачественных опухолях, был разработан синтетический миметик miR-34a, MRX34, для лечения злокачественных опухолей кожи, легких, почек и печени [28]. В настоящее время у ряда биофармацевтических компаний (Santaris Pharma, Roche Pharmaceuticals, Regulus therapeutics, Mirna Therapeutics Inc., miRagen Therapeutics и EnGeneIC) имеются программы применения микроРНК для терапии опухолей. Хотя несколько клинических испытаний микроРНК как потенциальных лекарственных средств было прекращено из-за серьезных побочных эффектов и токсичности, исследования применения микроРНК в терапевтической практике продолжаются и вселяют большие надежды [29].
ЗАКЛЮЧЕНИЕ
30 лет со времени открытия микроРНК — это немалый срок, в течение которого число исследований микроРНК неуклонно возрастало. Накопленные за это время данные не только расширили наши знания о механизмах регуляции активности генов, но и открыли новые горизонты в понимании их роли в физиологических и патологических процессах, протекающих в организме. При многих патологиях микроРНК могут служить в качестве надежных биомаркеров, а в ряде случаев модуляция активности микроРНК используется для терапии различных заболеваний. Однако всесторонний анализ участия отдельных микроРНК в клеточных процессах или в патогенезе конкретных заболеваний выходит за рамки нашей работы. Мы постарались познакомить читателя с широким спектром возможностей, которыми обладают эти малые РНК, и с перспективами их дальнейшего изучения и использования.
- Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993; 75 (5): 843–54. DOI:10.1016/0092-8674(93)90529-Y
- Wightman B, Ha I, Ruvkun G. Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell. 1993; 75 (5): 855–62. DOI: 10.1016/0092-8674(93)90530-4.
- Reinhart BJ, Slack FJ, Basson M, Pasquinelli AE, Bettinger JC, Rougvie AE, et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature. 2000; 403 (6772): 901–06. DOI: 10.1038/35002607.
- Moran Y, Agron M, Praher D, Technau U. The evolutionary origin of plant and animal microRNAs. Nat Ecol Evol. 2017; 1 (3): 27. DOI: 10.1038/s41559-016-0027.
- Dexheimer PJ, Cochella L. MicroRNAs: From Mechanism to Organism. Front Cell Dev Biol. 2020; 8: 409. DOI: 10.3389/fcell.2020.00409.
- Bhaskaran M, Mohan M. MicroRNAs: History, Biogenesis, and Their Evolving Role in Animal Development and Disease. Vet pathol. 2013; 51 (4): 759. DOI: 10.1177/0300985813502820.
- O’Brien J, Hayder H, Zayed Y, Peng C. Overview of MicroRNA Biogenesis, Mechanisms of Actions, and Circulation. Front Endocrinol (Lausanne). 2018; 9: 402. DOI: 10.3389/fendo.2018.00402.
- Liu N, Okamura K, Tyler DM, Phillips MD, Chung WJ, Lai EC. The evolution and functional diversification of animal microRNA genes. Cell Res. 2008; 18 (10): 985. DOI: 10.1038/cr.2008.278.
- Abdelfattah AM, Park C, Choi MY. Update on non-canonical microRNAs. Biomol Concepts. 2014; 5 (4): 275. DOI: 10.1515/bmc-2014-0012.
- Treiber T, Treiber N, Meister G. Regulation of microRNA biogenesis and its crosstalk with other cellular pathways. Nat Rev Mol Cell Biol. 2019; 20 (1): 5–20. DOI: 10.1038/s41580-018-0059-1.
- Yang JS, Lai EC. Alternative miRNA biogenesis pathways and the interpretation of core miRNA pathway mutants. Mol Cell. 2011; 43 (6): 892–903. DOI: 10.1016/j.molcel.2011.07.024.
- Medley JC, Panzade G, Zinovyeva AY. microRNA strand selection: Unwinding the rules. Wiley Interdiscip Rev RNA. 2021; 12 (3): e1627. DOI: 10.1002/wrna.1627.
- Agarwal V, Bell GW, Nam JW, Bartel DP. Predicting effective microRNA target sites in mammalian mRNAs. Elife. 2015; 4: e05005. DOI: 10.7554/eLife.05005.
- Broughton JP, Lovci MT, Huang JL, Yeo GW, Pasquinelli AE. Pairing beyond the Seed Supports MicroRNA Targeting Specificity. Mol Diseases. Avicenna J Med Biotechnol. 2010; 2 (4): 161.
- Pratt AJ, MacRae IJ. The RNA-induced Silencing Complex: A Versatile Gene-silencing Machine. J Biol Chem. 2009; 284 (27): 17897. DOI:10.1074/jbc.R900012200.
- Iwakawa HO, Tomari Y. Life of RISC: Formation, action, and degradation of RNA-induced silencing complex. Mol Cell. 2022; 82 (1): 30–43. DOI: 10.1016/j.molcel.2021.11.026.
- Gebert LFR, MacRae IJ. Regulation of microRNA function in animals. Nat Rev Mol Cell Biol. 2019; 20 (1): 21–37. DOI: 10.1038/s41580-018-0045-7.
- Wong JJL, Ritchie W, Gao D, Lau KA, Gonzalez M, Choudhary A, et al. Identification of nuclear-enriched miRNAs during mouse granulopoiesis. J Hematol Oncol. 2014; 7: 42. DOI: 10.1186/1756-8722-7-42.
- Hu X, Yin G, Zhang Y, Zhu L, Huang H, Lv K. Recent advances in the functional explorations of nuclear microRNAs. Front Immunol. 2023; 14: 1097491. DOI: 10.3389/fimmu.2023.1097491.
- Creemers EE, Tijsen AJ, Pinto YM. Circulating microRNAs: novel biomarkers and extracellular communicators in cardiovascular disease? Circ Res. 2012; 110 (3): 483–95. DOI: 10.1161/CIRCRESAHA.111.247452.
- Ardekani AM, Naeini MM. The Role of MicroRNAs in Human Diseases. Avicenna J Med Biotechnol. 2010; 2 (4): 161.
- Paul P, Chakraborty A, Sarkar D, Langthasa M, Rahman M, Bari M, et al. Interplay between miRNAs and human diseases. J Cell Physiol. 2018; 233 (3): 2007–18. DOI: 10.1002/jcp.25854.
- Zhu JJ, Liu YF, Zhang YP, Zhao CR, Yao WJ, Li YS, et al. VAMP3 and SNAP23 mediate the disturbed flow-induced endothelial microRNA secretion and smooth muscle hyperplasia. Proc Natl Acad Sci U S A. 2017; 114 (31): 8271. DOI: 10.1073/pnas.1700561114.
- Yang M, Chen J, Su F, Yu B, Su F, Lin L, et al. Microvesicles secreted by macrophages shuttle invasion-potentiating microRNAs into breast cancer cells. Mol Cancer. 2011; 10: 117. DOI: 10.1186/1476-4598-10-117.
- Ho PTB, Clark IM, Le LTT. MicroRNA-Based Diagnosis and Therapy. Int J Mol Sci. 2022; 23 (13): 7167. DOI: 10.3390/ijms23137167.
- Backes C, Meese E, Keller A. Specific miRNA Disease Biomarkers in Blood, Serum and Plasma: Challenges and Prospects. Mol Diagn Ther. 2016; 20 (6): 509–18. DOI: 10.1007/s40291-016-0221-4.
- Solé C, Moliné T, Vidal M, Ordi-Ros J, Cortés-Hernández J. An Exosomal Urinary miRNA Signature for Early Diagnosis of Renal Fibrosis in Lupus Nephritis. Cells. 2019; 8 (8): 773. DOI: 10.3390/cells8080773.
- Beg MS, Brenner AJ, Sachdev J, Borad M, Kang YK, Stoudemire J, et al. Phase I study of MRX34, a liposomal miR-34a mimic, administered twice weekly in patients with advanced solid tumors. Invest new drugs. 2016; 35 (2): 180. DOI: 10.1007/s10637-016-0407-y.
- Seyhan AA. Trials and Tribulations of MicroRNA Therapeutics. Int J Mol Sci. 2024; 25 (3): 1469. DOI: 10.3390/ijms25031469.