ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Когнитивный резерв больных хронической ишемией мозга
Научный центр неврологии, Москва, Россия
Когнитивный резерв (КР) характеризуется способностью активировать нейронные сети для адаптивной реорганизации функций мозга в ответ на повреждение или стресс. Целью работы было выявление структурно-функциональной организации нейросетей у больных хронической ишемией мозга (ХИМ) с различным КР. В исследовании участвовали 137 женщин в возрасте 50–85 лет больных ХИМ без диабета. Средняя давность заболевания ХИМ — 10,1 ± 0,7 года. Больные ХИМ были разделены на две группы: со средним (СО) и с высшим (ВО) образованием. Определяли содержание кортизола в слюне до и после когнитивной нагрузки, а также различие коннективной организации мозга по данным фМРТ в двух группах больных. Найдены коннективности преимущественно в слуховых областях, различные в двух группах, с учетом поправки на множественность сравнений (FDR), и чувствительные к уровню кортизола. Больные с более высоким КР позже заболевали ХИМ, имели достоверно более положительные значения коннективностей, более низкий уровень фонового кортизола и более высокий сдвиг кортизола при когнитивной нагрузке.
Ключевые слова: кортизол, фМРТ покоя, коннективность, хроническая ишемия мозга, высшее образование, когнитивный резерв, среднее образование, когнитивная нагрузка
Вклад авторов: В. Ф. Фокин — написание статьи; Н. В. Пономарева — дизайн исследования; А. А. Шабалина — биохимические исследования, определение кортизола в слюне; Р. Н. Коновалов — дизайн нейровизуалиционных исследований; Р. Б. Медведев — допплерогафические исследования; А. И. Боравова — психофизиологические исследования; О. В. Лагода — клинические исследования; М. В. Кротенкова — руководство нейровизуалиционными исследованиями; М. М. Танашян — руководство клиническими исследованиями, общий дизайн работы.
Соблюдение этических стандартов: исследование одобрено локальным этическим комитетом Научного центра неврологии (протокол № 5-6/22 от 1 июня 2022 г.). Все участники обследований подписали добровольное информированное согласие.
Для корреспонденции: Виталий Федорович Фокин
Волоколамское шоссе, д. 80, г. Москва, 125367, Россия; ur.liam@fvf
Когнитивный резерв (КР) — это концепция, описывающая способность мозга адаптироваться к повреждениям или старению. КР характеризуется способностью активировать нейронные сети и адаптивно реорганизовывать функции мозга в ответ на повреждение или стресс [1]. Понятие КР широко используют при описании процессов старения, а также нейродегенеративных и сосудистых заболеваний мозга.
Существуют два противоположно направленных фактора, играющих ключевую роль в организации КР: учебное образование и влияние стресса, который часто заменяется более измеряемой характеристикой — уровнем гормона стресса — кортизолом. Рассмотрим последовательно эти характеристики.
Исследования, описывающие влияние полученного человеком образования на его организм, делятся на две большие группы: влияние социальных преимуществ, связанных с получением высшего образования (ВО), и изменения, происходящие в структурно-функциональной организации мозга под влиянием образования. Период когнитивного тренинга при получении ВО можно рассматривать как более продолжительный, чем период при получении среднего образования (СО). Часто ВО завершается в относительно молодом возрасте, характеризующемся высокой пластичностью мозга, поэтому существует благоприятная возможность оптимальным образом сформировать сети мозга. Одно из главных преимуществ лиц с ВО — наработанный больший КР, который проявляется, в том числе, и в отношении к стрессу, связанному с когнитивной нагрузкой.
Стресс у мужчин и женщин протекает по-разному, поэтому целесообразно его рассматривать отдельно. В данной работе сосредоточимся на реакциях, связанных с когнитивным стрессом у женщин с ВО и СО, больных хронической ишемией мозга (ХИМ). Женщины с ВО имеют потенциально улучшенные механизмы регуляции стресса. Это может быть связано с динамикой кортизола. Длительный стресс снижает КР [2]. У женщин с ВО возможна более высокая активация префронтальной коры (ПФК), которая играет важную роль в исполнительных функциях и эмоциональной регуляции [3]. ВО, возможно, приводит к более сильной активации ПФК во время стресса, что способствует лучшему когнитивному контролю и эмоциональной регуляции. Это особенно верно по отношению к связям ПФК с поясной извилиной. Кроме того, ВО связано с увеличенным объемом гиппокампа, который играет роль в регуляции памяти и реакциях на стресс, возможно, обеспечивая защитный эффект полученного образования на целостность гиппокампа [4].
Можно наблюдать различные паттерны активации миндалевидного тела, которое участвует в формировании реакций на страх и угрозу. ВО может привести к менее выраженной или более контролируемой активации миндалевидного тела во время стресса [5].
У женщин с более низким социально-экономическим статусом, который часто связан с невысоким уровнем образования, имеет место повышенный базовый уровень кортизола, даже при отсутствии, казалось бы, сильных стрессоров [6]. Уменьшенный объем гиппокампа в условиях хронического стресса может негативно влиять на его функционирование, что приводит к ухудшению памяти и нарушениям регуляции стресса [7], а также снижению КР.
У лиц с недостаточным образованием повышенная реактивность миндалевидного тела и хронический стресс могут сенсибилизировать миндалевидное тело, что способствует усилению реакции страха. При этом ПФК не всегда может регулировать реакции миндалевидного тела, что приводит к менее эффективной эмоциональной регуляции [8].
Исследования нейронных коррелятов когнитивной нагрузки у женщин с разным уровнем образования все еще относительно ограничены, и результаты не всегда совпадают в разных исследованиях. Более высокая когнитивная нагрузка требует больших церебральных энергетических ресурсов, что приводит к повышенной нейронной активности. Это видно в исследованиях функциональной магнитно-резонансной томографии (фМРТ), где повышенный BOLD-сигнал (blood oxygen level dependent) сопровождается активацией в теменных долях и ПФК. Повышенная активация в теменных долях связана с пространственной обработкой, вниманием и рабочей памятью, и их активность увеличивается с ростом когнитивных трудностей [9].
ПАЦИЕНТЫ И МЕТОДЫ
В исследовании участвовали 137 женщин в возрасте 50–85 лет больных ХИМ, не болевших диабетом. Средняя давность заболевания ХИМ — 10,1 ± 0,7 года. Больные ХИМ были разделены на две группы: с СО и с ВО. Основные этиологические причины ХИМ: атеросклероз, артериальная гипертензия (включая гипертоническую болезнь), венозная недостаточность, диабетическая ангиопатия, васкулиты различной этиологии и т. д. Критерии включения: начальные проявления и субкомпенсация ХИМ; отсутствие необходимости в постоянной опеке со стороны окружающих [10]. Критерии невключения: деменция выраженностью 1 балл и более по клинически рейтинговой шкале деменции [11]; наличие в анамнезе острых нарушений мозгового кровообращения, черепно-мозговых травм, тяжелой кардиальной, почечной недостаточности, некомпенсированных нарушений функций щитовидной железы. Диагноз ХИМ дополнительно верифицировали с помощью дуплексного сканирования и МРТ-контроля. Все пациенты — правши. У больных регистрировали рост и массу тела для определения индекса массы тела (ИМТ). ИМТ = масса тела/рост2. Учитывали две возрастные характеристики: возраст пациента при данной регистрации и возраст при первом обращении в медицинское учреждение по поводу симптомов ХИМ. Обычно первое обращение было связано с нарушением памяти и концентрации внимания, сопровождающим артериальную гипертензию, а также с нарушениями мозгового кровообращения. Вторая характеристика — это возраст на момент экпериментального обследования. Предполагалось, что больные с разным уровнем образования достигают этой стадии в разном возрасте. Обе группы женщин в основном занимались умственным трудом, так женщины с СО в прошлом, как правило, были работниками бухгалтерии или средним медперсоналом.
Исследование фМРТ покоя
Обследуемым (25 больным ХИМ) регистрировали фМРТ покоя головного мозга в последовательности Т2* для получения BOLD-сигнала на магнитно-резонансном томографе Magnetom Verio (Siemens, Германия) с величиной магнитной индукции 3,0 Тесла. Исследуемым предлагали следовать инструкции: максимально расслабиться, лежать спокойно с закрытыми глазами (для исключения стимулирования зрительного анализатора), не думать о чемлибо конкретном. МРТ-данные обрабатывали в программе SPM12 в среде MATLAB. Для изучения коннективностей использовали приложение CONN-18b на платформе SPM-12. Оценивали коннективность в различных нейросетях мозга. Проводили сравнение коннективностей в двух группах больных ХИМ, различающихся по уровню образования. В этих группах оценивали достоверность различий по стандартизированному коэффициенту регрессии с поправкой на множественность сравнений (FDR, False Discovery Rate) в программе CONN-18b.
Магнитно-резонансный томограф MAGNETOM Verio (Siemens, Германия) имел напряженность магнитного поля 3,0 Тл. Функциональные сканы были получены в состоянии покоя с использованием T2*-взвешенной последовательности EPI: TR = 1 500 мс, TE = 30 мс, flip angle 70°, толщина среза 2 мм, FOV = 190 мм, фаза FoV 100,0%.
Когнитивные тесты
Пациентов обследовали с помощью корректурного теста, теста вербальной беглости, теста на вербальную память Лурия, теста МоСA, описанных ранее [12]. Кроме этого, регистрировали артериальное давление, вычисляли пульсовое давление (разность между систолическим и диастолическим давлением) и частоту сердечных сокращений.
Биохимические исследования
У пациентов определяли уровень кортизола в образцах слюны на иммунохемилюминесцентном анализаторе Abbott i2000 ARCHITECT (Abbott Laboratories, Illinois, USA) с использованием наборов реагентов этого же производителя.
Образцы слюны собирали по протоколу, описанному ранее [13]. Больные не употребляли алкоголь в течение недели, не пили чай или кофе за 1 ч до забора слюны, за 10 мин до этого прополаскивали рот водой. Сбор слюны осуществляли путем ее сплевывания в пробирку объемом не менее 1,5 мл. Образцы слюны, загрязненные кровью, исключали из исследования, для этого использовали набор иммуноферментного анализа для определения загрязнения слюны кровью [13].
Статистическая обработка
Анализ полученных данных осуществляли с помощью пакета прикладных программ Statistica-12 (Dell, США). Оценивали нормальность распределения по критерию Колмогорова– Смирнова. Вычисляли средние арифметические, стандартные ошибки, проводили однофакторный дисперсионный и корреляционный анализы. Для анализа нейросетей дополнительно вычисляли Т-критерий по Стьюденту, а также использовали поправку на множественность сравнений — FDR (False Discovery Rate).
Процедура обследования
Первый забор слюны проводили не ранее чем спустя 2 ч после еды; вначале происходила фоновая регистрация медленной электрической активности (не более 5 мин), затем с перерывом в 1–2 мин пациенты выполняли три когнитивных теста: корректурный тест по Кирчнеру (3 мин), тест вербальной беглости (фонематический вариант) (4–5 мин), тест на вербальную память по Лурия (5–7 мин). Сразу после выполнения тестов в течение 1–2 мин проводили повторный забор слюны. Тест МоСа проводили после окончания экспериментов и забора слюны.
РЕЗУЛЬТАТЫ И МЕТОДЫ
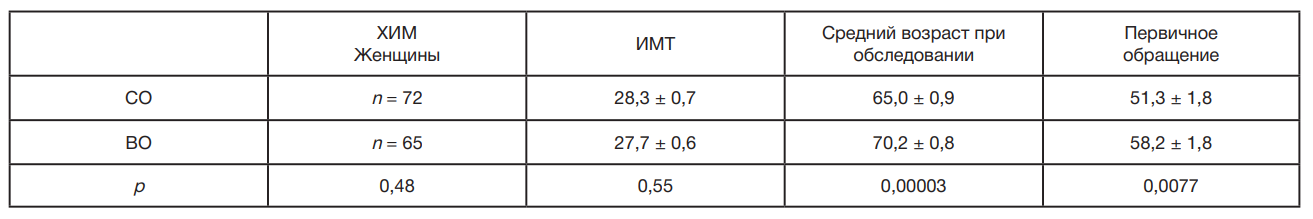
У больных ХИМ сопряженность между уровнем образования и возрастными характеристиками достоверно проявляется у женщин. В табл. 1 представлены демографические данные, которые дают представление о роли образования в динамике процесса сосудистого патологического старения (ХИМ).
Эффект ВО отчетливо отражается на возрастных характеристиках: женщины с ВО позже обращаются за медицинской помощью по поводу ХИМ (табл. 1). Первичное обращение в медицинское учреждение лиц с СО и их настоящее обследование происходило примерно на 7 лет раньше, по сравнению с больными с ВО. В связи с имеющимися литературными данными о влиянии длительного образования на стресс рассмотрим влияние образования на механизмы стресса, а именно на гормон стресса — кортизол (табл. 2).
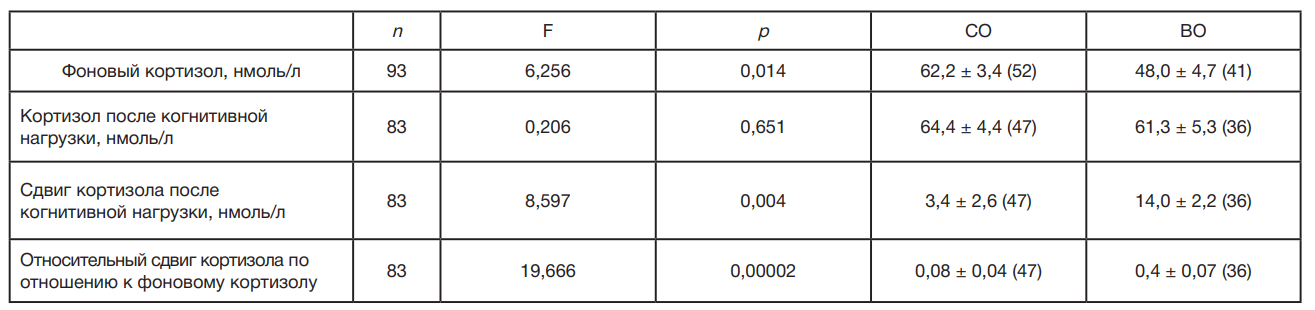
Фоновый уровень кортизола ниже у женщин с ВО примерно на 14 нмоль/л, а реактивность на когнитивную нагрузку примерно в 3,5–5 раз выше (табл. 2). Величина кортизола после когнитивной нагрузки достоверно не различается в двух группах. Это в значительной мере объясняет разную величину сдвига кортизола в обеих группах. Создается впечатление, что существует некоторый уровень максимально возможного содержания кортизола при когнитивной нагрузке, а различие в сдвигах кортизола объясняется разным содержанием кортизола в фоне в обеих группах. Найдена достоверная корреляция между показателями фонового кортизола и относительной реактивности кортизола: r = 0,41; n = 88; p = 0,00008.
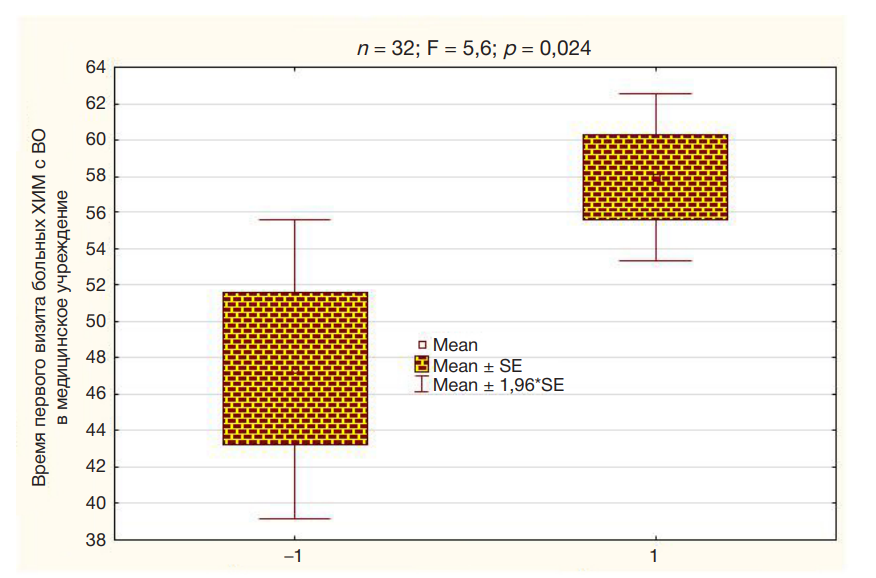
Cдвиг уровня кортизола при когнитивной нагрузке связан с возрастом первого обращения в медицинское учреждение по поводу появившихся симптомов ХИМ для больных с ВО (рис. 1).
Чем больше реактивность кортизола, тем позже обращается пациент за медицинской помощью по поводу появившихся симптомов ХИМ. Следует заметить, что в стационаре для обследования отбирали пациентов примерно одной степени тяжести. У лиц с ВО уровень кортизола ниже в фоне, чем у женщин с СО (табл. 1), при этом возраст больных на содержание кортизола у женщин достоверно не влиял (p = 0,14). При когнитивной нагрузке уровень кортизола примерно одинаков для людей с ВО и СО, и составляет, в среднем, 63,0 ± 3,4 нмоль/л (n = 83).
Какие существуют различия в организации нейронных сетей по данным фМРТ у больных с разным уровнем образования? Рассмотрим различия показателей коннективностей, связывающих области мозга у лиц с ВО и СО (рис. 2).
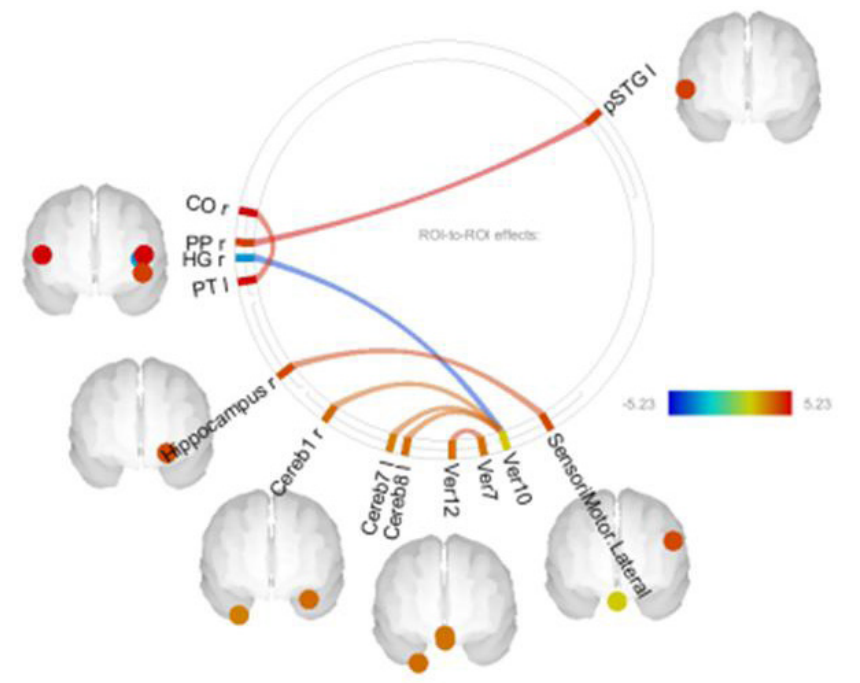
Можно наблюдать преобладание положительных значений разностей коннективностей, указывающих, что сопряженность некоторых образований головного мозга у больных с ВО выше, чем у больных с СО (рис. 2). Эти различия касаются в основном височных областей обоих полушарий и гиппокампа, а также некоторых районов мозжечка и червя мозжечка.
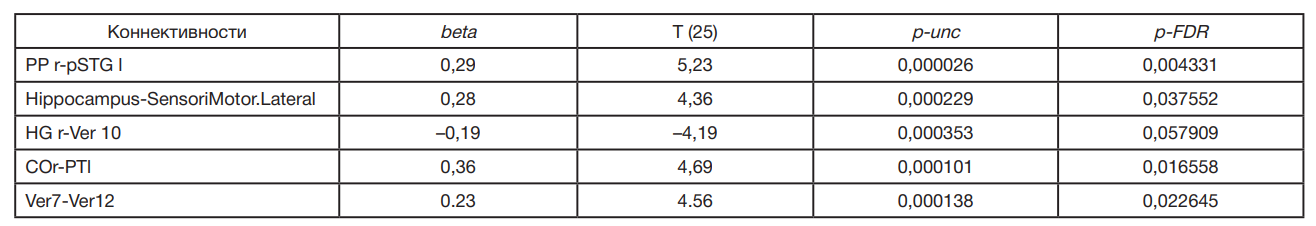
Рассмотрим статистические показатели разности коннективностей, достоверных с учетом множественности сравнений и различных в обеих группах больных (табл. 3). Анализ этих коннективностей показывает, какие связи преобладают у больных с ВО или СО.
Следует отметить, что у лиц с ВО преобладают положительные связи (табл. 3). Единственная отрицательная коннективность, связывающая извилину Гешля с червем мозжечка, недостоверна с учетом множественности сравнений (р-FDR > 0,5). Эта коннективность представлена в табл. 3, так как значение p-FDR выше достоверного менее чем на 0,008.
Коннективности между указанными выше областями можно оцифровать и представить в виде векторов, где каждому больному для каждой коннективности будет поставлен в соответствие коэффициент регрессии. Эти коннективности достоверно различны в обеих группах по F-критерию, который варьирует от 17,5 до 27,4 с уровнями значимости от 0,00035 до 0,00003.
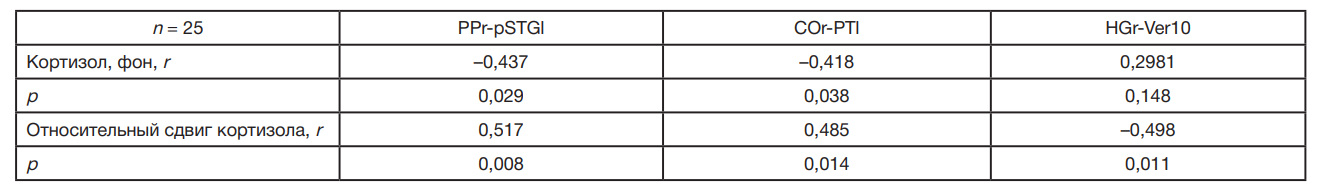
Некоторые коннективности имеют отношение к регуляции кортизола (табл. 4).
Положительные по знаку коннективности отрицательно коррелируют с фоновым кортизолом и положительно — с относительной реактивностью кортизола; негативная коннективность ( HGr-Ver10) отрицательно коррелировала с относительной реактивностью кортизола.
Таким образом, некоторые коннективности достоверно различны у лиц с разным уровнем образования и связаны с регуляцией уровня кортизола. Вклад коннективностей PPr-pSTGl, COr-PTl и HGr-Ver10 в обеспечение когнитивного резерва обусловлен, вероятно, их связями со слухоречевой системой.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наши исследования выявили факт более поздней заболеваемости ХИМ у женщин с ВО. Вероятно, прямое воздействие образования существенно отражается на КР. КР у женщин с ВО в сочетании с такими факторами, как социальный статус и более здоровый образ жизни, способствует снижению стресса и, как следствие, более позднему началу заболевания ХИМ. Это также подтверждается более низкими уровнями фонового кортизола у пациентов с ВО и повышенной реактивностью кортизола на когнитивную нагрузку. Высокая реактивность кортизола у этих лиц поддерживает более эффективное энергетическое обеспечение когнитивных функций и их успешную реализацию, особенно при относительно кратковременной ментальной нагрузке. Существенным представляется факт более высокой коннективности в мозге женщин, имеющих ВО, и связи этих коннективностей с когнитивными функциями.
По нашим данным, женщины с ВО заболевают хронической ишемией мозга (ХИМ) позже, о чем свидетельствует более позднее обращение в медицинские учреждения в среднем примерно на 7 лет, а также более поздний возраст начала обследования — в равной стадии заболевания, соответствующей дисциркуляторной энцефалопатии 1-й или 2-й стадии. Подтверждением того, что больные ХИМ с ВО стареют медленнее, является более высокая коннективность нейросетей мозга, что, в целом, является показателем лучше функционирующего и более молодого мозга [14].
В современной литературе описаны различия в процессе старения у женщин с ВО и СО. Эти различия касаются биологического возраста, а также внешних проявлений возрастных изменений. Несомненно, что несколько факторов, включая уровень образования, способствуют замедлению процессов старения [15]. ВО часто коррелирует с более высоким социально-экономическим статусом, что ведет к лучшему доступу к ресурсам, влияющим на здоровье и старение. Это включает доступ к качественному здравоохранению, правильному питанию и здоровым привычкам. Образованные женщины могут быть более склонны к поддержанию здорового образа жизни, включая регулярные физические упражнения, отказ от курения и контроль веса. Они также имеют более обширные знания о рисках для здоровья и мерах профилактики.
ВО связано с большим КР — способностью мозга справляться с повреждениями и поддерживать нормальное функционирование [1]. Это может приводить к более позднему началу или более медленному прогрессированию возрастного снижения когнитивных способностей. Женщины с ВО заболевают ХИМ в более позднем возрасте и демонстрируют более медленный прогресс заболевания, это касается также болезни Альцгеймера и развития других деменций [16].
Заслуживает также внимания связь образования с уровнями кортизола, указывающая на более низкие фоновые значения кортизола у лиц с ВО. Вопрос о коннективностях, различающихся у лиц с разным уровнем образованием, и при этом чувствительных к уровню кортизола, свидетельствует о принципиальной взаимосвязи двух главных факторов КР.
Функциональная связность между определенными областями мозга, такими как задняя теменная область (PPr), задняя верхняя височная извилина (pSTG), кортикомоторная область (COr), теменная кора (PTl) и червь мозжечка (HGr-Ver10), играет существенную роль в слуховой обработке, речевых и когнитивных функциях, в целом. Исследования нейровизуализации продемонстрировали, что характеристики этих коннективностей часто различаются у пациентов с различными нарушениями слуховой обработки, такими как вербальная и слуховая нагрузка. Эти коннективности также коррелируют с уровнями кортизола, особенно в ответ на когнитивную нагрузку [17–18].
Согласно анатомической и физиологической организации этих областей мозга, можно предположить, что коннективность PPr-pSTG, являясь частью слуховой ассоциативной системы, способствует интеграции слуховой информации и пониманию языка [19]. Связь COr-PTl рассматривают как участвующую в синтезе речи и сенсомоторной интеграции, необходимой для речевых функций [20]. Связывающая первичную слуховую кору правого полушария с червем мозжечка коннективность HGr-Ver10 считается основной для слухо-моторной регуляции, что способствует выполнению задач, требующих координации слуховых стимулов и двигательных реакций в норме и при патологии [21]. Таким образом, роль этих связей в создании и организации КР становится более очевидной.
ВЫВОДЫ
Получение ВО женщинами с высокой вероятностью приносит ряд дополнительных преимуществ. Часто это связано с более высоким материальным достатком, осведомленностью о здоровом образе жизни, меньшей приверженностью вредным привычкам и другими факторами. Все они наряду с более низким уровнем кортизола у лиц с ВО способствуют более высокому КР и более продолжительному сохранению здоровья. Это подтверждается и более высокими значениями коннективности у лиц с ВО, которые ассоциированы с более низким уровнем кортизола.
- Stern Y. What is cognitive reserve? Theory and findings. Journal of the International Neuropsychological Society. 2002; 8 (3): 450–58. Available from: https://doi.org/10.1017/S1355617702814268.
- Schuurmans IK, Hoepel SJW, Cecil CAM, Hillegers MHJ, Ikram MA, Luik AI. The Association of Life Stress with Subsequent Brain and Cognitive Reserve in Middle-Aged Women. J Alzheimers Dis. 2023; 93 (1): 97–106. DOI: 10.3233/JAD-220923. PMID: 36938734; PMCID: PMC10200172.
- Ochsner KN, Gross JJ. The cognitive control of emotion. Trends in Cognitive Sciences. 2005; 9 (5): 242–9. Available from: https://doi.org/10.1016/j.tics.2005.03.005.
- Tang X, Varma VR, Miller MI, Carlson MC. Education is associated with sub-regions of the hippocampus and the amygdala vulnerable to neuropathologies of Alzheimer's disease. Brain Struct Funct. 2017; 222 (3): 1469–79. DOI: 10.1007/s00429016-1287-9. Epub 2016 Aug 17. PMID: 27535407; PMCID: PMC5850930.
- Phelps EA. Emotion and cognition: insights from studies of the human amygdala. Annu Rev Psychol. 2006; 57: 27–53. DOI: 10.1146/annurev.psych.56.091103.070234. PMID: 16318588.
- Dowd JB, Simanek AM, Aiello AE. Socio-economic status, cortisol and allostatic load: a review of the literature. Int J Epidemiol. 2009; 38 (5): 1297–309. DOI: 10.1093/ije/dyp277. Epub 2009 Aug 31. PMID: 19720725; PMCID: PMC2755130.
- Wingenfeld K, Wolf OT. Stress, memory, and the hippocampus. Front Neurol Neurosci. 2014; 34: 109–20. DOI: 10.1159/000356423. Epub 2014 Apr 16. PMID: 24777135.
- Davidson RJ, Jackson DC, Kalin NH. Emotion, plasticity, context, and regulation: perspectives from affective neuroscience. Psychol Bull. 2000; 126 (6): 890–909. DOI: 10.1037/0033-2909.126.6.890. PMID: 11107881.
- Culham JC, Kanwisher NG. Neuroimaging of cognitive functions in human parietal cortex. Curr Opin Neurobiol. 2001; 11 (2): 157– 63. DOI: 10.1016/s0959-4388(00)00191-4. PMID: 11301234.
- Танашян М. М., Максимова М. Ю., Домашенко М. А. Дисциркуляторная энцефалопатия. Путеводитель врачебных назначений. 2015; 2: 1–25.
- Morris JC. Clinical dementia rating: a reliable and valid diagnostic and staging measure for dementia of the Alzheimer type. Int Psychogeriatric. 1997; (9 Suppl 1): 173–76.
- Фокин В. Ф., Пономарева Н. В., Коновалов Р. Н., Кротенкова М. В., Медведев Р. Б., Лагода О. В., Танашян М. М. Влияние уровня образования на функциональную организацию мозга больных хронической церебральной ишемией. Анналы клинической и экспериментальной неврологии. 2021; 15 (2): 35–41. DOI: 10.25692/ACEN.2021.2.5
- Фокин В. Ф., Шабалина А. А., Пономарева Н. В., Медведев Р. Б., Лагода О. В., Танашян М. М. Кортизол, цитокины и вегетативные изменения при когнитивной нагрузке у больных хронической ишемией мозга. Патологическая физиология и экспериментальная терапия. 2023; 67 (3): 51–57. DOI: 10.25557/0031-2991.2023.03.51-57.
- Cansino S. Brain connectivity changes associated with episodic recollection decline in aging: A review of fMRI studies. Front Aging Neurosci. 2022; 14: 1012870. DOI: 10.3389/fnagi.2022.1012870. PMID: 36389073; PMCID: PMC9640923.
- Seblova D, Berggren R, Lövdén M. Education and age-related decline in cognitive performance: Systematic review and metaanalysis of longitudinal cohort studies. Ageing Res Rev. 2020; 58: 101005. DOI: 10.1016/j.arr.2019.101005. Epub 2019 Dec 24. PMID: 31881366.
- Zahodne LB, Stern Y, Manly JJ. Differing effects of education on cognitive decline in diverse elders with low versus high educational attainment. Neuropsychology. 2015; 29 (4): 649–57. DOI: 10.1037/neu0000141. Epub 2014 Sep 15. PMID: 25222199; PMCID: PMC4362867.
- Rivera-Bonet CN, Birn RM, Ladd CO, Meyerand ME, Abercrombie HC. Cortisol effects on brain functional connectivity during emotion processing in women with depression. J Affect Disord. 2021; 287: 247–54. DOI: 10.1016/j.jad.2021.03.034. Epub 2021 Mar 17. PMID: 33799044; PMCID: PMC8128282.
- Jentsch VL, Merz CJ, Wolf OT. Restoring emotional stability: Cortisol effects on the neural network of cognitive emotion regulation. Behav Brain Res. 2019; 18 (374): 111880. DOI: 10.1016/j.bbr.2019.03.049. Epub 2019 Apr 1. PMID: 30946860.
- Hickok G, Poeppel D. The cortical organization of speech processing. Nature Reviews Neuroscience. 2007; 8 (5): 393–402. Available from: https://doi.org/10.1038/nrn2113.
- Heald SL, Nusbaum HC. Speech perception as an active cognitive process. Front Syst Neurosci. 2014; 8: 35. DOI: 10.3389/fnsys.2014.00035. PMID: 24672438; PMCID: PMC3956139.
- Wang Z, Wang Y, Sweeney JA, Gong Q, Lui S, Mosconi MW. Resting-State Brain Network Dysfunctions Associated With Visuomotor Impairments in Autism Spectrum Disorder. Front Integr Neurosci. 2019; 13: 17. DOI: 10.3389/fnint.2019.00017. PMID: 31213995; PMCID: PMC6554427.