ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Модель прогноза вероятности летального исхода у больных абдоминальным сепсисом
1 Южно-Уральский государственный медицинский университет, Челябинск, Россия
2 Городская клиническая больница № 8, Челябинск, Россия
3 Челябинская областная клиническая больница, Челябинск, Россия
Летальность среди пациентов с различными формами сепсиса составляет 36,2–47,7%. Прогнозирование вероятности летального исхода при сепсисе критически важно для принятия клинических решений, стратификации риска пациентов и улучшения общей выживаемости. Целью исследования было разработать математическую модель прогноза исхода сепсиса у пациентов с абдоминальной хирургической патологией. Исследование выполняли на 64 больных с диагностированным абдоминальным сепсисом (АС). В зависимости от исходов АС были выделены группа 1 (n = 46) с благоприятным исходом и группа 2 (n = 18) с летальным исходом. Использовали клинические шкалы и лабораторные методы исследования с оценкой показателей на 1, 3 и 7 сутки с момента диагностирования АС. На 3 и 7 сутки показатели SOFA в группе с неблагоприятным исходом АС были значимо выше, чем в группе с благоприятным исходом. В общем анализе крови у пациентов в группе 2 наблюдалось уменьшение абсолютного количества лимфоцитов на 1 сутки в сравнении с группой 1. Среди биохимических показателей выявлено увеличение концентрации в сыворотке С-реактивного белка, мочевины, креатинина, лактата, прокальцитонина, прямого билирубина, активности аспартатаминотрансферазы, аланинаминотрасферазы и щелочной фосфатазы. Также в группе 2 выявлено снижение респираторного индекса на 3 и 7 сутки, насыщения венозной крови кислородом — на 1 и 7 сутки. Построена модель логистической регрессии и создана программа для ЭВМ «Калькулятор прогноза летальности при АС». Разработана модель вероятности летального исхода у пациентов с АС. Высокий уровень С-РБ, креатинина в сыворотке крови, а также снижение насыщения венозной крови кислородом служат значимыми прогностическими маркерами летального исхода у пациентов с АС.
Ключевые слова: прогноз, модель, летальность, абдоминальный сепсис
Вклад авторов: М. В. Осиков, Л. Ф. Телешева, А. Г. Конашов — концепция и дизайн исследования; В. А. Конашов, А. Г. Конашов, А. В. Гусев, М. С. Бойко — сбор и обработка материала; В. А. Конашов, А. Г. Конашов — написание текста; М. В. Осиков — редактирование.
Соблюдение этических стандартов: исследование одобрено этическим комитетом ФГБОУ ВО ЮУГМУ Минздрава России (протокол № 10 от 02 ноября 2023 г.).
Для корреспонденции: Михаил Владимирович Осиков
ur.xednay@vokiso.forp
Сепсис — типовая форма патологии, в основе которой лежит реакция организма в виде генерализованного (системного) воспаления на инфекцию различной природы (бактериальную, вирусную, грибковую), приводящая к остро возникающей полиорганной дисфункции [1]. Летальность среди пациентов с различными формами сепсиса, поступающих в отделения интенсивной терапии по всему миру, составляет 36,2–47,7% [2]. Наиболее распространенными источниками инфекции при сепсисе являются легкие (64%), брюшная полость (20%), система кровообращения (15%) и мочевыводящие пути (14%) [3].
Абдоминальный сепсис (АС) — это синдром, в основе которого лежит системная воспалительная реакция организма на интраабдоминальную инфекцию, приводящий к острой органной дисфункции [4]. Интраабдоминальные инфекции являются второй по частоте причиной сепсиса после легочного очага [4]. Осложненные интраабдоминальные инфекции приводят к развитию местного или разлитого перитонита, что вызывает органную недостаточность и в итоге АС [4]. Смертность от АС колеблется от 7,6 до 36% [4].
Многие клинические и лабораторные маркеры не обладают достаточной чувствительностью и специфичностью для идентификации прогноза исходов сепсиса из-за сложных патофизиологических механизмов. На сегодняшний день в прогнозе развития АС используют шкалу оценки тяжести сепсиса WSES (от англ. World Society of Emergency Surgery — Всемирное общество неотложной хирургии) для пациентов с осложненными внутрибрюшинными инфекциями, шкалу оценки тяжести состояния PIPAS — для пациентов с острым перитонитом с целью определения эффективности лечения и летальности [5, 6]. Мультимаркерный подход позволит создать математическую модель пациента в зависимости от исхода заболевания, а также охарактеризовать индивидуальный прогноз. В последние годы алгоритмы построения логистических регрессионных моделей для прогнозирования исходов абоминального сепсиса путем применения моделей регрессии Акаике (AIC) превосходят традиционные статистические методы [7]. Математическая модель прогноза вероятности летального исхода у больных с АС позволит внести изменения в хирургическую тактику лечения, своевременно определить показания к экстракорпоральным методам лечения (селективная гемосорбция цитокинов, сочетанная с адсорбцией липополисахаридов, гемодиафильтрация, плазмообмен, селективная плазмофильтрация) и интенсифицировать терапию.
Цель работы — разработать математическую модель прогноза вероятности летального исхода сепсиса у пациентов с абдоминальной хирургической патологией.
ПАЦИЕНТЫ И МЕТОДЫ
Проведен поперечный срез сплошным методом выборки по мере госпитализации пациентов с абдоминальной хирургической патологией в отделение реанимации и интенсивной терапии ГАУЗ ОЗП «ГКБ № 8 г. Челябинск», которым предварительно выполнено оперативное лечение с санацией первичного очага в течение первых суток госпитализации. У всех пациентов выборки диагностирован сепсис в соответствии с действующей концепцией «Сепсис-3». Выборка пациентов представлена 64 больными в возрасте 32–82 лет. Критерии включения: возраст старше 18 лет; наличие письменного информированного согласия, абдоминальное хирургическое вмешательство в течение первых суток текущей госпитализации; наличие верифицированного очага интраабдоминальной инфекции (бактериологический посев и / или прямое наблюдение за очагом инфекции); наличие органной дисфункции (по шкале SOFA > 2 баллов). Критерии исключения: развитие интраабдоминальной инфекции в стационаре; предшествующая иммунотропная, антибактериальная терапия, прием антикоагулянтов в течение 90 суток; злокачественные новообразования; аутоиммунные, аллергические, иммунодефицитные заболевания в анамнезе; выявленные ранее наследственные нарушения системы гемостаза; беременность.
В качестве критерия для разделения пациентов выбрана зависимость от исхода заболевания, выделена группа 1 (n = 46) с благоприятным исходом АС и группа 2 (n = 18) с летальным исходом АС. Согласно концепции «Сепсис-3», тяжесть состояния пациентов оценивали по шкале органной дисфункции (SOFA) [8, 9]. Тромбо-геморрагические нарушения оценивали по шкале Международного общества по тромбозу и гемостазу ISTH/SSC, критериям сепсис-индуцированной коагулопатии (СИК) [10].
Для лабораторных исследований использовали цельную периферическую кровь, ее плазму и сыворотку. Исследование парциального давления кислорода в артериальной крови (PaO2) для расчета респираторного индекса (PaO2/FiO2), кислотно-основного состояния венозной крови (pH крови), концентрация бикарбонат-ионов (SB), дефицит или избыток оснований (BE), показатель насыщения кислородом венозной крови (SvO2) проводили на радиометре «ABL 800 FLEX» (Radiometer Medical ApS, Дания). Определение биохимических показателей (альфа-амилаза, общий и прямой билирубин, аспартатаминотрансфераза (АСТ), аланинаминотрасфераза (АЛТ), мочевина, креатинин, щелочная фосфатаза, глюкоза крови, лактат) в сыворотке осуществляли на биохимическом анализаторе «Mindray BS – 800 M» (Mindray, Китай). Показатели общего анализа крови определяли на анализаторе «Sysmex XT — 1800i / XT — 2000i» (Sysmex, Япония). Протромбиновое время (ПТВ), протромбиновый индекс (ПТИ), международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), концентрацию фибриногена в плазме исследовали на коагулометре «Technology Solution» (Technology Solution, Япония). Концентрацию прокальцитонина и стандартного С-реактивного белка (С-РБ) в сыворотке определяли методом иммуноферментного анализа на анализаторе «Personal Lab» («Adaltis», Италия).
Статистическую обработку результатов выполняли с помощью статистического пакета SPSS 17.0 (IBM, США). Для описания количественных величин рассчитывали медиану (Ме), верхний и нижний квартили (LQ; UQ). Проверку нормальности распределения проводили с помощью Колмогорова–Смирнова. Группы пациентов по количественным показателям сравнивали с помощью критерия Краскела–Уоллиса и Манна–Уитни. За уровень доверительной вероятности принимали значение р < 0,05. Полученные данные были использованы при создании компьютерной программы методом логистической регрессии для прогнозирования исхода сепсиса у пациентов с абдоминальной хирургической патологией.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
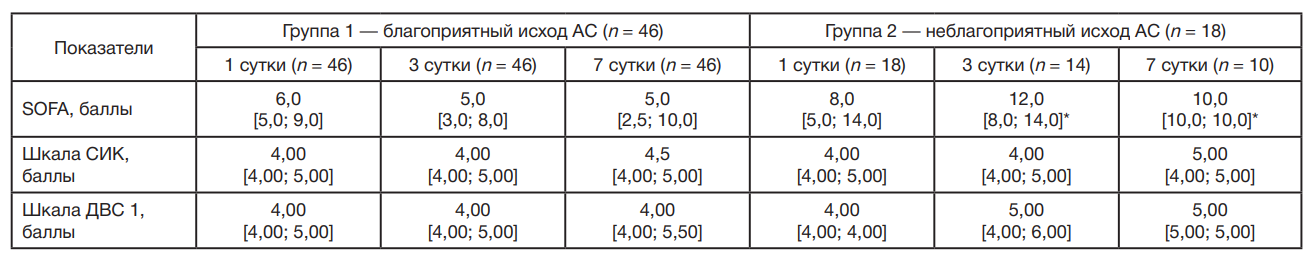
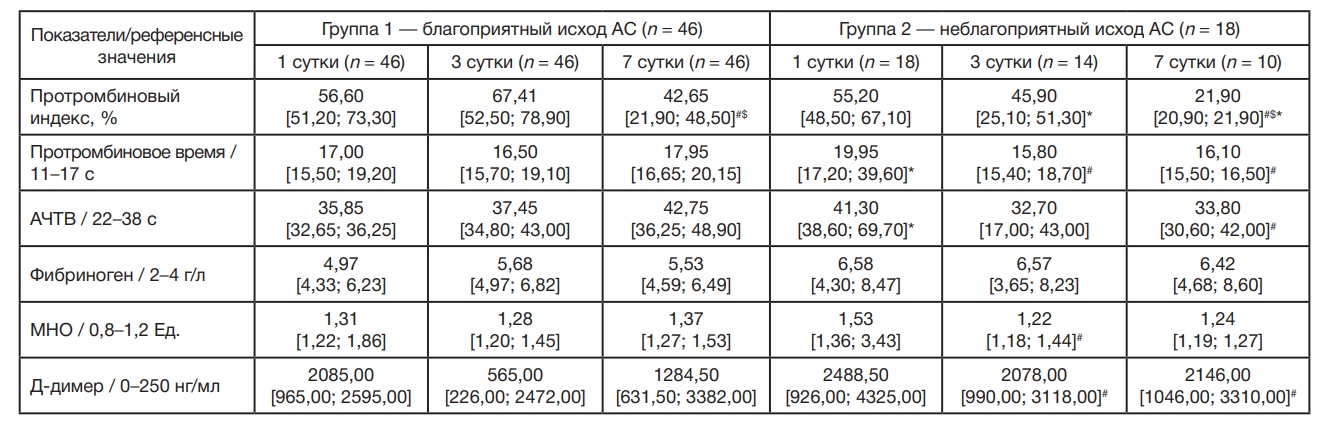
У больных с АС за время наблюдения летальный исход зарегистрирован у 18 человек (28,1%). При анализе клинических прогностических шкал обнаружено, что на 3 и 7 сутки показатели шкалы SOFA в группе с неблагоприятным исходом АС были значимо выше, чем в группе с благоприятным исходом (табл. 1).
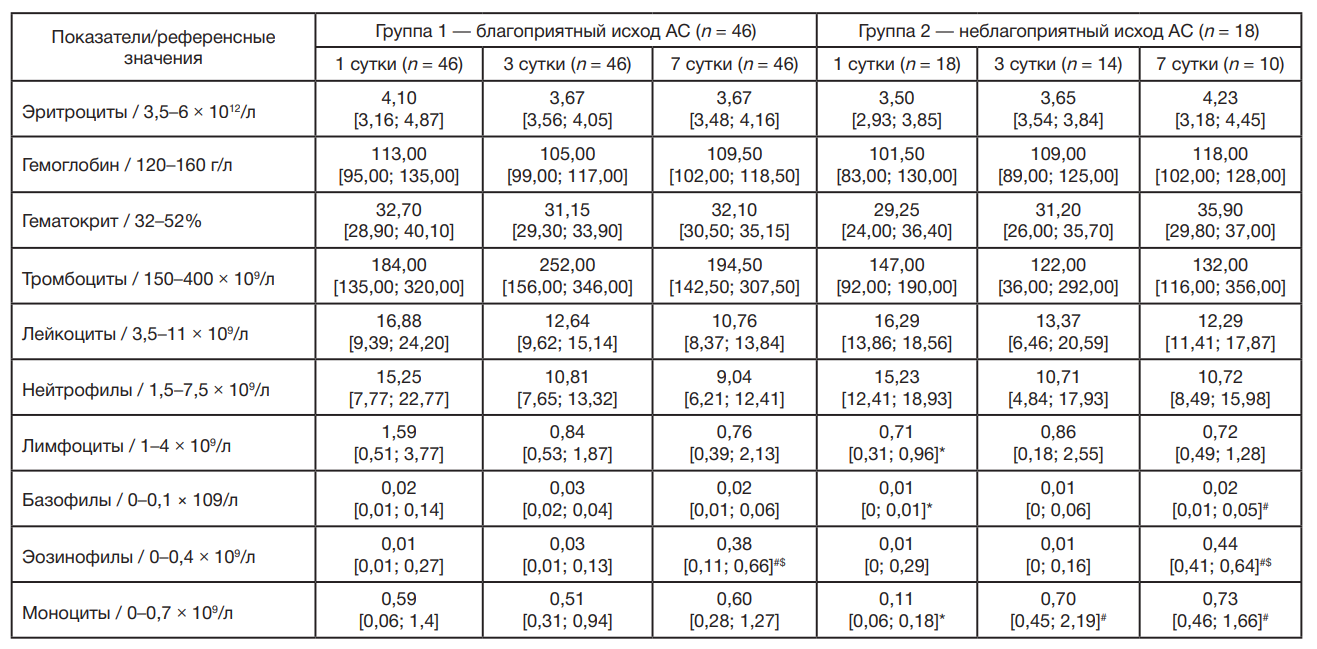
В группе больных с АС и неблагоприятным исходом в общем анализе крови на 1 и 3 сутки относительно общепринятых референсных значений наблюдались анемия со снижением количества эритроцитов, концентрации гемоглобина, гематокрита, тромбоцитопения, лейкоцитоз и нейтрофилия, а также лимфоцитопения. В динамике наблюдений на 7 сутки увеличивалось абсолютное количество базофилов и эозинофилов, а на 3 и 7 сутки — моноцитов (табл. 2). В группе пациентов с благоприятным исходом отмечен статистически значимый рост абсолютного количества эозинофилов на 7 сутки в сравнении с аналогичными показателями на 1 и 3 сутки. Для пациентов с неблагоприятным исходом АС наблюдалось статистически значимое снижение абсолютного количества лимфоцитов и моноцитов на 1 сутки в сравнении с группой благоприятного исхода АС.
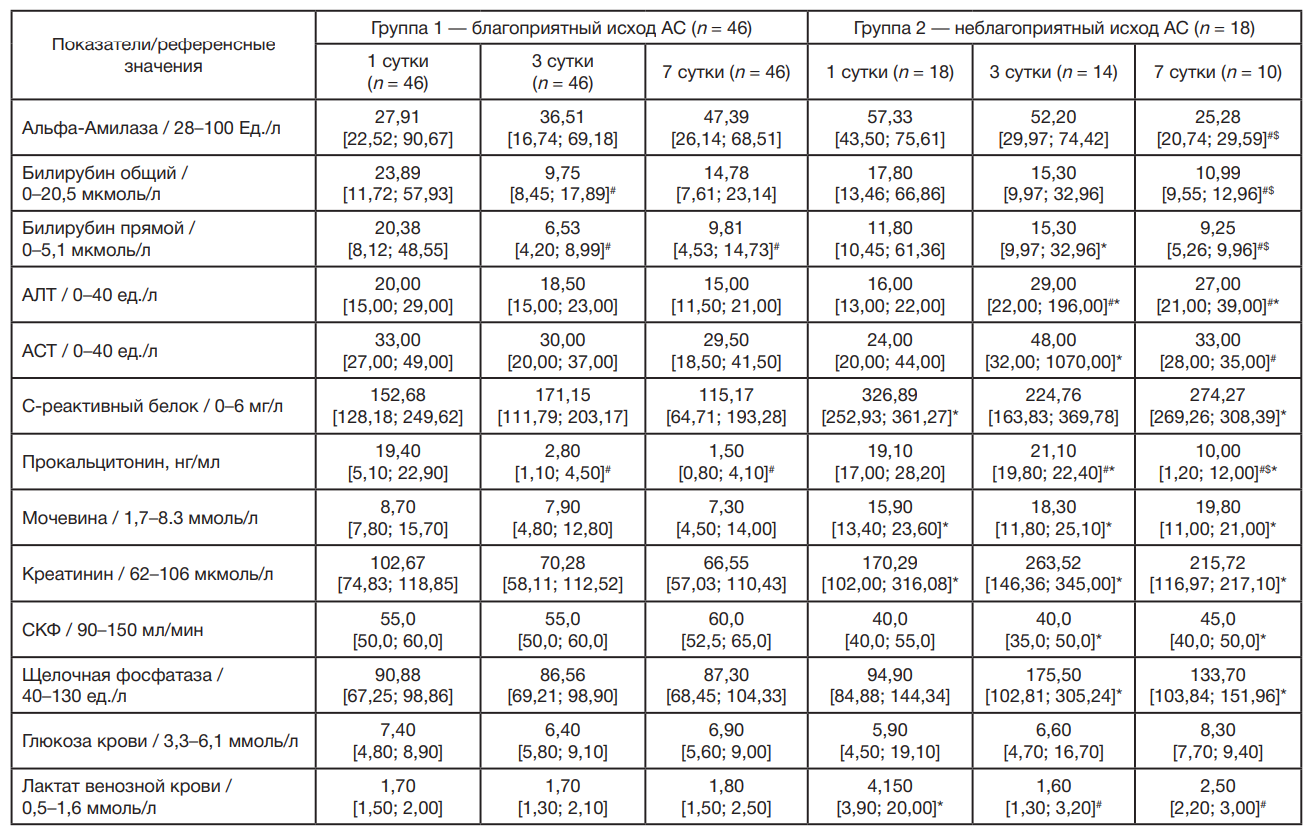
У пациентов с АС обеих групп на 1, 3 и 7 сутки выявлены высокие значения С-РБ, прокальцитонина и прямого билирубина в сравнении с референсными значениями (табл. 3). В группе пациентов с неблагоприятным исходом АС также отмечен рост концентрации мочевины, креатинина, лактата и щелочной фосфатазы в сыворотке крови. В динамике наблюдения в группе больных АС и неблагоприятным исходом на 7 сутки концентрация альфа-амилазы, прямого и общего билирубина статистически значимо снижалась в сравнении с аналогичными показателями на 1 и 3 сутки. Напротив, активность АЛТ достоверно повысилась на 3 и 7 сутки, а АСТ на 7 сутки в сравнении с 1 сутками. Концентрация лактата в сыворотке значимо снижалась на 3 и 7 сутки в сравнении с 1 сутками. Уровень прокальцитонина значимо увеличивался на 3 сутки, а на 7 сутки снижался в сравнении с 1 и 3 сутками соответственно. В группе пациентов с благоприятным исходом АС отмечено статистически значимое снижение концентрации в сыворотке общего билирубина на 3 сутки, а также прямого билирубина и прокальцитонина на 3 и 7 сутки в сравнении с 1 сутками. В группе пациентов с неблагоприятным исходом АС выявлено статистически значимое увеличение концентрации в сыворотке С-РБ, мочевины, креатинина и лактата на 1 сутки в сравнении с группой благоприятного исхода АС. В динамике наблюдений на 3 сутки увеличивалась концентрация прокальцитонина, мочевины, креатинина, АСТ, АЛТ, прямого билирубина и щелочной фосфатазы, а на 7 сутки — прокальцитонина, креатинина, мочевины, АЛТ, щелочной фосфатазы и С-реактивного белка. СКФ у пациентов с неблагоприятным исходом было значимо ниже на 3 и 7 сутки.
У больных с АС обеих групп на все сутки наблюдения относительно общепринятых референсных значений выявлен рост показателей Д-димера, фибриногена и МНО.
Рост АЧТВ и ПТВ отмечен в группе с неблагоприятным исходом на 1 сутки (табл. 4). В группе пациентов с АС и неблагоприятным исходом статистически значимо снижались уровни ПТВ, МНО и Д-димера на 3 сутки в сравнении с 1 сутками. В динамике наблюдения на 7 сутки показатели концентрации Д-димера, АЧТВ и ПТВ в сравнении с аналогичными показателями на 1 сутки также значимо снижались, а ПТИ в сравнении с 1 и 3 сутками. Для пациентов группы с благоприятным исходом выявлено статистически значимое снижение ПТИ на 7 сутки относительно значений на 1 и 3 сутки. Для пациентов с неблагоприятным исходом АС отмечено статистически значимое снижение ПТИ на 3 и 7 сутки, увеличение АЧТВ и ПТВ на 1 сутки в сравнении с группой благоприятного исхода АС.
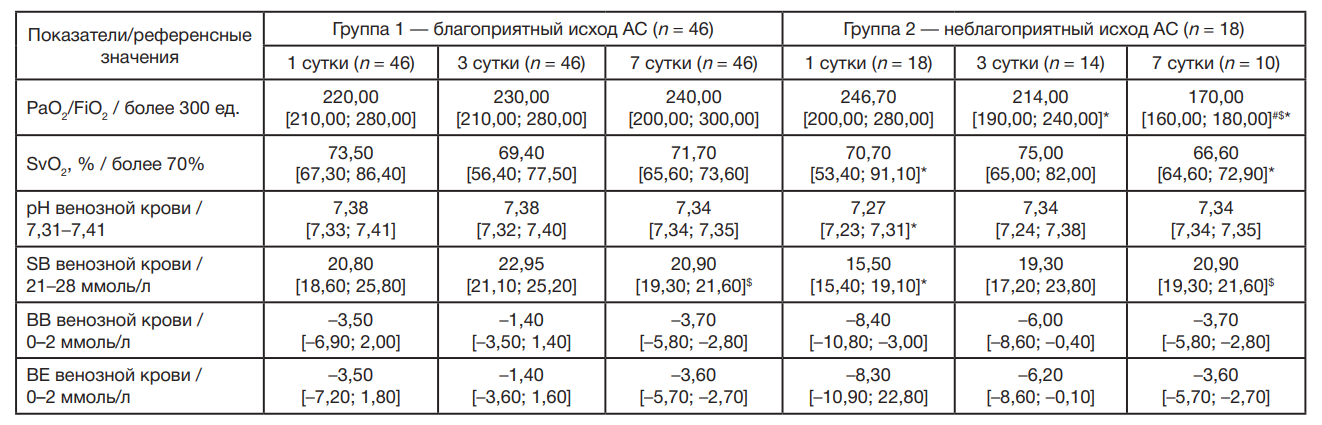
Для пациентов с АС в группах 1 и 2 отмечены низкие значения респираторного индекса (PaO2/FiO2), насыщения кислородом венозной крови (SvO2) относительно общепринятых референсных значений на все сутки наблюдения. У пациентов с АС и неблагоприятным исходом при интерпретации КОС — декомпенсированный метаболический ацидоз на 1 сутки наблюдения, а в группе больных с АС и благоприятным исходом — компенсированный метаболический ацидоз на 1 и 3 сутки (табл. 5). В группе пациентов с АС и неблагоприятным исходом статистически значимо увеличивается концентрация бикарбонат-ионов (SB) на 7 сутки в сравнении с аналогичными значениями на 3 сутки, а также снижается PaO2/FiO2 на 7 сутки в сравнении с 1 и 3 сутками. В группе больных с неблагоприятным исходом выявлено значимое снижение PaO2/FiO2 на 3 и 7 сутки, а SvO2 — на 1 и 7 сутки в сравнении с группой больных АС и благоприятным исходом. Аналогичные изменения происходят с pH венозной крови и концентрацией SB на 1 сутки.
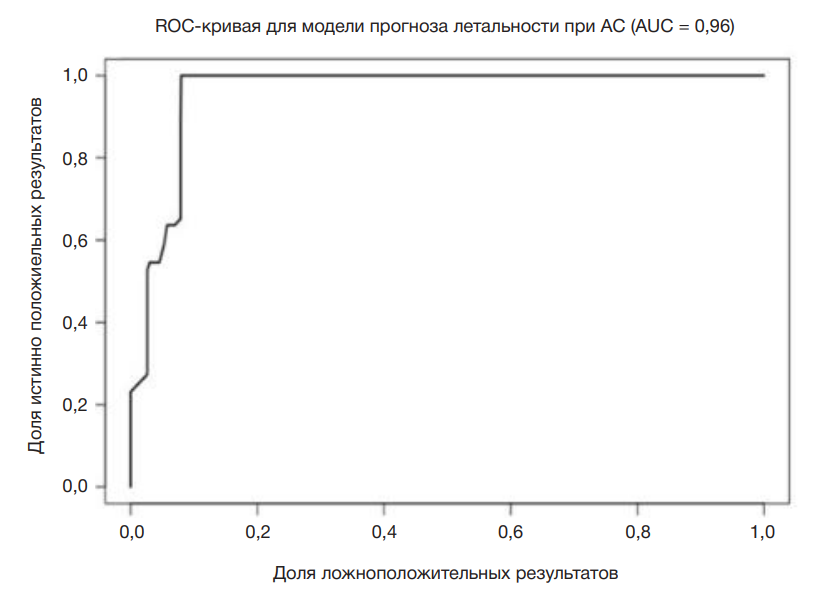
На основании полученных данных для определения вероятности летального исхода при АС была построена модель логистической регрессии и создана программа для ЭВМ «Калькулятор прогноза летальности при абдоминальном сепсисе» [11]. Отбор показателей проводили с помощью построения логистических регрессионных моделей и процедуры пошагового исключения признаков. Полученная модель включала три показателя: SvO2, концентрацию С-РБ и уровень креатинина в сыворотке. В качестве метрики прогноза модели летального исхода при АС выбрана ROC-кривая (рисунок).
С учетом значений показателей SvO2, концентрации в сыворотке С-РБ и креатинина, программа оценивает прогноз летальности при АС, который выражается в процентах. Наблюдаемая зависимость описывается следующим уравнением:
P = 1/(1 + exp(–3,192989 – 0,081246 × SvO2 + 0,016764 × C-РБ + 0,014123 × креатинин)),
где P — вероятность летального исхода (%), SvO2 — показатель насыщения кислородом венозной крови (%), C-РБ — концентрация в сыворотке C-реактивного белка (мг/л), креатинин — уровень креатинина в сыворотке (мкмоль/л).
Согласно нашим данным и построенной модели, летальный исход при АС возникает чаще у пациентов с высокой концентрацией в сыворотке крови С-РБ (более 30 мг/л), креатинина (более 70 мкмоль/л), а также низкими значениями SvO2 (менее 65%). Валидация модели на использованных данных показала следующие результаты: точность — 89,8%, чувствительность — 92,11%, специфичность — 81,82%, площадь под ROC-кривой — 96%.
Расчет прогноза вероятности летального исхода у больных с АС можно проводить ежедневно. С одной стороны, результат может быть расценен как статический, для определения хирургической тактики лечения, выставления показаний к релапаротомии «по требованию». В случае роста вероятности летального исхода, пациентам возможно будут показаны повторные санационные релапаротомии. С другой стороны, результат вероятности летального исхода может быть использован как динамический показатель, для оценки эффективности проводимой терапии, включая оперативное лечение, дорогостоящие методы экстракорпоральной детоксикации. В данной ситуации, когда мы видим рост вероятности летального исхода, больным необходимо менять проводимую терапию, использовать другие методы экстракорпоральной детоксикации.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При анализе результатов оценки с помощью клинической шкалы SOFA выявлены значимые изменения у пациентов с АС в двух группах, что позволяет использовать ее в оценке исходов АС. Это связано с тем, что шкала SOFA отражает функцию многих органов и систем (дыхательная, сердечно-сосудистая, нервная, почечная, печеночная, система гемостаза). Для оценки по этой шкале используют количественные данные, что обеспечивает большую объективность и воспроизводимость результатов [12]. У пациентов с неблагоприятным исходом АС были выявлены лейкоцитоз, нейтрофилия, анемия со снижением количества эритроцитов, концентрации гемоглобина, гематокрита, тромбоцитопения. Данные изменения связаны с активацией врожденного и адаптивного иммунитета, плазменного и тромбоцитарного звеньев гемостаза, сосудистого эндотелия, с последующей иммуносупрессией, проявляющейся лимфоцитопенией, моноцитопенией, повышающих вероятность развития вторичных инфекций [13, 14]. Высокий уровень прокальцитонина и С-РБ в сыворотке в группе неблагоприятного исхода АС отражают выраженность воспалительного ответа при АС. Рост данных показателей может говорить о неблагоприятном исходе в прогнозе развития АС [15–18]. Среди биохимических показателей у больных с неблагоприятным исходом АС стоит отметить рост концентрации креатинина, мочевины, прямого билирубина и активности АЛТ, АСТ в сыворотке, а также снижение СКФ в сравнении с группой благоприятного исхода АС. Данные изменения связаны с дисфункцией органов при АС, развитием синдрома полиорганной недостаточности (СПОН) вследствие повреждения, вызванного патогенами и эндотоксинами, активацией врожденного и адаптивного иммунитета.
Дисфункция митохондрий, вызванная сепсисом, является основной причиной нарушений клеточного метаболизма, недостаточного энергоснабжения и окислительного стресса, которые ведут к апоптозу клеток, дисфункции многих органов, СПОН, что повышает летальность среди пациентов [19–21].
Со стороны системы гемостаза для больных АС с неблагоприятным исходом характерны высокая концентрация в плазме уровня фибриногена, Д-димера, увеличение АЧТВ, ПТВ и снижение ПТИ. Эти изменения связаны с гиперкоагуляционным-гипофибринолитическим фенотипом изменения гемостаза, активацией внешнего и внутреннего путей свертывания, угнетением антикоагулянтных процессов, нарушением фибринолиза, печеночной дисфункцией с нарушением синтеза факторов свертывания, с развитием сепсис-индуцированной коагулопатии, ДВС-синдрома [22–25]. Со стороны КОС и газового состава крови пациентов с АС и неблагоприятным исходом выявлен более выраженный метаболический ацидоз, сопровождающийся высоким уровнем лактата, а также сниженными значениями PaO2/FiO2 и SvO2, что связано с нарушением центральной и периферической гемодинамики, микроциркуляции, нарушением доставки, потребления и утилизации кислорода в тканях, острым почечным повреждением. Уровень лактата в сыворотке крови является важным биомаркером сепсиса и положительно коррелирует с заболеваемостью и смертностью при сепсисе или септическом шоке [26–28].
Согласно нашим данным и построенной модели, высокая концентрация в сыворотке крови С-РБ, креатинина, а также низкие значения SvO2 могут служить ценными клиническими инструментами для прогнозирования исхода АС. Лабораторные показатели, используемые в «Калькуляторе прогноза летальности при абдоминальном сепсисе», доступны для всех медицинских организаций, где оказывается медицинская помощь пациентам с АС, в том числе отделениях нереанимационного профиля, что позволяет своевременно на всех этапах провести оценку вероятности летального исхода заболевания и определить дальнейшую тактику ведения больного.
ВЫВОДЫ
Исследование продемонстрировало, что прогностическая модель, основанная на концентрации в сыворотке крови С-реактивного белка, креатинина и показателя насыщения кислородом венозной крови, является эффективным инструментом для прогнозирования исхода АС. Выявленная значимость этих трех маркеров подчеркивает ключевую роль дисфункции почек, воспалительного ответа и тканевой гипоксии в патогенезе и исходе АС. Построена математическая модель прогноза исхода сепсиса у пациентов с абдоминальной хирургической патологией. Cоздана программа для ЭВМ «Калькулятор прогноза летальности при абдоминальном сепсисе». Разработанная модель представляет собой ценный инструмент для клинической практики и дальнейших научных исследований в области патофизиологиии септических состояний. Своевременное выявление пациентов с высокой вероятностью летального исхода при АС позволит оперативно интенсифицировать терапию, включая раннюю целенаправленную гемодинамическую поддержку, проводить коррекцию антибактериальной терапии, а также повторное хирургическое вмешательство при необходимости повторной санации очага. Это позволит улучшить исходы лечения и снизить летальность при АС. Перспективным остается совершенствование представленной модели прогноза вероятности летального исхода АС путем включения других клинических и лабораторных маркеров для повышения ее прогностической точности и практической применимости.
- Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. The Third International Consensus defnitions for sepsis and septic shock (Sepsis-3): JAMA. 2016; 315 (8): 801–10. DOI: 10.1001/jama.2016.0287.
- Fleischmann-Struzek C, Mellhammar L, Rose N, Cassini A, Rudd KE, Schlattmann P, et al. Incidence and mortality of hospital- and ICU-treated sepsis: results from an updated and expanded systematic review and meta-analysis. Intensive Care Med. 2020; 46 (8): 1552–62. DOI: 10.1007/s00134-020-06151-x.
- Font MD, Thyagarajan B, Khanna AK. Sepsis and Septic Shock — Basics of diagnosis, pathophysiology and clinical decision making. Medical Clinics of North America. 2020; 104 (4): 573–85. DOI: 10.1016/j.mcna.2020.02.011.
- Peksöz R, Ağırman E, Şentürk F, Albayrak Y, Atamanalp SS. A Focus on Intra-Abdominal Sepsis with Biomarkers: A Literature Review. Eurasian J Med. 2022; 54 (Suppl1): 66–70. DOI: 10.5152/eurasianjmed.2022.22296.
- Sartelli M, Abu-Zidan FM, Catena F, et al. Global validation of the WSES Sepsis Severity Score for patients with complicated intra-abdominal infections: a prospective multicentre study (WISS Study). World J Emerg Surg. 2015; 10 (61). DOI: 10.1186/s13017-015-0055-0.
- Sartelli M, Abu-Zidan FM, Labricciosa FM, et al. Physiological parameters for Prognosis in Abdominal Sepsis (PIPAS) Study: a WSES observational study. World J Emerg Surg. 2019; 14 (34). DOI: 10.1186/s13017-019-0253-2.
- Fan Z, Jiang J, Xiao C, Chen Y, Xia Q, Wang J, et al. Construction and validation of prognostic models in critically Ill patients with sepsis-associated acute kidney injury: interpretable machine learning approach. J Transl Med. 2023; 21 (1): 406. DOI: 10.1186/s12967-023-04205-4.
- Vincent JL, Moreno R, Takala J, Willatts S, De Mendonça A, Bruining H, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. Intensive Care Med. 1996; 22 (7): 707–10. DOI: 10.1007/BF01709751. PMID: 8844239.
- Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med. 1985; 13 (10): 818–29. PMID: 3928249.
- Iba T, Nisio MD, Levy JH, Kitamura N, Thachil J. New criteria for sepsis-induced coagulopathy (SIC) following the revised sepsis definition: a retrospective analysis of a nationwide survey. BMJ Open. 2017; 7 (9): e017046. DOI: 10.1136/bmjopen-2017-017046.
- Калькулятор прогноза летальности при абдоминальном сепсисе: свидетельство о государственной регистрации программ для ЭВМ No 2024686256 Российская Федерация. М. В. Осиков, Л. Ф. Телешева, А. Г. Конашов, А. В. Гусев, В. А. Конашов - No 2024685640; заявл. 30.10.24; опубл. 06.11.24.
- Dronamraju S, Agrawal S, Kumar S, Acharya S, Gaidhane S, Wanjari A, et al. Comparison of PIRO, APACHE IV, and SOFA Scores in Predicting Outcome in Patients with Sepsis Admitted to Intensive Care Unit: A Two-year Cross-sectional Study at Rural Teaching Hospital. Indian J Crit Care Med. 2022; 26 (10): 1099– 105. DOI: 10.5005/jp-journals-10071-24323.
- Wiersinga WJ, van der Poll T. Immunopathophysiology of human sepsis. EBioMedicine. 2022; 86: 104363. DOI: 10.1016/j.ebiom.2022.104363
- Стрельцова Е. И., Пешкова И. В., Саматов И. Ю., Валеева В. А., Верещагин Е. И. Лимфопения как фактор, определяющий тяжесть сепсиса, как точный критерий диагностики и как объект терапии. Journal of Siberian Medical Sciences. 2020; (3): 108–25.
- Hany A Zaki, Soumaya Bensliman, Khalid Bashir, et al. Accuracy of procalcitonin for diagnosing sepsis in adult patients admitted to the emergency department: a systematic review and metaanalysis. Syst Rev. 2024; 13: 37. DOI: 10.1186/s13643-023-02432-w.
- Plebani M. Why C-reactive protein is one of the most requested tests in clinical laboratories? Clin Chem Lab Med. 2023; 61 (9): 1540–5. DOI: 10.1515/cclm-2023-0086.
- El Shabrawy RM, Gawish A, Elgabry R, Nasr FM, Diab M, Gamal D. Presepsin, procalcitonin and C reactive protein as diagnostic biomarkers of sepsis in intensive care unit patients. Microbes and Infectious Diseases. 2021; 2. DOI: 10.21608/mid.2021.54196.1100.
- Huang N, Chen J, Wei Y, Liu Y, Yuan K, Chen J, et al. Multi-marker approach using C-reactive protein, procalcitonin, neutrophil CD64 index for the prognosis of sepsis in intensive care unit: a retrospective cohort study. BMC Infect Dis. 2022; 22 (1): 662. DOI: 10.1186/s12879-022-07650-6.
- Balkrishna A, Sinha S, Kumar A, Arya V, Gautam AK, Valis M, Kuca K, Kumar D, Amarowicz R. Sepsis-mediated renal dysfunction: Pathophysiology, biomarkers and role of phytoconstituents in its management. Biomed Pharmacother. 2023; 165: 115183. DOI: 10.1016/j.biopha.2023.115183.
- Ronco C, Bellomo R, Kellum JA. Acute kidney injury. Lancet. 2019; 394: 1949–64. DOI: 10.1016/S0140-6736(19)32563-2.
- Peerapornratana S, Manrique-Caballero CL, Gómez H, Kellum JA. Acute kidney injury from sepsis: Current concepts, epidemiology, pathophysiology, prevention and treatment. Kidney Int. 2019; 96: 1083–99. DOI: 10.1016/j.kint.2019.05.026.
- Marín Oyarzún CP, Glembotsky AC, Goette NP, Lev PR, De Luca G, Baroni Pietto MC, et al. Platelet Toll-Like Receptors Mediate Thromboinflammatory Responses in Patients With Essential Thrombocythemia. Front Immunol. 2020; 11: 705. DOI: 10.3389/fimmu.2020.00705.
- Pravin Patel, James V. Michael, Ulhas P. Naik, Steven E. McKenzie. Platelet FcgRIIA in immunity and thrombosis: adaptive immunothrombosis. J Thromb Haemost. 2021; 19: 1149–60. DOI: 10.1111/jth.15265.
- Tsantes AG, Parastatidou S, Tsantes EA, Bonova E, Tsante KA, Mantzios PG, et al. Sepsis-Induced Coagulopathy: An Update on Pathophysiology, Biomarkers, and Current Guidelines. Life (Basel). 2023; 13 (2): 350. DOI: 10.3390/life13020350.
- Giustozzi M, Ehrlinder H, Bongiovanni D, Borovac JA, Guerreiro RA, Gąsecka A, et al. Coagulopathy and sepsis: Pathophysiology, clinical manifestations and treatment. Blood Rev. 2021; 50: 100864. DOI: 10.1016/j.blre.2021.100864.
- Sijia Liu, Ting Yang, Qingsong Jiang, et al. Lactate and Lactylation in Sepsis: A Comprehensive Review. J Inflamm Res. 2024; 17: 4405–4417. DOI: 10.2147/JIR.S459185.
- Rui Yin, Xiaoshan Yang, Yanfen Yao. Risk factors for acute respiratory distress syndrome in sepsis patients: A meta-analysis. Heliyon. 2024; 10 (18): e37336. DOI: 10.1016/j.heliyon.2024.e37336.
- Sanjana Chetana Shanmukhappa, Srivatsa Lokeshwaran. Affiliations expand. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2024. PMID: 33232065 Bookshelf ID: NBK564395.