ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Изменение LIF и sLIFr в период реконвалесценции (новая коронавирусная инфекция, грипп) у пациентов с гипертонической болезнью
1 Национальный исследовательский Мордовский государственный университет имени Н. П. Огарёва, Саранск, Россия
2 Государственный научно-исследовательский институт особо чистых биопрепаратов Федерального медико-биологического агентства, Санкт-Петербург, Россия
На сегодняшний день актуален анализ риска развития сердечно-сосудистых осложнений у пациентов с гипертонической болезнью (ГБ) после перенесенной новой коронавирусной инфекции (COVID-19). Показана значимость лейкемия-ингибирующего фактора (LIF) и его растворимого рецептора (sLIFr) в прогрессировании ГБ и актуальность циркадианных подходов в оценке вклада провоспалительных цитокинов в патогенез острого нарушения мозгового кровообращения (ОНМК). Целью исследования было сопоставить изменения уровня LIF и sLIFr в период реконвалесценции после COVID-19 и гриппа у больных с ГБ II стадии, выделить значимые особенности для формирования ОНМК и проанализировать связи с циркадианными ритмами. Исследование проводили в четыре этапа (n = 180; возраст 55–60 лет): (1) за 6–8 месяцев до COVID-19; (2–3) на 10–14-й дни после первичного и повторного COVID-19; (4) на 10–14-й после гриппа. На каждом этапе определяли уровни LIF и sLIFr в крови иммуноферментным методом в 7.00–8.00 ч и 19.00–20.00 ч, 12 пациентам на четырех этапах — в 7.00–8.00 ч, 12.00–13.00 ч, 19.00–20.00 ч, 23.00–1.00 ч в течение трех суток. Показано, что у пациентов с ГБ уровень LIF и sLIFr повышен во всех временных точках по сравнению со здоровыми (р ˂ 0,001) и заметно увеличен в 19.00–20.00 ч (р ˂ 0,001). При анализе связи циркадианных ритмов и содержания LIF, sLIFr в крови пациентов с ГБ II стадии после COVID-19 и гриппа определены схожие изменения в виде более выраженного увеличения в 19.00–20.00 ч уровня sLIFr (данные ROC-анализа продемонстрировали предикторную ценность в отношении развития ОНМК в течение года после СOVID-19 при повышении в 19.00–20.00 ч до значений более 7100 пг/мл). Выявленные принципы актуализируют дальнейшее изучение эффектов комплекса LIF/sLIFr при прогрессировании ГБ после острых инфекционных заболеваний.
Ключевые слова: гипертоническая болезнь, LIF, SARS-CoV-2, грипп, sLIFr, циркадианные ритмы, SARS-COV-2
Финансирование: поддержано грантом РНФ «Анализ изменения циркадианных ритмов синтеза цитокинов в крови пациентов с эссенциальной артериальной гипертензией как предиктор развития сердечно-сосудистых осложнений», № 23-25-00147.
Вклад авторов: О. А. Радаева — дизайн исследования, анализ результатов, оформление рукописи; А. С. Симбирцев — формулирование цели исследования, редактирование; Ю. А. Костина — лабораторные исследования, оформление рукописи; М. С. Искандярова — работа с литературой, редактирование; Е. В. Негоднова — работа с литературой, наблюдение за пациентами; Г. А. Солодовникова — статистическая обработка; В. В. Еремеев — редактирование; К. А. Красноглазова, И. О. Бабушкин — статистическая обработках данных за 6 месяцев наблюдения.
Соблюдение этических стандартов: исследование одобрено этическим комитетом МГУ имени Н. П. Огарева (протокол № 12 от 14 декабря 2008 г., дополнительный протокол № 85 от 27 мая 2020). Все пациенты подписали добровольное информированное согласие.
Для корреспонденции: Ольга Александровна Радаева
ул. Ульянова, д. 26а, г. Саранск, 430032, Россия; ur.liam@demaveadar
Лейкемия-ингибирующий фактор (leukemia inhibitory factor, LIF) является представителем семейства интерлейкина 6 (IL6) и обладает широкими плеотропными эффектами за счет взаимодействия как с классическим рецептором IL6 — gp130, так и собственным мембранным рецептором, представленным на кардиомиоцитах, нейронах, эндотелиальных клетках и др. [1]. Роль его растворимого рецептора sLIFr остается спорной, так как описываются и его антагонистические и агонистические связи с LIF. Представлены данные о корреляции уровней LIF/sLIFr c продуктами метаболизма оксида азота (асимметричного и симметричного диметиларгинина (ADMA, SDMA) и др.), что значимо в патогенезе гипертонической болезни (ГБ) [2]. Новой задачей стал поиск факторов, ассоциированных с развитием осложнений у пациентов с ГБ в постковидном периоде, что определило введение новых компонентов в дизайн исследования цитокиновых механизмов прогрессирования ГБ. На сегодняшний день ограничено число данных об изменениях связей цитокиновых механизмов регуляции иммунного ответа с циркадианными ритмами человека под воздействием возбудителей инфекционных заболеваний, в том числе вирусов [3]. В то же время уже с 1995 г. продемонстрирована связь введения вакцин и циркадианных ритмов синтеза цитокинов с указанием значимости индивидуальных особенностей пациентов с хроническими неинфекционными заболеваниями [4]. Российская научная школа хронобиологии имеет длительную историю фундаментальных исследований [5, 6]. Актуальность представленной в статье комплексной проблематики подтверждается и данными обзора, опубликованного в 2024 г., подчеркивающими значимость изучения циркадианного контроля иммуно-сосудистых взаимодействий как в нормальном состоянии, так и при сердечно-сосудистых заболеваниях [7]. Циркадианные ритмы влияют как на иммунную, так и на сосудистую составляющие этих взаимодействий, в первую очередь, посредством регуляции цитокинов хемотаксиса, адгезии их рецепторов на иммунных и эндотелиальных клетках, что особенно значимо при ГБ. Учитывая ранее полученные данные о связи изменений уровней в крови LIF и sLIFr с концентрациями продуктов метаболизма оксида азота в постковидном периоде у пациентов с ГБ [2, 8], данные коллег о значимости циркадианных подходов в оценке вклада провоспалительных цитокинов в патогенез и исход острого нарушения мозгового кровообращения (ОНМК) [9], а также информацию о топической презентации мембранных рецепторов LIF на нейронах и эндотелиальных клетках [1], мы сделали предположение о значимости зависимости изменения циркадианных ритмов синтеза цитокинов в патогенезе ГБ. Цель исследования — сопоставить изменения содержания LIF и sLIFr в крови в период реконвалесценции после перенесенного первичного и повторного COVID-19, а также гриппа у больных с ГБ II стадии, выделить иммунопатогенетически значимые особенности для формирования ОНМК и провести анализ связи с циркадианными ритмами.
ПАЦИЕНТЫ И МЕТОДЫ
Исследование проводили на базе кафедры иммунологии, микробиологии и вирусологии с курсом клинической иммунологии Медицинского института ФГБОУ ВО МГУ имени Н. П. Огарева, клиническую часть с набором пациентов проводили в ГБУЗ РМ «РКБ имени С. В. Каткова», сосудистом центре ГБУЗ РМ № 4 в период с 2019 по 2020 г. и дальнейшим наблюдением в 2020–2024 гг. с учетом места проживания пациента.
Дизайн исследования
Работа включала несколько этапов формирования группы, в результате чего 12 пациентам из 180 изначально включенных с ГБ II стадии был проведен многократный динамический забор крови для изучения в течение суток связи изменения уровня цитокинов в крови (LIF, sLIFr) с циркадианными биологическими ритмами (рис. 1).
Этап 1. Декабрь 2019 г. — январь–март 2020 г. (до пандемии)
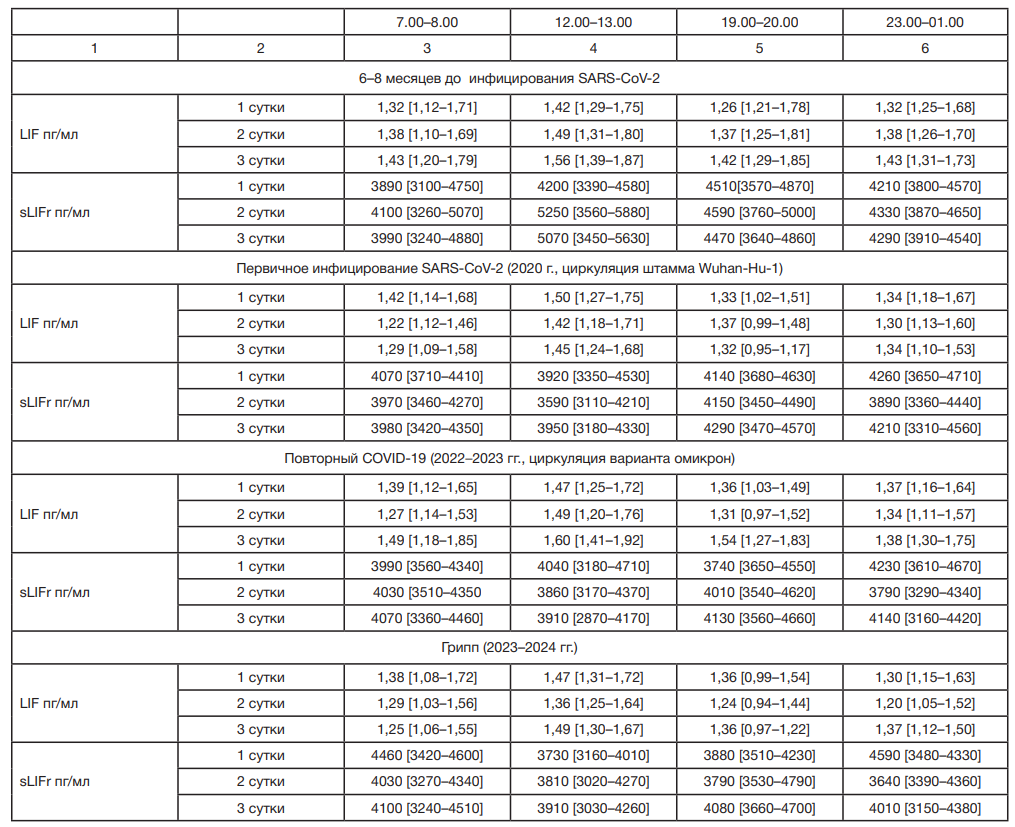
Был проведен набор 180 пациентов с ГБ II стадии (80 женщин и 100 мужчин) для определения утренних (7.00–8.00 ч) и вечерних (19.00–20.00 ч) концентраций LIF, sLIFr, а у 40 пациентов из этой группы определяли в крови уровень цитокинов в четырех временных точках (7.00–8.00 ч, 12.00– 13.00 ч, 19.00–20.00 ч, 23.00–1.00 ч) в течение трех суток.
Этап 2. Май — ноябрь 2020 г. (период циркуляции штамма Wuhan-Hu-1)
У 68 человек (30 женщин и 38 мужчин) из 180 пациентов, включенных в исследование на этапе 1, был проведен анализ утренних и вечерних концентраций того же ряда цитокинов, а у 27 пациентов (10 женщин и 17 мужчин) из 68 человек — содержания в крови цитокинов в четырех временных точках (7.00–8.00 ч, 12.00–13.00 ч, 19.00–20.00 ч, 23.00–1.00 ч) в течение трех суток на 10–14-й дни реконвалесценции после первичного COVID-19 с фиксацией развития сердечнососудистых осложнений (ОНМК, ТНМК, ИМ). Методом телефонного опроса подтверждали случаи ОНМК, ТНМК на основе медицинской документации в течение последующего года наблюдения и выделяли статистически независимые предикторы развития ОНМК/ТНМК и ИМ (из 68 пациентов 11 больных перенесли ОНМК и ТНМК, два пациента ИМ, при этом все 68 пациентов характеризовались по шкале SCORE2ОР, сопоставимым с высоким риском развития фатальных и нефатальных сосудистых осложнений).
Этап 3 — 2022–2023 гг. (циркуляция штамма омикрон)
У 24 пациентов (из 27 участников этапа 2, имеющих ГБ II стадии и данные о содержании в крови цитокинов в течение трех суток) определяли содержание в крови цитокинов в четырех временных точках (7.00–8.00 ч, 12.00–13.00 ч, 19.00–20.00 ч, 23.00–1.00 ч) в течение трех суток на 10–14-й дни реконвалесценции после повторного COVID-19.
Этап 4. Декабрь 2023 г. — март 2024 г. (период повышения заболеваемости гриппом)
У 12 пациентов из 24 больных с ГБ II стадии, обследованных на этапе 3, определяли содержания в крови цитокинов в четырех временных точках (7.00–8.00 ч, 12.00–13.00 ч, 19.00–20.00 ч, 23.00–1.00 ч) в течение трех суток на 10–14-й дни реконвалесценции после перенесенного гриппа (тип A).
Характеристика пациентов
Общеклиническая характеристика пациентов в период наблюдения подтверждает высокую степень сопоставимости больных, включенных в исследование по уровням систолического артериального давления (САД), диастолического артериального давления (ДАД), среднего за ночные часы значения систолического артериального давления (САДн) и диастолического артериального давления (ДАДн); индексу массы тела (ИМТ), уровням липопротеинов низкой плотности (ЛПНП), холестерина, креатинина, мочевины, скорости клубочковой фильтрации (СКФ), глюкозы (см. приложение).
Группа контроля включала шесть сопоставимых по полу и возрасту здоровых лиц (три женщины и трое мужчин), сформированная из 32 здоровых лиц, включенных параллельно с группой пациентов с ГБ на этапе 1 для дальнейшего прохождения четырех этапов наблюдения.
Диагноз COVID-19 был выставлен в соответствии с актуальными временными методическими рекомендациями по профилактике, диагностике и лечению новой коронавирусной инфекции; у пациентов отмечалось среднетяжелое течение, пневмония (КТ I–II). Применяли следующие сопоставимые схемы терапии (исследователи не влияли на назначение терапии):
- первичное инфицирование SARS-CoV-2 (2020 г.): дексаметазон 16 мг/сут. со снижением, азитромицин 1500 мг/сут., гепарин натрия 10 000 МЕ/сут.;
- повторное инфицирование COVID-19 (2022–2023 гг.; среднетяжелое течение, пневмония (КТ I–II)): молнупиравир 1600 мг/сут. со 2–3-го дня клинических проявлений в соответствии с инструкцией к препарату, парацетамол для снижения температуры до 1000 мг/сут.;
- грипп (2023–2024 гг.; диагноз выставлен в соответствии с клиническими рекомендациями по лечению гриппа у взрослых 2022 г. с подтверждением лабораторными методами: иммунохроматографического экспресс-исследования носоглоточного мазка на вирусы гриппа A и B с подтверждением молекулярно-генетическим методом): осельтамивир 75 мг 2 раза день не позднее трех суток после первых клинических проявлений в дозировке, указанной в инструкции к препарату; парацетамол для снижения температуры до 1000 мг/сут.
Критерии включения пациентов в исследование 2019–2020 гг. (этап 1)
Критерии включения: ГБ II стадии; длительность ГБ составляет 10 лет; сопоставимая гипотензивная терапия (иАПФ + тиазидный/тиазидоподобный диуретик); возраст 55–60 лет; концентрации показателей липидного обмена: общего холестерина — не более 5,0 ммоль/л, липопротеинов низкой плотности — не более 3,0 ммоль/л, липопротеинов высокой плотности — более 1,0 ммоль/л, триглицеридов — не более 1,7 ммоль/л, толщина слоя интима медиа сонной артерии — не более 0,9 мм, уровень глюкозы — не более 5,5 мг/дл, ИМТ — не более 30 кг/м2; сопоставимые характеристики режима дня (сон с 23.00 ч до 6.00 ч, последний прием пищи в 20.00 ч, отсутствие нарушения сна и приема снотворных средств и/или препаратов, содержащих мелатонин (оценку данных характеристик проводил врач-невролог); подписание пациентом информированного согласия.
Дополнительные критерии, определяющие включение больных с ГБ II стадии и здоровых в исследование в 2022–2024 гг. в рамках формирования основной группы с анализом циркадианных зависимостей содержания LIF и sLIFr в крови: введение двух доз вакцины Гам-КОВИД-ВАК в 2021 г.
Критерии невключения в 2019 г. и 2020–2024 гг. (общие)
Критерии невключения: сахарный диабет 1-го или 2-го типа, заболевания аллергического/аутоиммунного характера, хронические инфекционные заболевания (ВИЧ, гепатит B и С), психические заболевания, симптоматическая артериальная гипертензия, курение; неготовность к долгосрочному обследованию; прием антигипертензивных препаратов, помимо иАПФ и/или тиазидных/тиазидопобных диуретиков (только для группы с ГБ II стадии).
Критерии исключения
Критерии исключения были общими: назначение антигипертензивных препаратов помимо иАПФ и/или тиазидных/тиазидоподобных диуретиков (только для группы с ГБ II стадии), развитие ОНМК, ТНМК, ИМ и других состояний, определяющих формирование III стадии ГБ, диагностирование аутоиммунной патологии в период наблюдения, потеря контакта с пациентом. Критерии исключения обосновали формирование группы из 180 пациентов, соответствующих критериям исследования в течение всего периода наблюдения.
Процедура забора крови
Время забора крови — 7.00–8.00 ч, 12.00–13.00 ч, 19.00– 20.00 ч, 23.00–1.00 ч). Цитокины LIF и sLIFr были выделены в данной работе на основании результатов научных исследований о циркадианных закономерностях синтеза цитокинов человека и ранее проведенных собственных исследований по изучению цитокин-опосредованных механизмов патогенеза ГБ [6].
Забор крови осуществляли с использованием систем Вакутайнер (BD Vacutainer, США) (прием пищи происходил не менее чем за 4 ч). В течение 15 мин проводили центрифугирование крови при 1500–2000 об./мин. Сыворотку отделяли и хранили при температуре –30 °С не более 30 сут. в промаркированных пробирках. От забора крови до процедуры ее заморозки выдерживали время 60 мин. Анализ осуществлял сертифицированный специалист на иммуноферментном анализаторе «Personal Lab TM» (Adaltis, Италия). Для регистрации в сыворотке крови уровней LIF и sLIFr использовали следующие тестсистемы: LIF (eBioscience (Bender MedSystems GmbH, Austria)) — аналитическая чувствительность тест-системы составляет 0,66 пг/мл, интервал детекции — 0,66–200 пг/мл; sLIFr (eBioscience (Bender MedSystems GmbH, Austria) — аналитическая чувствительность тест-системы — 0,052 нг/мл, интервал детекции — 0,052 –5 нг/мл.
Статистическая обработка результатов
Для статистической обработки результатов применяли две программы с учетом поставленных задач StatTech v. 2.8.8 («Статтех», Россия) и Stat Soft Statistica 10.0 (США). При количестве пациентов менее 50 (группы с оценкой шести циркадианных точек) нормальность распределения оценивали с помощью критерия Шапиро–Уилка; при количестве пациентов более 50 человек (группы с оценкой двух временных точек) — критерий Колмогорова– Смирнова. Далее количественные показатели, имеющие нормальное распределение, описывали с помощью средних арифметических величин (M) и стандартных отклонений (SD). В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Сравнение двух несвязанных групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий, выполняли с помощью t-критерия Стьюдента. Сравнение двух несвязанных групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью U-критерия Манна–Уитни. Для связанных выборок (сравнение показателей в динамике у 12 пациентов с ГБ, а также изменения у шести здоровых) применяли критерий Уилкоксона. Направление и тесноту корреляционной связи между двумя количественными показателями оценивали с помощью коэффициента ранговой корреляции Спирмена (при распределении показателей, отличном от нормального). Прогностическую модель, характеризующую зависимость количественной переменной от факторов, разрабатывали с помощью метода линейной регрессии. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применяли метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определяли по наивысшему значению индекса Юдена. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
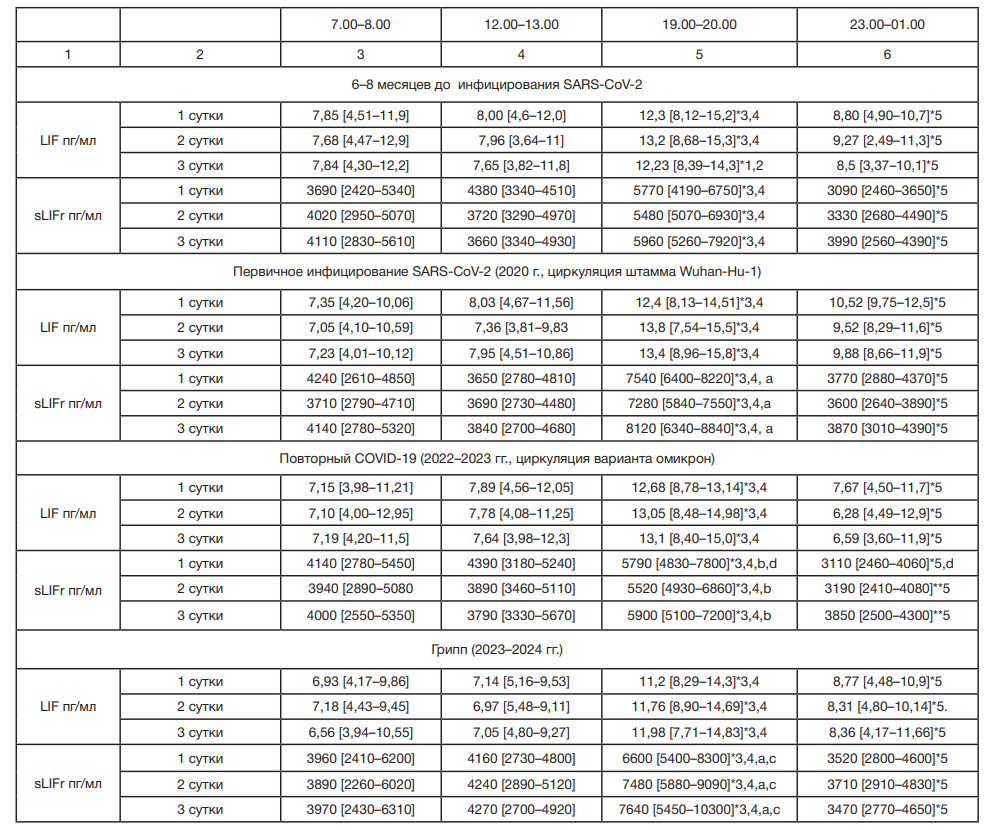
По результатам этапа 1 исследования, включающего данные 180 пациентов с ГБ II стадии и 32 человека группы здоровых (анализировали показатели в 7.00–8.00 ч и 19.00–20.00 ч), было показано, что пациенты с ГБ II имеют более высокие (p ˂ 0,001) уровни LIF и sLIFr в 7.00–8.00 ч и в 19.00–20.00 ч (табл. 1) по сравнению со здоровыми лицами (табл. 2). При этом у пациентов с ГБ регистрируется достоверный рост LIF и sLIFr в крови к 19.00–20.00 ч по сравнению с данными, полученными в 7.00–8.00 ч (на 65% (95% ДИ — [43–87]%) и 71,3% (95% ДИ — [52,8–82,1]% соответственно; p ˂ 0,001), табл. 1). У лиц без ГБ изменения уровня LIF и sLIFr в течение дня не зарегистрировано (табл. 2).
На втором этапе исследования у 68 пациентов с ГБ II стадии и 28 пациентов без ГБ из группы этапа 1 повторно проанализированы уровни LIF и sLIFr в крови на 10–14-й дни периода ранней реконвалесценции после перенесенного первичного COVID-19 (табл. 1). У пациентов с ГБ количественные различия уровней LIF между периодами до SARS-CoV-2 инфицирования и ранней реконвалесценцией не определены (р > 0,05). Зафиксированы более высокие концентрации sLIFr в крови больных с ГБ II стадии в 19.00–20.00 ч с ростом на 92% [83–121]% при сопоставлении с данными в 7.00–8.00 ч; процент роста в вечернее время выше, чем до пандемии (р ˂ 0,01) (табл. 1). У лиц без ГБ отличий от доковидного периода в количественных показателях уровней LIF и sLIFr не выявлено (р > 0,05), при этом сохранены отклонения от результатов у пациентов с ГБ, зарегистрированных до SARS-CoV-2 инфицирования.
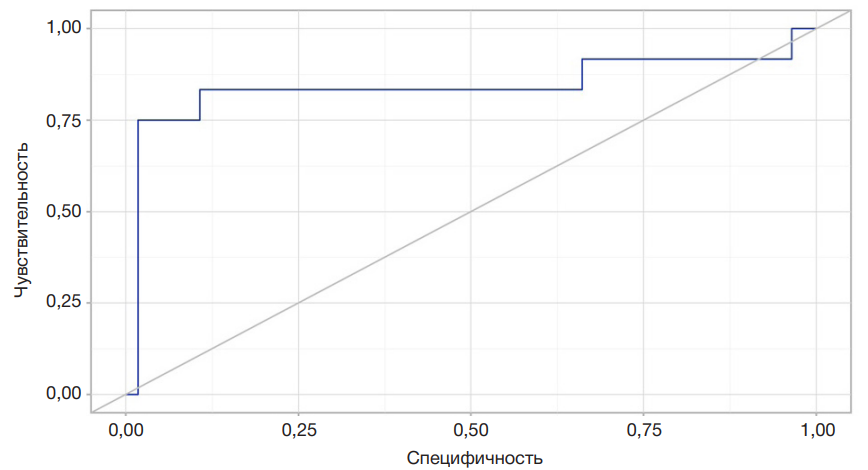
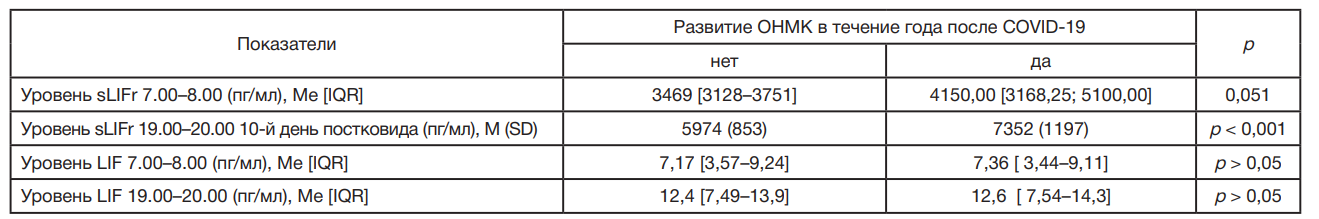
В рамках этапа 2 было также начато наблюдение за развитием сердечно-сосудистых осложнений (ОНМК, ТНМК и ИМ) у 68 больных с ГБ II стадии в течение года после перенесенного первичного COVID-19 и последующее ретроспективное сопоставление c утренними и вечерними концентрациями LIF и sLIFr на 10–14-й дни периода реконвалесценции после первичного COVID-19 (табл. 3). При анализе уровня sLIFr в 7.00–8.00 ч в зависимости от развития ОНМК в течение года после COVID-19 не удалось установить статистически значимых различий (p = 0,051) (использовали U-критерий Манна–Уитни). При анализе уровня sLIFr в 19.00–20.00 ч на 10–14-й дни периода ранней реконвалесценции после перенесенного первичного COVID-19 (штамм Wuhan-Hu-1) в зависимости от развития ОНМК и ТНМК в течение последующего года были установлены существенные различия (p < 0,001) (использовали t-критерий Стьюдента) (табл. 3). Уровни LIF в 7.00–8.00 ч и 19.00–20.00 ч у пациентов в зависимости от развития ОНМК или ТНМК в последующий год не отличались (p > 0,05). При оценке зависимости вероятности развития ОНМК или ТНМК от уровня содержания в сыворотке периферической крови sLIFr в 19.00–20.00 ч на 10–14-й дни постковида при применении ROCанализа нами была построена кривая (рис. 2) (значение 0,842 ± 0,074 соответствует площади под построенной кривой с 95% ДИ: 0,697–0,987; p < 0,001). Критический уровень повышения sLIFr в крови больных с ГБ II стадии в период ранней реконвалесценции после перенесенного COVID-19 при оценке в 19.00–20.00 ч составил 7100 пг/мл, что идентично наивысшему значению индекса Юдена. Повреждение головного мозга у пациентов с ГБ II стадии прогнозировалось при значении уровня в крови sLIFr 19.00–20.00 ч на 10–14-й дни постковида выше данной величины или равном ей с чувствительностью и специфичностью 75% и 98,2% соответственно.
На этапе 3 (после повторного COVID-19) при оценке утренних и вечерних концентраций анализируемых цитокинов выявлено, что для пациентов с ГБ II стадии (27 человек) и лиц без ГБ (18 человек) характерны закономерности доковидного периода, с сохранением отличий от здоровых (p ˂ 0,001; табл. 1, табл. 2). Изменений в виде увеличения степени повышения sLIFr в 19.00–20.00 ч у лиц с ГБ, которое регистрировалось на 10–14-й дни периода реконвалесценции после первичного COVID-19, при повторном COVID-19 не происходило.
Этап 4 позволил проанализировать изменения у 12 пациентов с ГБ II стадии и шести лиц без ГБ, находившихся под наблюдением с первого этапа исследования, уровней LIF и sLIFr в крови в период ранней реконвалисценции после перенесенного гриппа. Полученные данные продемонстрировали у пациентов с ГБ II стадии тенденции, схожие с тенденциями периода после первичного COVID-19 (табл. 1): более выраженный рост sLIFr в 19.00–20.00 (на 91% (95% ДИ [81–126]%), что выше (p ˂ 0,01), чем в доковидный период и после повторного COVID-19. Ранее в 2019 г. были проанализированы уровни sLIFr в крови в 7.00–8.00 и в 19.00–20.00 у 60 пациентов с ГБ II стадии, не включенных в данный блок работы, но участвующих в исследовании цитокиновых механизмов прогрессирования ГБ (работа проводится с 2012 г. по настоящее время). Указанные больные сопоставимы по всем критериям включения и исключения из исследования, описанным в данной работе для больных четырех этапов наблюдения. После перенесенного гриппа в 2019 г. у пациентов с ГБ II стадии не регистрировались отклонения суточных кривых от данных этих же пациентов за 9–10 месяцев до инфицирования (р > 0,05): до гриппа в 7.00–8.00 ч — 3720 [2210–4960] пг/мл, в 19.00–20.00 ч — 5510 [3700–6240] пг/мл; 10–14-й дни реконвалесценции после гриппа в 7.00–8.00 ч — 4140 [2640–4860] пг/мл, в 19.00–20.00 ч — 5680 [3380–6420] пг/мл.
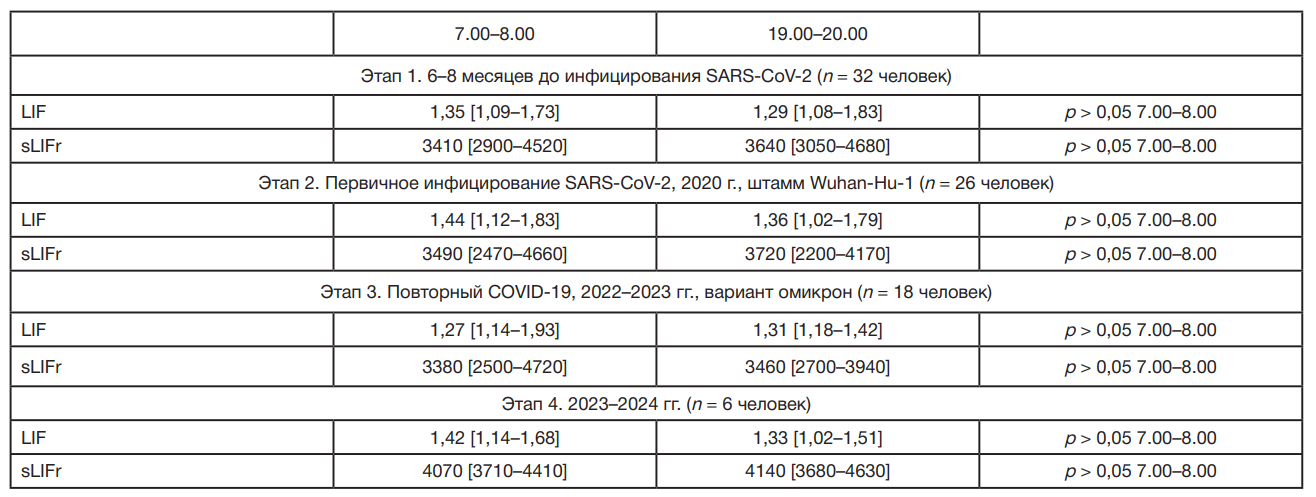
С учетом разных объемов выборок на этапах 1–4, для подтверждения связей выявленных закономерностей с циркадианными биологическими ритмами и большей прогностической ценности отличий между вечерними количественными характеристиками sLIFr пациентов с ГБ и здоровыми лицами, сформированы группы из 12 пациентов с ГБ II стадии и 6 здоровых пациентов, у которых на всех четырех этапах исследования был выполнен забор крови в четырех временных точках в течение трех суток. Сопоставление содержания LIF и sLIFr в крови в указанной группе после первичного в 2020 г. (этап 2) и повторного COVID-19 в 2022–2023 гг. (этап 3), вызванного разными штаммами SARS-CoV-2, подтвердило данные, зарегистрированные по двум временным точкам: изменение суточной динамики уровня sLIFr в виде более выраженного увеличения в вечернее время (19.00–20.00 ч) происходило только в период ранней реконвалесценции после первичного COVID-19 (р ˂ 0,001; табл. 4). При анализе данных пациентов с ГБ II при инфицировании вирусом гриппа тип А в период осенне-зимнего сезона 2023–2024 гг. определена трехсуточная тенденция повышения степени роста sLIFr в крови в 19.00–20.00 ч, сопоставимая с периодом при первичном SARS-CoV-2инфицировании в период циркуляции штамма Wuhan-Hu-1. Изменения у пациентов с ГБ имели связи с циркадианными биологическими ритмами.
У здоровых лиц отсутствовали изменения концентрации LIF и sLIFr в крови в течение суток как до перенесенного COVID-19, так и в период реконвалесценции (табл. 5), и уровни LIF и sLIFr были достоверно ниже, чем у больных с ГБ II стадии (р ˂ 0,001) и не изменялись в период реконвалесценции после гриппа. Связи с циркадианными ритмами в группе здоровых выявлено не было.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Пандемия новой коронавирусной инфекции привлекла внимание исследователей и клиницистов к длительности и особенностям цитокиновых изменений после перенесенного заболевания; идут обсуждения критериев и проявления постковидного синдрома. У пациентов с ГБ важен контроль за повышением риска развития сердечнососудистых осложнений, а также понимание факторов, которые это определяют. По данным доковидного периода (этапа 1 исследования) наша исследовательская группа выявила особенности пациентов с ГБ II стадии в виде более высоких концентраций LIF и sLIFr в крови с тенденцией к увеличению в вечернее время. В 2017 г. нами продемонстрировано, что рост на фоне ГБ содержания LIF и sLIF регистрируется до назначения антигипертензивных препаратов и выступает компонентом патогенеза ГБ, на фоне достижения целевого уровня АД при приеме антигипертензивных препаратов определялось снижение sLIFr, динамики к уменьшению LIF на фоне терапии у больных с ГБ выявлено не было [2]. В связи с опубликованной на международных научных платформах информации о повышении экспрессии LIF после церебральной ишемии и о нейронах как основных источниках LIF [10], обоснована значимость изучения связи данного цитокина и его растворимого рецептора как предикторов изменения риска развития ОНМК у пациентов с ГБ, в том числе после перенесенного COVID-19, которая и была подтверждена на этапе 2 нашего исследования. Основной пул сердечнососудистых осложнений у больных с ГБ в течение года после перенесенного первичного COVID-19 составили случаи ОНМК и ТНМК, а их предикцией с высокой чувствительностью и специфичностью выступил рост в 19.00–20.00 ч уровня в крови sLIFr выше 7100 пг/мл на 10–14-й дни периода ранней реконвалесценции. Ранее в литературе описывалось, что между сосудосуживающими и сосудорасширяющими молекулами, которые влияют на кровоснабжение мозга и усиливают спектры мощности электроэнцефалограммы, существует баланс, который, вероятно, регулируется цитокинами и соотносится с циркадианными биологическими ритмами [11]. Возможно, это проявляется также формированием связи содержания изучаемых цитокинов в крови на фоне гипертензии с циркадианными биологическими ритмами и не регистрируется у лиц с нормальным артериальным давлением. При этом остается открытым вопрос о механизме влияния sLIFr на развитие ОНМК и ТНМК. Если рассматривать sLIFr как фактор блокирования LIF, то в остром периоде ишемии его повышение может обладать протективными свойствами, так как рядом авторов отмечена провоспалительная роль LIF на фоне острого ишемического повреждения нейронов [10]. Далее LIF выступает нейротрофическим фактором [10] и его блокирование через sLIFr будет иметь негативный характер. Эти данные ставят новые патогенетические вопросы перед исследователями. Может ли длительное повышение LIF у лиц с ГБ до ОНМК выступать потенциальным протективным нейротрофическим буфером, повышающим устойчивость нейронов к факторам повреждения на фоне гипертензии, или наоборот, поддерживает воспалительные процессы, в том числе с увеличением проницаемости гематоэнцефалического барьера? И какова роль sLIFr, если он обладает не только блокирующей активностью в отношении LIF, но и собственными независимыми от LIF иммунопатогенетическими эффектами в виде корреляции с увеличением в крови факторов, ассоциированных с прогрессированием дисбаланса синтеза NO: SDMA и ADMA [2]. Одной из точек приложения эффектов действия LIF/sLIFr может выступить микроглия [12–13].
При анализе циркадианных ритмов содержания LIF, sLIFr в крови пациентов с ГБ II стадии после перенесенного COVID-19 и гриппа наибольший интерес представляют данные о схожести изменений в виде более выраженного увеличения в 18.00–19.00 ч уровня sLIFr при первичном SARS-CoV-2 и после перенесенного гриппа. Важно отметить, что, по нашим данным, такой тенденции после перенесенного гриппа ранее (до пандемии) не регистрировалось у пациентов с ГБ. Учитывая, что результаты исследования после первичного COVID-19 продемонстрировали связь между уровнем sLIFr в крови более 7100 пг/мл в 19.00–20.00 ч и развитием ОНМК, ТНМК, а такие уровни в настоящее время определяются у пациентов с ГБ и после гриппа, необходимо привлечь внимание клиницистов к потенциальной группе повышенного риска сердечно-сосудистых осложнений. Необходимо продолжить исследования с расширением группы наблюдения в новом эпидемическом периоде, так как полученные данные подчеркивают значимость анализа циркадианных закономерностей, влияющих на цитокиновую регуляцию развития ОНМК при ГБ, и их актуальность находит подтверждение в публикациях других исследователей иммунопатогенеза ОНМК [14].
Особенности и длительность цитокиновых изменений в постковидном периоде исследователи чаще связывают именно с первичным контактом представителей популяции с вирусом, что было характерно для SARS-CoV-2 в 2020 г. По представленным нами данным при повторном инфицировании пациентов с ГБ коронавирусом в 2022–2023 гг., зарегистрированного ранее более выраженного роста уровня sLIFr в 19.00–20.00 ч выявлено не было, что можно объяснить нивелированием выраженности иммунного воздействия вируса на фоне круглогодичной циркуляции, снижением вирулентности и эффектами вакцинации [15]. По эпидданным сезонный рост случаев гриппа был менее выражен в 2020–2022 гг. на фоне доминирования SARSCoV-2, что может быть причиной отмены эффективности иммунной памяти. Отсутствие вакцинации у указанной группы пациентов (подписание отказа от вакцинации против гриппа) также определило формирование «цитокинового хвоста» с более выраженным повышением уровня sLIFr после перенесенного гриппа как «новой инфекции».
Рост уровня sLIFr может снижать процент взаимодействия между LIF и его мембранным рецептором на стволовых клетках, что способно влиять на изменение процесса их дифференцировки в нейроны, так как по экспериментальным данным доставка LIF в мозг мышей увеличивает самообновление нейронных стволовых клеток в субвентрикулярной зоне и обонятельной луковице с вектором дифференцировки в нейроны [16].
ВЫВОДЫ
Система LIF/sLIFr обладает значимым патогенетическим компонентом в развитии ОНМК и ТНМК у пациентов с ГБ после перенесенной новой коронавирусной инфекции. Выявленный схожий рост вечерних концентраций sLIFr и после перенесенного гриппа актуализирует анализ вклада более широкого спектра вирусов (варианты SARS-CoV-2 или гриппа) в отношении повышения риска развития ОНМК в течение последующего года у пациентов с ГБ. Хронобиология иммунного ответа на стыке макроорганизмвирус определяет прогрессирование неинфекционных сопутствующих заболеваний и должна быть одной из частей персонализированного подхода в расчете рисков развития осложнений у коморбидного пациента в будущем. Продемонстрированное формирование связи между изменениями концентрации sLIFr и биологическими циркадианными ритмами обосновывает научную и патогенетическую значимость изучения вечерних концентраций данного цитокина у пациентов с гипертензией (в интервале 19.00–20.00 ч). Выявленные хронобиологические закономерности данного процесса открывают новые перспективы в изучение эффектов действия комплекса LIF/sLIFr в иммунопатогенезе ГБ и развитии ОНМК у указанной категории больных с учетом перенесенных вирусных инфекций (COVID-19, грипп).

- The Human Protein Atlas project is funded by the Knut & Alice Wallenberg foundation. 2023 [18.10.2024]. Available from: https://www.proteinatlas.org/.
- Радаева О. А., Симбирцев А. С. Изменения сывороточных уровней фактора, ингибирующего лейкемию (LIF), и растворимого рецептора LIF (sLIFr) при развитии эссенциальной артериальной гипертензии II стадии. Патогенез. 2017; 3 (15): 63–69. Доступно по ссылке: http://pathogenesis.pro/index.php/pathogenesis/article/view/126 (дата обращения 20.10.2024).
- Mok H, Ostendorf E, Ganninger A, Adler AJ, Hazan G, Haspel JA. J Clin Invest. 2024; 134 (3): e175706. Available from: https://doi.org/10.1172/JCI175706.
- Langlois PH, Smolensky MH, Glezen WP, Keitel WA. Diurnal variation in responses to influenza vaccine. Chronobiol Int. 1995; 12 (1): 28– 36. Available from: https://doi.org/10.3109/07420529509064497.
- Катинас Г. С., Чибисов С. М., Халаби Г. М., Дементьев М. В. Аналитическая хронобиология. М.: Бейрут, 2017; 224 с.
- Чибисов С. М., Рапопорт С. И., Благонравова М. Л. Хронобиология и хрономедицина. М.: Изд-во РУДН, 2018; 828 с.
- Zeng Q, Oliva VM, Moro MÁ, Scheiermann C. Circadian Effects on Vascular Immunopathologies. Circ Res. 2024; 134 (6): 791–809. Available from: https://doi.org/10.1161/CIRCRESAHA.123.323619.
- Радаева О. А., Симбирцев А. С., Костина Ю. А., Искандярова М. С., Негоднова Е. В., Машнина С. В. и др. Изменения циркадианных ритмов уровней цитокинов в крови пациентов с эссенциальной гипертензией в постковидном периоде. Вестник РГМУ. 2023; (6): 14–20. Доступно по ссылке: https://vestnik.rsmu.press/files/issues/vestnik.rsmu.press/2023/6/2023-6-1385_ru.pdf?lang=ru (дата обращения 20.10.2024).
- Mergenthaler P, Balami JS, Neuhaus AA, Mottahedin A, Albers GW, Rothwell PM, et al. Stroke in the Time of Circadian Medicine. Circ Res. 2024; 134 (6): 770–90. Available from: https://doi.org/10.1161/CIRCRESAHA.124.323508.
- Suzuki S, Tanaka K, Suzuki N. Ambivalent Aspects of Interleukin-6 in Cerebral Ischemia: Inflammatory versus Neurotrophic Aspects. Journal of Cerebral Blood Flow & Metabolism. 2009; 29: 464–79. Available from: https://doi:10.1038/jcbfm.2008.141.
- Jin RR, Cheung CN, Wong CHY, Lo CCW, Lee CPI, Tsang HW, et al. Sleep quality mediates the relationship between systemic inflammation and neurocognitive performance. Brain Behav Immun Health. 2023; 30: 365–74. Available from: https://doi.org/10.1016/j.bbih.2023.100634.
- Zielinski MR, Gibbons AJ. Neuroinflammation, Sleep, and Circadian Rhythms. Front Cell Infect Microbiol. 2022; 12: 853096. Available from: https://doi.org/10.3389/fcimb.2022.853096.
- Jiao H, Kalsbeek A, Yi CX. Microglia, circadian rhythm and lifestyle factors. Neuropharmacology. 2024; 257: 110029. Available from: https://doi.org/10.1016/j.neuropharm.2024.110029.
- Khan S, Siddique R, Liu Y, Yong VW, Xue M. Towards improving the prognosis of stroke through targeting the circadian clock system. Int J Biol Sci. 2024; 20 (2): 403–13. Available from: https://doi.org/10.7150/ijbs.88370.
- Punj M, Desai A, Hashash JG, Farraye FA, Castillo PR. COVID-19 breakthrough infections and sleep disorders: A population-based propensity matched analysis. Sleep Med X. 2023; 6: 100089. Available from: https://doi.org/10.1016/j.sleepx.2023.100089.
- Bauer S, Patterson PH. Leukemia inhibitory factor promotes neural stem cell self-renewal in the adult brain. The Journal of neuroscience: the official journal of the Society for Neuroscience. 2006; 26:12089–99. Available from: https://doi:10.1523/JNEUROSCI.3047-06.2006.