ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Интраназальное введение липополисахарида крысам Sprague-Dawley как биомодель острого респираторного дистресс-синдрома
1 Российский университет дружбы народов имени Патриса Лумумбы, Москва, Россия
2 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени В. И. Кулакова, Москва, Россия
3 Российский научный центр хирургии имени Б. В. Петровского, Москва, Россия
Для острого респираторного дистресс-синдрома (ОРДС) характерны высокая частота летальных исходов и отсутствие патофизиологической терапии. Для воспроизведения у животных ОРДС используют интратрахеальное введение липополисахарида (ЛПС). Ограничением метода является необходимость использования оборудования для выполнения интубации и контроля за состоянием животного. Целью исследования было оценить возможность использования интраназального введения ЛПС вместо интратрахеального и определить его оптимальную дозу. ЛПС E. coli O111:B4 7,5 мг/кг или 15 мг/кг или NaCl 0,9% в объеме 150 мкл вводили 21 крысе Sprague-Dawley. Через 48 ч кровь из хвостовой вены отбирали для определения лейкоцитарной формулы и концентрации TNFa. Легкие извлекали для оценки сухого остатка (Wet/dry ratio), определения уровней экспрессии генов про- и противовоспалительных цитокинов методом ПЦР-РВ, определения относительного количества CD68, CD86 и MHC II положительных клеток в ткани легкого методом проточной цитометрии. W/d ratio было выше при дозе 15 мг/кг массы тела (p = 0,0228, Ordinary one-way Anova). В крови содержание лимфоцитов было снижено (p = 0,0019, Ordinary one-way Anova), а нейтрофилов повышено (p = 0,0021, Ordinary one-way Anova) при обеих дозах введения. Количество CD86 (p = 0,0014, Ordinary one-way Anova) и MHC II положительных клеток (p = 0,0050, Ordinary one — way Anova) повышалось после введения ЛПС. Уровень экспрессии гена IL10 был значимо повышен при дозе 15 мг/кг (p = 0,0024, Ordinary one-way Anova), а IL4 (p = 0,0194, Ordinary one-way Anova) снижен при дозе 7,5 мг/кг. Таким образом, интраназальное введение ЛПС может быть использовано для воспроизведения ОРДС у крыс Sprague-Dawley. Высокая доза введения приводит к быстрому развитию воспалительных процессов в легких.
Ключевые слова: ЛПС, ОРДС, липополисахарид, крысы Sprague-Dawley, цитокин, модель на животных, уровень экспрессии
Финансирование: работа поддержана Российским научным фондом (номер гранта 24-25-00203).
Благодарности: авторы благодарят руководителя лаборатории патологии клетки НИИ морфологии человека имени А. П. Авцына к. б. н. Д. А. Арешидзе за измерение показателей общей формулы крови животных.
Вклад авторов: В. В. Киселева — дизайн и проведение эксперимента, анализ полученных результатов, написание статьи; П. А. Вишнякова — консультирование по вопросам проведения эксперимента, материальная база, редактирование; А. М. Косырева — консультирование по вопросам проведения эксперимента, редактирование; Е. Ю. Кананыхина, И. И. Емельянов — работа с животными; А. В. Ельчанинов — консультирование по вопросам проведения эксперимента, материальная база, редактирование; Т. Х. Фатхудинов — материальная база исследования.
Соблюдение этических стандартов: исследование одобрено этическим комитетом НИИ морфологии человека имени А. П. Авцына (протокол № 21 от 29 марта 2019 г.). Все манипуляции с животными проводили в соответствии с рекомендациями ARRIVE и Директивой ЕС 2010/63/EU о защите животных, используемых в научных целях.
Для корреспонденции: Виктория Викторовна Киселева
ул. Опарина, д. 4, г. Москва, 117997, Россия; moc.liamg@1991.avosonruk.airotciv
Острое повреждение легких и его наиболее тяжелая форма — острый респираторный дистресс-синдром (ОРДС) — комплексное многофакторное заболевание. На сегодняшний день не существует патофизиологической терапии ОРДС, а лечение остается исключительно симптоматическим, что обусловливает актуальность изучения данной патологии [1]. Использование моделей на животных («животных моделей») — неотъемлемая часть как изучения патофизиологических процессов при развитии заболевания, так и оценки эффективности потенциальных лекарственных препаратов.
Эффективность воспроизведения ОРДС человека на «животной модели» оценивают по наличию основных морфологических изменений, характерных для патологии: наличию интра-альвеолярного отека; увеличению количества нейтрофилов в межальвеолярных перегородках; формированию гиалиновых мембран, приводящему к утолщению межальвеолярных перегородок; образованию микротромбов [2]. Степень выраженности этих изменений обычно оценивают через 24 ч, более длительные интервалы времени после введения ЛПС остаются малоизученными.
Для моделирования ОРДС используют разные виды животных от грызунов до человекообразных обезьян [3]. Чаще всего ОРДС моделируют на мышах и крысах ввиду их максимальной доступности и относительной простоты работы с ними. Выделяют несколько подходов к моделированию ОРДС: прямое и непрямое повреждение легких (интраназальное/интратрахеальное или внутривенное введение липополисахарида (ЛПС) стенки грамотрицательных бактерий), а также комбинированные модели.
ЛПС состоит их трех частей, определяющих его иммуногенность. Липид А «заякоривает» молекулу ЛПС в клеточной стенке грамотрицательных бактерий и через Core-полисахарид связывается с О-цепью на поверхности бактерий. Последние уникальны для каждой бактерии и лежат в основе серотипирования, исторически используемого для идентификации грамотрицательных бактерий. Считается, что бактерии, формирующие гладкие колонии, имеют менее пирогенную О-цепь, состоящую из повторяющихся дисахаридов, при этом ЛПС из бактерии без О-цепи наиболее иммуногенен.
Преимущество использования ЛПС для моделирования ОРДС состоит в относительной доступности и возможности стандартизации экспериментов. Однако стоит помнить, что препараты ЛПС часто содержат загрязняющие вещества, такие как бактериальные липопротеины, которые могут влиять на биологические эффекты ЛПС.
При попадании в организм ЛПС их распознают толлподобные рецепторы 4-го типа (Toll-like receptor 4, TLR4) на поверхности моноцитов, макрофагов и дендритных клеток. ЛПС-связывающий белок (lipopolysaccharidebinding protein, LBP) и CD14, являющиеся корецепторами при этом взаимодействии, способствуют активации MyD88 и TRIF-зависимых сигнальных путей [4]. Эти каскады реакций приводят к активации транскрипционных факторов NF-κB / MAPK (mitogen-activated protein kinases) и IRF3 соответственно. В итоге стимулируется продукция провоспалительных цитокинов TNFα, IL6, IL1β и интерферонов I типа, что опосредует развитие воспаления [4].
Моделирование ОРДС с использованием интратрахеального введения ЛПС на сегодняшний день применяют чаще, чем интраназальное введение, что обусловлено более целенаправленным воздействием на нижние дыхательные пути. Однако такой подход требует использования специального оборудования для доставки ЛПС в нижние дыхательные пути через нос либо введения препарата через интратрахеальный разрез, что увеличивает время восстановления животного, а также несет риски заражения постоперационной раны. Это может увеличивать как сроки исследований, так и финансовые ресурсы, необходимые для их реализации. При этом есть данные о сравнимых эффектах обоих способов введения. Сравнение интраназального и интратрахеального способов введения ЛПС Escherichia coli O55:B5 было проведено на 12 самках мышей C57Bl/6 J исследователями из Канады под руководством Fatemeh Khadangi. Использовали одну дозу ЛПС с выведением животных из эксперимента через 24 ч. Авторы показали, что способ введения не повлиял на выраженность воспалительного процесса, однако при интраназальном введении наблюдалась меньшая вариабельность исследуемых показателей (количество клеток и общего белка в бронхоальвеолярном лаваже, сухой остаток легкого, уровень воспаления по гистологическим препаратам легкого и механические показатели вентиляции) внутри группы [5].
Другими авторами показано, что интратрахеальное введение ЛПС E. coli O111:B4 приводит к бронхопневмонии, увеличению количества макрофагов костномозгового происхождения и макрофагов с провоспалительным фенотипом в бронхоальвеолярном лаваже. Развитие локального воспалительного процесса в легких отражалось в высоких уровнях экспрессии провоспалительных цитокинов и низких уровнях экспрессии противовоспалительных цитокинов. На системном уровне отмечали высокий уровень С-реактивного белка в сыворотке крови [6].
Целью данной работы было оценить возможность использования интраназального введения ЛПС крысам Sprague-Dawley (SD) для воспроизведения ОРДС и сравнить изменения в легких крыс после однократного введения ЛПС в дозе 7,5 мг/кг или 15 мг/кг.
МАТЕРИАЛЫ И МЕТОДЫ
Интраназальное введение ЛПС
Самцы крыс породы Sprague-Dawley массой 250–280 г были получены из питомника «Столбовая» (Московская область, Россия). Животных содержали при естественном освещении, при температуре 20–22 °С и относительной влажности воздуха 60–70%. Животные имели свободный доступ к питьевой воде и брикетированным кормам (ООО «Лабораторснаб», Россия).
Исследование проводили на 21 животном. ЛПС E. coli O111:B4 (Sigma, США) 7,5 мг/кг или 15 мг/кг в объеме 150 мкл вводили интраназально под глубоким инъекционным наркозом (Золетил, Virbac, Франция) опытным животным. Контрольным крысам вводили 150 мкл физиологического раствора (NaCl 0,9%).
Легкие 10 крыс были извлечены через 48 ч после введения NaCl 0,9% (три особи), ЛПС в дозе 7,5 мг/кг массы тела (четыре особи) и ЛПС в дозе 15 мг/кг массы тела (три особи) для определения сухого остатка.
У девяти крыс (те же группы, по три особи в каждой) через 48 ч после введения ЛПС или NaCl 0,9% извлекали правое легкое. Небольшую его часть помещали в Фиксатор РНК («Евроген», Россия) с целью дальнейшего выделения РНК, постановки ОТ и ПЦР для оценки степени локального воспаления. Оставшееся легкое гомогенизировали, фиксировали и окрашивали для определения маркеров макрофагов CD68, CD86 и MHC II методом проточной цитофлуориметрии. Из хвостовой вены этих же животных отбирали 2–3 мл крови для выделения сыворотки и проведения иммуноферментного анализа с целью исследования концентрации TNFa (Cloude-Clone, #SEA133Ra), а также для оценки общей формулы крови.
Наконец, для определения маркеров макрофагов методом проточной цитофлуориметрии были использованы легкие еще трех интактных животных.
Оценка сухого остатка легкого (Wet/dry ratio)
Для оценки выраженности отека легкие 10 животных извлекали и взвешивали через 48 ч после введения ЛПС или физиологического раствора. Повторное взвешивание проводили через 7 дней высушивания легких при температуре 60 °C. Рассчитывали отношение массы в день забора легкого к массе после высушивания [8].
Выделение РНК, реакция обратной транскрипции и ПЦР
Для определения уровней экспрессии генов про- (TNFα, IL18, IL13, IL1β) и противовоспалительных (IL10, IL4) цитокинов, генов ферментов, вовлеченных в метаболизм аргинина (NOS2 и Arg1), и гена транскрипционного фактора NF-kb тотальную РНК выделяли из образцов правых легких, помещенных в Фиксатор РНК («Евроген», Россия) с помощью реагента Magzol (Magen, Китай) в соответствии с рекомендациями производителя. Первую цепь кДНК для определения уровня экспрессии генов получали из 1 мкг тотальной РНК с помощью набора MMLV RT kit («Евроген», Россия) в соответствии с рекомендациями производителя.
ПЦР в реальном времени проводили в объеме 25 мкл, содержащем 400 нг первой цепи кДНК, по 400 нМ прямых и обратных праймеров (последовательности указаны в табл. 1) и 5х qPCRmixHS SYBR («Евроген», Россия). Все реакции проводили в трех повторах в детектирующем амплификаторе DTprime DT96 («ДНК-Технология», Россия) при следующих условиях: предварительная денатурация — 95 °C 5 мин; 40 циклов амплификации, включающих денатурацию — 95 °C 15 с, отжиг — 60 °C 12 с и элонгацию — 72 °C 15 с. Специфичность полученного продукта проверяли с помощью анализа кривой плавления ПЦРпродукта в программе Real Time PCR («ДНК-Технология», Россия). По кривой накопления флуоресцентного сигнала определяли пороговые циклы (Ct) для всех исследуемых генов. Относительный уровень экспрессии генов рассчитывали методом 2^(-ΔΔCt). Для нормализации экспрессии каждого гена использовали ген «домашнего хозяйства» бета-2-микроглобулин.
Проточная цитометрия
Оценку содержания панмакрофагального маркера CD68, CD86, характерного для провоспалительных макрофагов, и MHC II, характерного для противовоспалительных макрофагов, проводили методом проточной цитометрии. Для этого легкие 12 животных (интактные животные, животные после введения NaCl 0,9%, и ЛПС в дозе 7,5 мг/кг или 15 мг/кг; по три особи в каждой группе) гомогенизировали механически, затем пропускали через сито с диаметром пор 100 мкм для избавления от оставшихся крупных фрагментов и фиксировали 2%-м параформальдегидом. 106 клеток отбирали для пермеамбилизации реагентом Inside Perm (#130-090-477, Miltenyi, Германия). Окрашивали CD68 FITC (#130-133-301, Miltenyi, Германия) или CD68 PE-Vio 770 (#130-134-152 Miltenyi, Германия), CD86 Vio Bright FITC (#130-109-180 Miltenyi, Германия) и MHC II PE (#205308, Biolegent). Собирали как минимум 50 000 событий на проточном цитометре BD FACS Calibur (США). Оценку относительного количества CD68, CD86 и MHC II положительных клеток проводили в онлайн-программе Floriadae [7].
Иммуноферментный анализ
Для определения концентрации TNFα в сыворотке крови из хвостовой вены крысы SD под глубоким наркозом отбирали 2 мл крови в пробирки с активатором свертывания. Центрифугирование проводили при 3200 об./мин в течение 20 мин. Далее сыворотку отбирали в новые пробирки и хранили при –20 °С. Исследование проводили с использованием набора ELISA Kit for Tumor Necrosis Factor Alpha (TNFa) (Cloude-Clone, Китай, #SEA133Ra) в соответствии с рекомендациями производителя. Оптическую плотность определяли при длине волны 450 нм на ИФА-анализаторе Multiskan FC (Thermo Scientific, США).
Статистический анализ
Статистический анализ проводили в программе Prism 8.0.
При сравнении двух групп использовали критерий Манна–Уитни, при сравнении большего количества групп использовали Ordinary one-way ANOVA. Различия считали статистически значимыми при при p < 0,05. Для графического представления данных использовали боксплоты, включающие медиану и верхние/нижние экстремальные значения.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
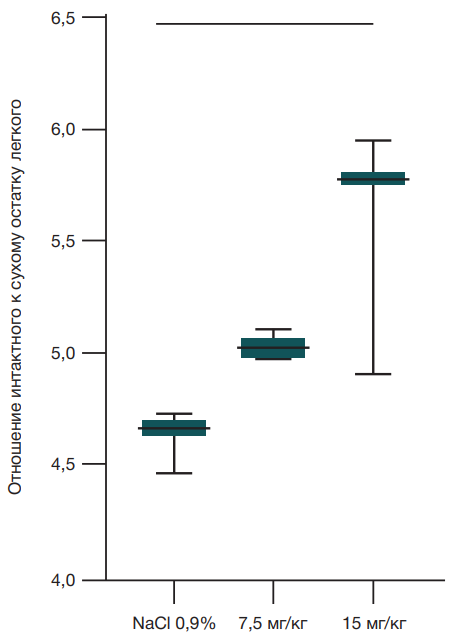
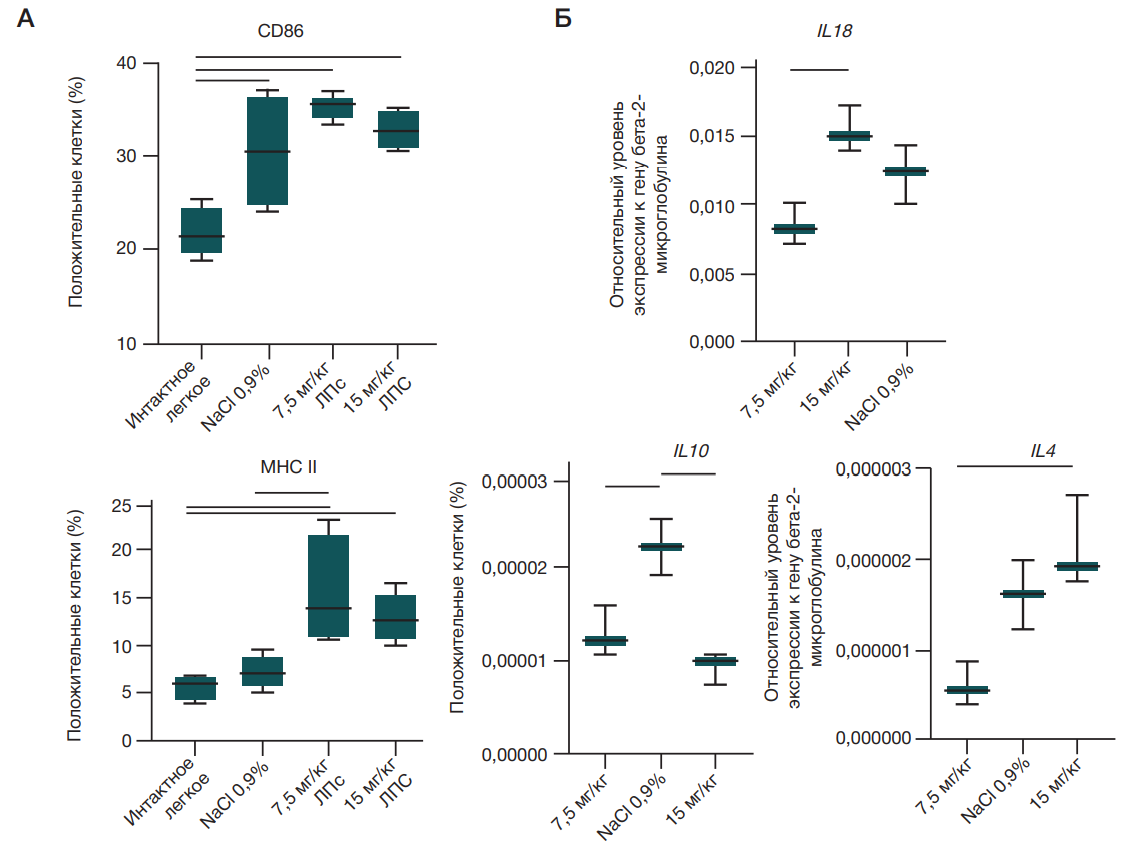
Оценку развития острого повреждения легких в первую очередь проводили по отношению массы интактного легкого к сухому остатку (Wet/dry ratio или W/D), которое является объективным показателем содержания воды в тканях легких и отражает развитие экссудативной фазы ОРДС. Для определения отношения W/D использовали целое легкое. Значимо высокий показатель W/D относительно контрольной группы был определен при введении дозы 15 мг/кг массы тела (p = 0.0228, Ordinary one-way Anova) (рис. 1).
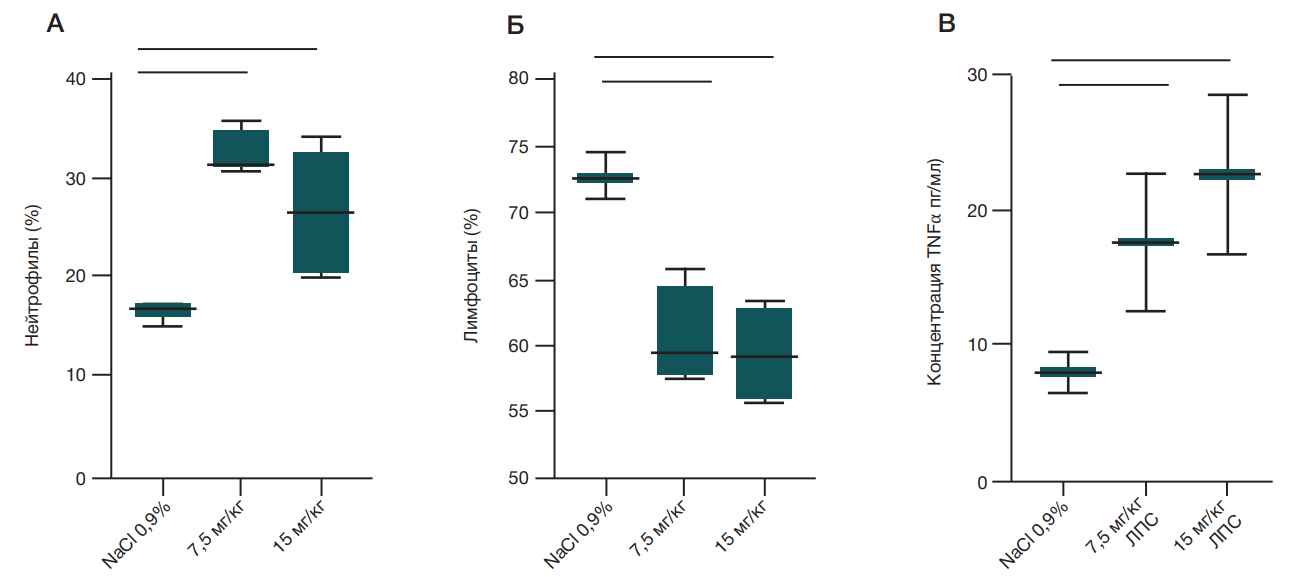
На системном уровне интраназальное введение ЛПС в обеих дозировках привело к значимо низкому относительному содержанию лимфоцитов (p = 0,0019, Ordinary one-way Anova) и значимо высокому содержанию нейтрофилов (p = 0,0021, Ordinary one-way Anova).
После введения ЛПС у опытных крыс в сыворотке крови наблюдали увеличение концентрации провоспалительного цитокина TNFα более чем в 4 раза по сравнению с контрольной группой, однако различия не достигли статистической значимости (рис. 2).
Известно, что макрофаги определяют исход ОРДС, поэтому на следующем этапе в гомогентах легких крыс оценивали относительное количество клеток, несущих панмакрофагальный маркер CD68, а также маркеры, описанные для провоспалительных и противовоспалительных макрофагов (CD86 и MHC II соответственно) [9–11]. В легких опытных животных по сравнению с интактными при введении обеих дозировок ЛПС был выявлен значимо высокий уровень CD86-положительных клеток (p = 0,0014, Ordinary one-way Anova), а при использовании дозы ЛПС 7,5 мг/кг массы тела — еще и значимо высокий уровень MHC II положительных клеток (p = 0,0050, Ordinary one-way Anova) (рис. 3).
Развитие локального воспаления оценивали путем определения уровней экспрессии генов провоспалительных цитокинов TNFα, IL1β, IL13 и IL18, гена транскрипционного фактора NF-kb, противовоспалительных цитокинов IL10 и IL4, а также генов ферментов, вовлеченных в метаболизм аргинина, NOS2 и Arg1 (рис. 3).
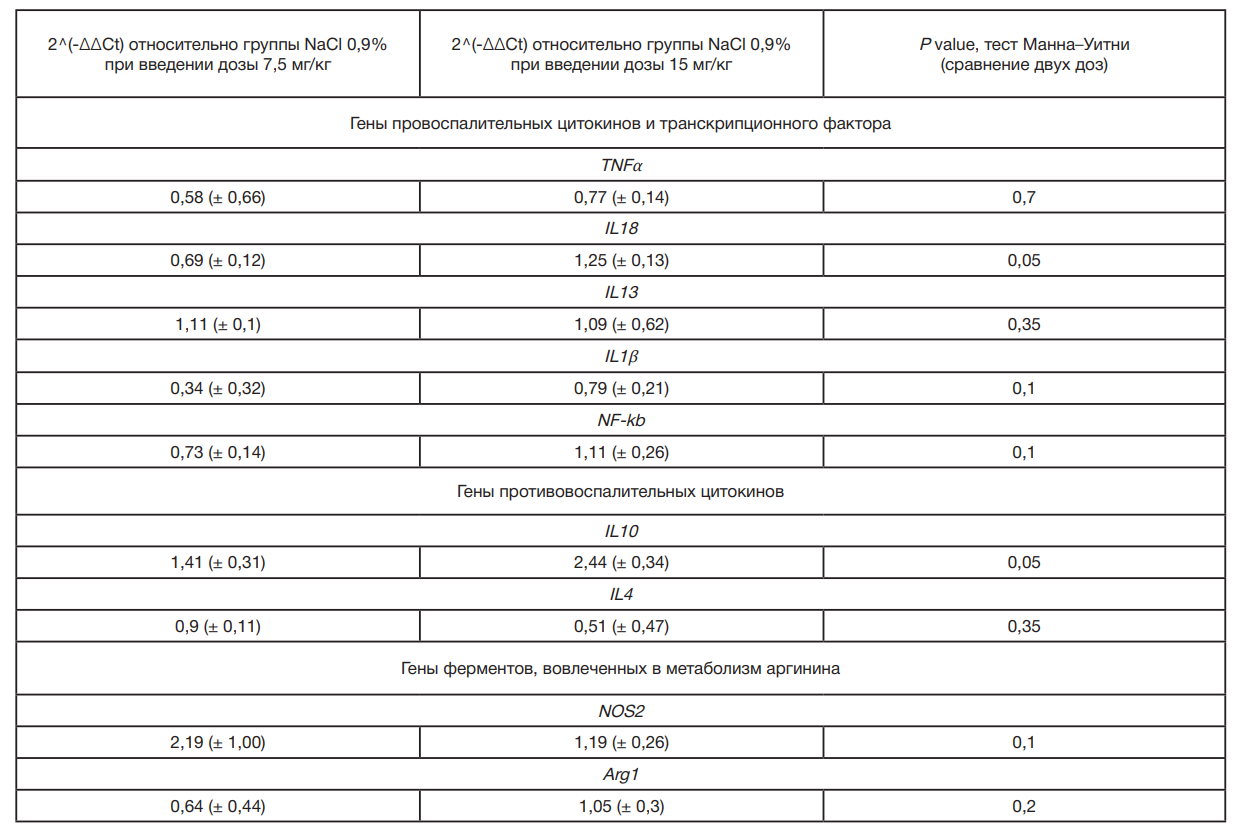
Уровень экспрессии гена IL10 был значимо повышен у опытных крыс при введении ЛПС в дозе 15 мг/кг массы тела (Ordinary one-way Anova, p = 0,0024), а уровень IL4 — снижен при введении дозы 7,5 мг/кг массы тела (Ordinary one-way Anova, p = 0,0194) по сравнению с животными, которым вводили физиологический раствор. Для генов IL18 и IL10 значимые различия были выявлены между животными после введения ЛПС в разных дозировках (Ordinary oneway Anova, p = 0,009 и 0,0024 соответственно).
Сравнение степеней изменения уровней экспрессии (2^(-ΔΔCt)) при введении двух дозировок ЛПС относительно группы введения физиологического раствора с использованием критерия Манна–Уитни показало значимое повышение уровня экспрессии генов провоспалительного цитокина IL18 и противоспалительного цитокина IL10 при введении дозы 15 мг/кг массы тела (табл. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Моделирование ОРДС для изучения его патогенеза и поиска потенциальной терапии является нетривиальной задачей, что обусловлено в большей степени комплексностью патогенетической картины.
Вне зависимости от причин принято выделять три стадии заболевания: экссудативную, пролиферативную и фибротическую. Экссудативная стадия ОРДС длится 1–7 дней. В это время повреждающие факторы приводят к нарушению аэро-гематического барьера и развитию интра-альвеолярного отека [1]. В большинстве работ оценивают инфильтрацию нейтрофилами межальволярных перегородок и развитие интра-альвеолярного отека в легких через 24 ч. Особенностью данной работы является валидирование модели ОРДС через 48 ч. Значимо высокое отношение массы легкого после извлечения из тела животного к его сухому остатку при введении дозы ЛПС E. coli O111:B4 15 мкг/кг массы тела говорит о высоком содержании жидкости в ткани легкого, что свидетельствует об экссудативной стадии заболевания.
На системном уровне были отмечены признаки развития воспалительной реакции, о чем говорит значимо низкое относительное содержание лимфоцитов и значимо высокое содержание нейтрофилов. Лимфоциты — клетки адаптивной иммунной системы, помогающие организму противостоять вторжениям патогенных микроорганизмов в том числе через привлечение нейтрофилов в очаги инфекции во время острого воспаления. Под воздействием ЛПС запускается каскад реакций, приводящий к стимулированию костного мозга и высвобождению большого количества нейтрофилов в кровеносную систему [12]. Низкий уровень лимфоцитов может быть следствием перераспределения клеток в очаг воспаления [13]. Похожие изменения были выявлены при секвенировании мононуклеарных клеток крови у людей, больных ОРДС, по сравнению со здоровыми донорами. Были отмечены низкие уровни основных представителей лимфоцитов: В-клеток и CD4-Т-клеток [14].
Характерной особенностью ОРДС является феномен, получивший название «цитокиновый шторм», который характеризуется высокой концентрацией провоспалительных цитокинов (TNFα, IFNγ, IL6 IL1β) в крови. Показано участие TNFα в развитии лихорадки, усилении системного воспаления, активации антимикробных реакций и повышении секреции других провоспалительных цитокинов (например, IL6).
TNFα активирует транскрипционный фактор NF-kB, который стимулирует множество генов, участвующих в воспалительной реакции [15].
Легкие — барьерный орган с мощно развитой системой защиты от микроорганизмов. Первыми клетками, отвечающими на вторжение из вне, являются макрофаги. В легких выделяют два типа макрофагов: населяющие альвеолы альвеолярные макрофаги и располагающиеся в интерстициальном пространстве интерстициальные макрофаги [16]. Фенотип первых описывают как противовоспалительный с высокой экспрессией IL10 и TGFβ [17]. Интерстициальные макрофаги на сегодняшний день активно изучаемая популяция клеток [16]. Макрофаги, рекрутируемые из моноцитов крови, имеют фенотип, близкий к провоспалительному, и экспрессируют в значительных количествах костимулирующие молекулы CD86, необходимые для адекватной антигенной передачи сигнала, в комплексе с молекулами главного комплекса гистосовместимости первого типа (MHC I) [9]. Исход заболевания зависит от баланса двух состояний альвеолярных макрофагов. При этом показано, что в случае вирусного заболевания из них формируется популяция клеток памяти MHC IIhi [18, 19]. В экссудативной фазе провоспалительные макрофаги преобладают над противовоспалительными клетками. Активация распознающих паттерн рецепторов макрофагов приводит к формированию инфламмасомы, в которой каспаза-1 способствует созреванию IL1 и IL18. Прогрессирование заболевания может быть тяжелым, если процесс созревания инфламмасомы нарушается. В пролиферативной фазе ОРДС провоспалительные макрофаги сменяются противовоспалительными макрофагами, которые удаляют клеточные остатки и выделяют противовоспалительные цитокины. Было показано, что дефектный эффероцитоз может приводить к затяжному воспалению, наблюдаемому при ОРДС; кроме того, избыточное участие противовоспалительных макрофагов в процессах реорганизации матрикса на этой стадии может привести к хроническому фиброзу и окклюзии кровеносных сосудов [20]. Таким образом, выявленное нами повышение количества CD86 и MHC II положительных клеток позволяет предположить, что через 48 ч после интраназального введения ЛПС макрофаги легкого находятся в переходном состоянии от провоспалительного к противовоспалительному [18].
На генном уровне было отмечено, что интраназальное введение ЛПС в дозе 15 мг/кг массы тела приводит к изменению уровней экспрессии генов как про- так и противовоспалительных цитокинов (IL18 и IL10 соответственно). При этом использование более высокой дозы значимо активировало противовоспалительный иммунный ответ, о чем свидетельствует высокий уровень экспрессии гена IL10 [21]. В патогенезе ОРДС IL10 играет неоднозначную роль: он может как способствоать разрешению заболевания путем ингибирования секреции провоспалительных цитокинов, таких как TNFα, IL1β, IL6 и IFNγ, так и осложнять его путем снижения дифференцировки стволовых клеток в альвеолоциты II типа, таким образом препятствуя восстановлению легких [22]. Высокий уровень экспрессии IL10 потенциально может указывать на поляризацию макрофагов в противовоспалительный фенотип, что согласуется с высоким уровнем MHC II положительных клеток по результатам проточной цитометрии [17].
Провоспалительный цитокин IL18, который был впервые описан как фактор, индуцирующий интерферон IFNγ через воздействие на клетки как врожденного, так и адаптивного иммунного ответа, участвует в защите от инфекционных агентов и в противоопухолевом иммунитете. Активация паттерн-распознающих рецепторов врожденного иммунитета (PRR) в легких приводит к активации транскрипционного фактора NF-kb в эпителиальных и эндотелиальных клетках, а также в резидентных иммунных клетках. NF-kb в свою очередь способствует увеличению про-IL1β, про-IL18 и прокаспазы-1, зрелые формы которых формируются в инфламмасомах и запускают порочный круг развития воспаления. IL18 является мощным хемоатрактантом для нейтрофилов, увеличенное количество которых в легких является важнейшим признаком острой фазы ОРДС; это согласуется с полученными нами данными о высоком уровне экспрессии гена IL18 после введения дозы ЛПС 15 мг/кг массы тела, а также о высоком содержании нейтрофилов в крови.
ВЫВОДЫ
Интраназальное введение крысам ЛПС внешней стенки грамотрицательных бактерий через 48 ч приводит к развитию процессов, характерных для экссудативной и пролиферативной фаз ОРДС: отек легких, снижение количества лимфоцитов и повышение количества нейтрофилов в крови, а также повышение концентрации TNFα в сыворотке крови. Введение ЛПС в дозе 15 мг/кг приводит к быстрому развитию воспалительных процессов в легких, и уже через 48 ч в значительной мере прослеживается активация противовоспалительных реакций. Таким образом, использование интраназального введения ЛПС O111:B4 в дозе 15 мг/кг массы тела крысам породы Sprague-Dawley может быть использовано с целью моделирования ОРДС для оценки эффективности лекарственной терапии, в том числе клеточной, по таким показателям как сухой остаток легкого, содержание CD86 и MHC II положительных клеток в гомогентах легких и уровни экспрессии генов IL10 и IL18.
- Bos LDJ, Ware LB. Acute respiratory distress syndrome: causes, pathophysiology, and phenotypes. The Lancet. 2022; 400: 1145–56.
- Aeffner F, Bolon B, Davis IC. Mouse Models of Acute Respiratory Distress Syndrome. Toxicol Pathol. 2015; 43: 1074–92.
- Matute-Bello G, Frevert CW, Martin TR. Animal models of acute lung injury. American Journal of Physiology-Lung Cellular and Molecular Physiology. 2008; 295: L379–99.
- Soloveva T, Davydova V, Krasikova I, Yermak I. Marine Compounds with Therapeutic Potential in Gram-Negative Sepsis. Mar Drugs. 2013; 11: 2216–29.
- Khadangi F, Forgues A-S, Tremblay-Pitre S, Dufour-Mailhot A, Henry C, Boucher M, et al. Intranasal versus intratracheal exposure to lipopolysaccharides in a murine model of acute respiratory distress syndrome. Sci Rep. 2021; 11: 7777.
- Kosyreva AM, Miroshnichenko EA, Tsvetkov IS, Lokhonina AV, Sentyabreva AV, Dzhalilova DSh, et al. Morphofunctional Characteristics of Lung Macrophages in Rats with Acute Respiratory Distress Syndrome. Bull Exp Biol Med. 2023; 175: 822–7.
- Онлайн-программа для обсчета цитометрических данных. Доступно по ссылке: https://floreada.io/.
- Parker JC, Townsley MI. Evaluation of lung injury in rats and mice. American Journal of Physiology-Lung Cellular and Molecular Physiology. 2004; 286: L231–46.
- Vishnyakova P, Poltavets A, Karpulevich E, Maznina A, Vtorushina V, Mikhaleva L, et al. The response of two polar monocyte subsets to inflammation. Biomedicine & Pharmacotherapy. 2021; 139: 111614.
- Chistiakov DA, Killingsworth MC, Myasoedova VA, Orekhov AN, Bobryshev YV. CD68/macrosialin: not just a histochemical marker. Laboratory Investigation. 2017; 97: 4–13.
- Murray PJ, Allen JE, Biswas SK, Fisher EA, Gilroy DW, Goerdt S, et al. Macrophage Activation and Polarization: Nomenclature and Experimental Guidelines. Immunity. 2014;41:14–20.
- Qazi MR, Bogdanska J, Butenhoff JL, Nelson BD, DePierre JW, Abedi-Valugerdi M. High-dose, short-term exposure of mice to perfluorooctanesulfonate (PFOS) or perfluorooctanoate (PFOA) affects the number of circulating neutrophils differently, but enhances the inflammatory responses of macrophages to lipopolysaccharide (LPS) in a similar fashion. Toxicology. 2009; 262: 207–14.
- Chakraborty S, Zawieja SD, Wang W, Lee Y, Wang YJ, von der Weid P-Y, et al. Lipopolysaccharide modulates neutrophil recruitment and macrophage polarization on lymphatic vessels and impairs lymphatic function in rat mesentery. American Journal of Physiology-Heart and Circulatory Physiology. 2015; 309: H2042–57.
- Torres M, Casado G, Vigón L, Rodríguez-Mora S, Mateos E, Ramos-Martín F, et al. Changes in the immune response against SARS-CoV-2 in individuals with severe COVID-19 treated with high dose of vitamin D. Biomedicine & Pharmacotherapy. 2022; 150: 112965.
- Riyaz Tramboo S, Elkhalifa AME, Quibtiya S, Ali SI, Nazir Shah N, Taifa S, et al. The critical impacts of cytokine storms in respiratory disorders. Heliyon. 2024; 10: e29769.
- Hou F, Xiao K, Tang L, Xie L. Diversity of Macrophages in Lung Homeostasis and Diseases. Front Immunol. 2021; 12.
- Fakoya AO, Naeem A, Louisdon P, Histology. Alveolar Macrophages. Available from: https://www.ncbi.nlm.nih.gov/books/NBK513313/#:~:text=Alveolar%20macrophages%20produce%20anti%2Dinflammatory,processes%20and%20promote%20tissue%20repair.
- Morrell ED, Bhatraju PK, Mikacenic CR, Radella F, Manicone AM, Stapleton RD, et al. Alveolar Macrophage Transcriptional Programs Are Associated with Outcomes in Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med. 2019; 200: 732–41.
- Yao Y, Jeyanathan M, Haddadi S, Barra NG, Vaseghi-Shanjani M, Damjanovic D, et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 2018; 175: 1634–50.e17.
- Mahida RY, Scott A, Parekh D, Lugg ST, Hardy RS, Lavery GG, et al. Acute respiratory distress syndrome is associated with impaired alveolar macrophage efferocytosis. European Respiratory Journal. 2021; 58: 2100829.
- Couper KN, Blount DG, Riley EM. IL-10: The Master Regulator of Immunity to Infection. The Journal of Immunology. 2008; 180: 5771–7.
- Sun Z, Chen A, Fang H, Sun D, Huang M, Cheng E, et al. B cell-derived IL-10 promotes the resolution of lipopolysaccharide-induced acute lung injury. Cell Death Dis. 2023; 14: 418.