ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Микробиологический анализ и идентификация патогенов во время ортопедических операций: исследование в г. Эн-Насирия
Медицинский колледж, Иракский университет Аль-Айан (AUIQ), Эн-Насирия, Ирак
Бактерии, встречающиеся в операционных, могут приводить к хирургическим и внутрибольничным инфекциям. Целью работы было идентифицировать бактерии, ответственные за обсеменение, определить факторы, способствующие обсеменению, а также картировать распределение этих микроорганизмов по различным зонам операционного блока и определить характер их устойчивости к противомикробным средствам с использованием микробиологических стандартов. Было отобрано 1358 образцов с поверхностей и предметов в операционной. В 3,1% случаев результаты анализа на наличие бактерий были положительными, а в 96,9% случаев имело место отсутствие роста бактерий. Идентифицированы патогенные бактерии шести типов: коагулазонегативные стафилококки (14,3%), Staphylococcus aureus (11,9%), Pseudomonas aeruginosa (19,1%), E. coli (21,4%), Bacillus spp. (11,9%) и Enterobacter spp. (21,4%). Выявлена умеренная и сильная устойчивость к амоксициллину и ампициллину, цефаклору, цефуроксиму, цефадроксилу, эритромицину. Самая высокая устойчивость выявлена у изолятов P. aeruginosa. На втором месте — E. coli, продемонстрировавшая разную устойчивость к 14 противомикробным средствам и чувствительность только к амикацину. Таким образом, исследование, проведенное в Больнице Имама Хусейна, выявило в целом низкий, но заметный уровень обсеменения ортопедических операционных опасными для пациентов специфическими патогенами. Полученные результаты согласуются с глобальными данными, что говорит об универсальности проблемы обеспечения стерильности операционных. Постепенное выявление очагов и закономерностей обсеменения подчеркивает необходимость применения целенаправленных мер и постоянного наблюдения.
Ключевые слова: Pseudomonas aeruginosa, зоны операционного блока, устойчивость к противомикробным средствам
Соблюдение этических стандартов: исследование проведено в соответствии со стандартами добросовестной клинической практики и доказательной медицины.
Для корреспонденции: Kareem Al-Zirkan
Al-Zirkan KD, lecturer College of Medicine Al-Ayen Iraqi University, An Nasiriyah, Iraq; qi.ude.neyala@yfak.meerak
Важнейшим фактором развития внутрибольничных инфекций (ВБИ) является присутствие патогенных микроорганизмов в помещении. Клинические последствия этого открытия имеют важное значение не только для пациента, но и для хирургической бригады, которая оказывает помощь [1, 2]. Согласно статистическим данным Центров профилактики и контроля заболеваемости (CDC), нозокомиальные инфекции (НИ) ежегодно развиваются у 1,7 млн человек.
Они вызывают до 99 000 летальных исходов [3]. Ортопедические хирургические вмешательства, особенно такие плановые операции, как артропластика и операции на кисти, снижают риск развития послеоперационной инфекции [4]. В ортопедической хирургии применяют более строгие протоколы стерилизации, чем при проведении иных хирургических операций. Хотя методики измерения, используемые для оценки индекса риска НИ, могут различаться, возможны значительные колебания их частоты [5].
В то же время, НИ продолжают оставаться источником беспокойства из-за связанных с ними значительных показателей заболеваемости и длительного пребывания в стационаре, повторных госпитализаций и ревизионных операций, приводящих к росту затрат на лечение [6, 7]. Согласно имеющимся данным, из-за бактериальных НИ в Насирии за последние два года (2021–2023) было проведено около 1718 операций на бедре, колене, операций внутренней фиксации, операций на тазобедренном суставе и кисти. Неудивительно, что эти тревожные цифры побудили медицинских специалистов предпринять ряд попыток определить и свести к минимуму причины возникновения НИ и связанные с ними риски. В исследованиях выявлено множество источников, связанных с распространением патогенных микроорганизмов, например воздух, больничные помещения, морозильные камеры с жидким азотом, одежда персонала и даже длительное хранение стерильной металлической посуды в открытом виде [8, 9].
Установлен ряд различных источников загрязнения операционной: необработанный воздух, вентилируемые помещения и антисептические жидкости; раневой дренаж; пациент и сумка с вещами; хирургическая бригада; число внутренних перемещений; хирургическая одежда; обувь; перчатки и руки; использование недостаточно стерильных материалов; загрязненная среда и сильно загрязненные поверхности [10, 11]. Благодаря внедрению подходящих мер инфекционного контроля можно избежать микробного обсеменения операционной. Например, уменьшение примерно в 13 раз содержания бактерий в воздухе приведет к 50%-му снижению показателя инфицирования ран. В основном оно обусловлено частой фумигацией операционных и совершенствованием процедур уборки и дезинфекции [12, 13].
Кроме того, исследования показали, что мобильные устройства, которые медицинские работники используют во всей больнице, представляют собой один из основных источников загрязнения операционной. Ряд исследований показал, что болезнетворные микроорганизмы, такие как коагулазонегативные стафилококки (CoNS), S. aureus и Acetinobacter, перемещаются на мобильных телефонах [14, 15].
Выявлено несколько предотвратимых причин НИ. Применение правильной обработки позволяет уменьшить распространенность НИ. Проблемы могут быть связаны с пациентами, хирургами, медицинскими сестрами, воздухом операционной и оборудованием. Несмотря на то что было разработано несколько методов для снижения риска инфекции после имплантации, инфицирование все еще возможно. Чтобы сократить количество инфекций, возникающих в операционной, важно практиковать такие меры, как соблюдение гигиены рук, профилактическое применение противомикробных средств в приемлемых формах и правильной дозировке, ношение хирургической одежды и ограничение мобильности персонала. Хирургические инфекции занимают третье место среди наиболее распространенных нозокомиальных инфекций (около 14–16%). Устойчивость к противомикробным средствам стала общемировой проблемой с соответствующими последствиями и операционные одновременно служат рассадником и центром, из которого мультирезистентные (МР) микроорганизмы распространяются по больнице. В развитых и развивающихся странах рост частоты нозокомиальных инфекций прямо или косвенно связан с показателями бактериального обсеменения, несмотря на относительно высокий уровень гигиены и чистоты, а также базовое понимание мер по контролю инфекций с применением профилактических методов [16, 17].
Необходимо осуществлять надзор внутри подразделения для получения крайне необходимых эпидемиологических данных, которые послужат моделью для разработки политики контроля и профилактики инфекций. Инфекции, поражающие кости и суставы, считают основной причиной заболеваемости, эмоционального стресса и повышенной смертности, а также значительных экономических потерь, поэтому можно представить себе масштаб проблемы. Целью настоящего исследования было оценить уровень обсеменения операционных в Больнице Имама Хусейна в Насирии. Основной целью было выявить ответственные за обсеменение бактерии и связанные с этим факторы. В ходе исследования мы также попытались составить карту распространения этих микроорганизмов в нескольких зонах операционной и характер их устойчивости к противомикробным средствам, используя микробиологические критерии. В связи с этим мы приняли решение оценить уровень бактериального обсеменения в ортопедических операционных больницы.
МАТЕРИАЛЫ И МЕТОДЫ
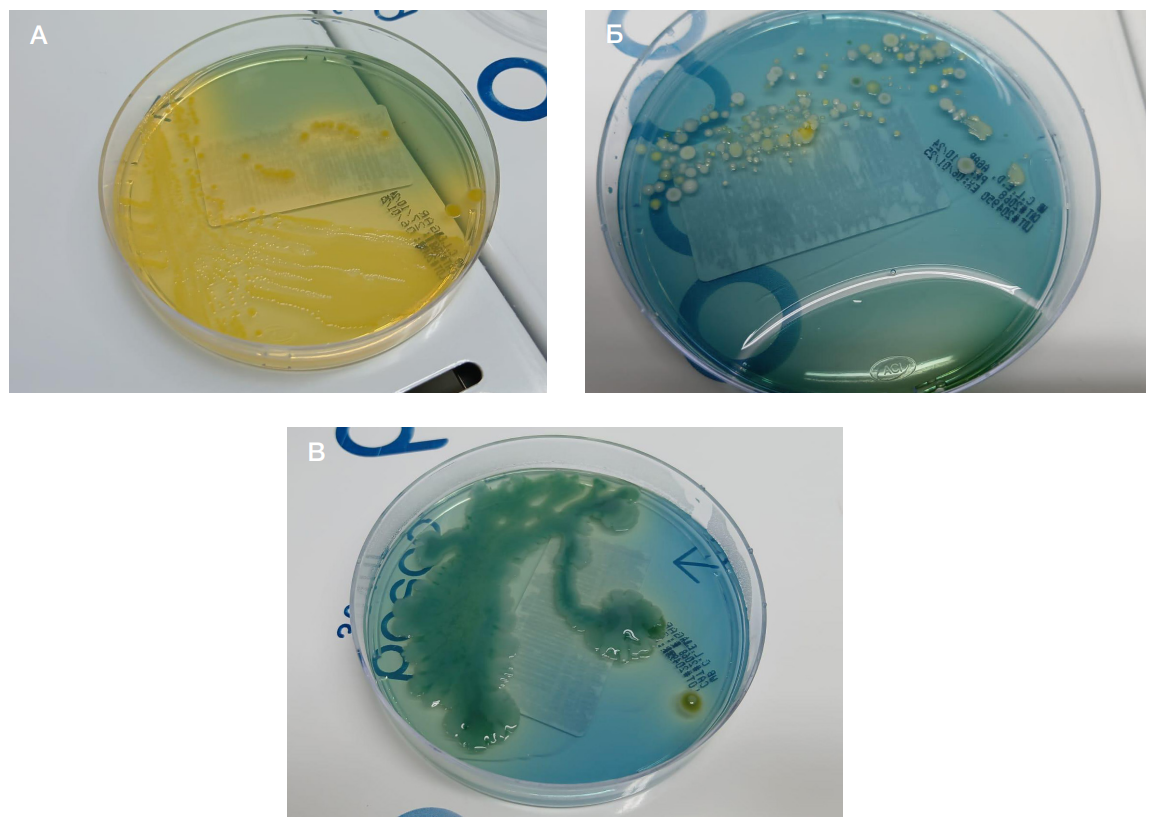
В Больнице Имама Хусейна, расположенной в г. Насирия, где проводили исследование, есть три разные операционные. С февраля 2022 г. по май 2024 г. три операционные были предназначены для общей хирургии, две для урологических операций и три — для ортопедических. Мы оценивали бактериальное обсеменение ортопедических операционных больницы примерно 4–5 раз в месяц. Чтобы взять мазки, стерильные тампоны смачивали стерильным физиологическим раствором, сразу после этого ими несколько раз протирали поверхности пола, дверей, телефонных трубок, стен, раковин и медицинских инструментов в операционной и отделении реанимации и интенсивной терапии (ОРИТ) до и после операции. Затем образцы надлежащим образом подписывали для транспортировки в лабораторию и дальнейшей обработки. Непосредственно после отбора проб все мазки использовали для культивирования методом выделения на обогащенном кровяном агаре и агаре CLED [18] (рис. 1).
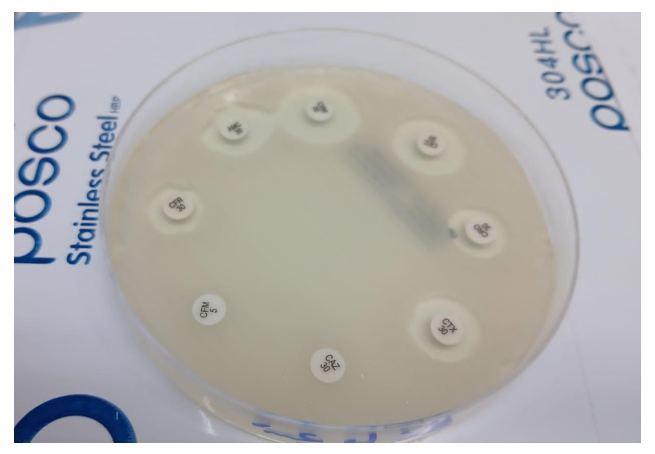
В соответствии с рекомендациями CSLI, исследование чувствительности к противомикробным средствам проводили диск-диффузионным методом на среде Мюллера–Хинтона (рис. 2). На 15 дисков нанесли следующие противомикробные средства: ампициллин (AM), амоксициллин (AMX), амоксициллин/клавулановую кислоту (AMC), цефаклор (CEC), цефадроксил (CFR), цефуроксим (CXM), цефтриаксон (CRO), цефтазидим (CAZ), цефотаксим (CTX), цефиксим (CFM), эритромицин (ERY), ципрофлоксацин (CIP), левофлоксацин (LE), гентамицин (GM), амикацин (AK) (рис. 3). Следуя рекомендациям, измеряли и интерпретировали диаметр зоны ингибирования роста бактериальных изолятов [19].
Статистический анализ
Показатели, которые представляли частоты и процентные доли, анализировали с использованием статистического программного обеспечения SPSS, версия 17.0. Статистический анализ данных был выполнен с учетом того, что ошибка первого рода составляла 0,05 с 95%-м доверительным интервалом. Данные представляли в виде среднего и стандартного отклонения (mean ± SD). Частоты и процентные доли использовали для описания демографических факторов и исходных условий. Для указанных выше сравнений использовали критерий хи-квадрат, если выполнялись условия теста, в противном случае использовали t-критерий Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для микробиологического анализа в ортопедических операционных с февраля 2022 г. по май 2024 г. были отобраны 1358 мазков. После посева и культивирования мазков в аэробных и анаэробных условиях было установлено, что 42 мазка (3,09%) продемонстрировали наличие роста, в то время как отсутствие роста бактерий было зафиксировано в 1316 случаях (96,90%).
Временное распределение культур с наличием роста продемонстрировало высокие показатели в феврале, марте, апреле, в то время как в мае был зафиксирован общий спад.
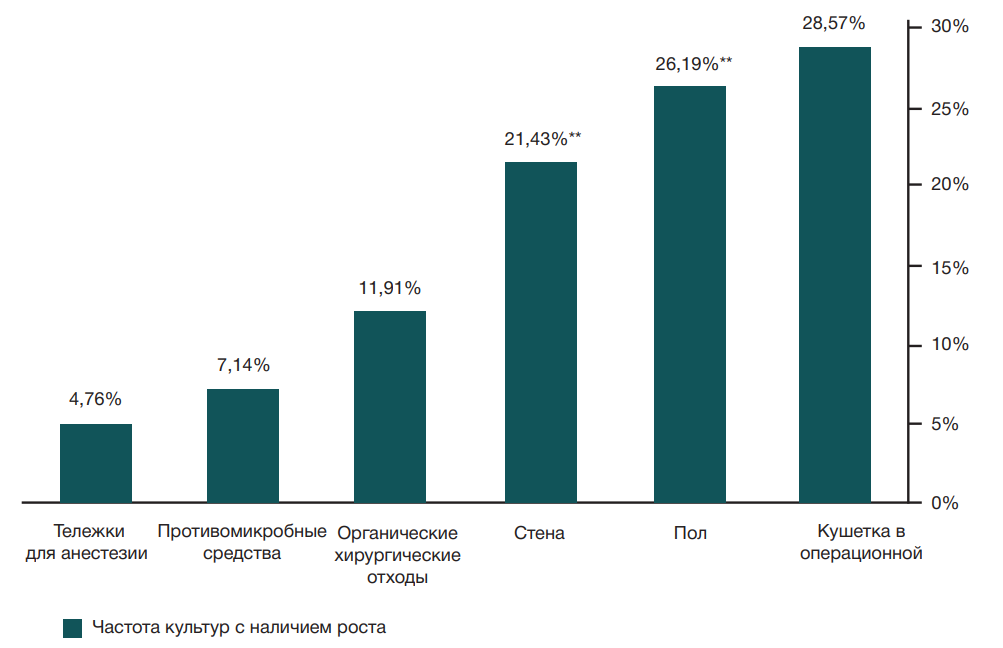
Высокая частота культур с наличием роста показана для мазков, взятых с кушетки операционной, — 12 (28,57%), пола — 11 (26,19%) и стены — 9 (21,43%). Низкая частота культур с наличием роста зафиксирована для мазков, взятых с органических операционных отходов, — 5 (11,91%), антисептических растворов — 3 (7,14%) и тележек для анестезии — 2 (4,76%); мазки, взятые с марли (0%) и хирургических инструментов (0%), продемонстрировали отсутствие роста бактерий (рис. 3). Высокая значимость различий (P-value < 0,001) установлена для показателей бактериального обсеменения различных источников, откуда были взяты мазки. При этом показатели обсеменения кушетки, пола и стены были значимо выше показателей обсеменения других зон.
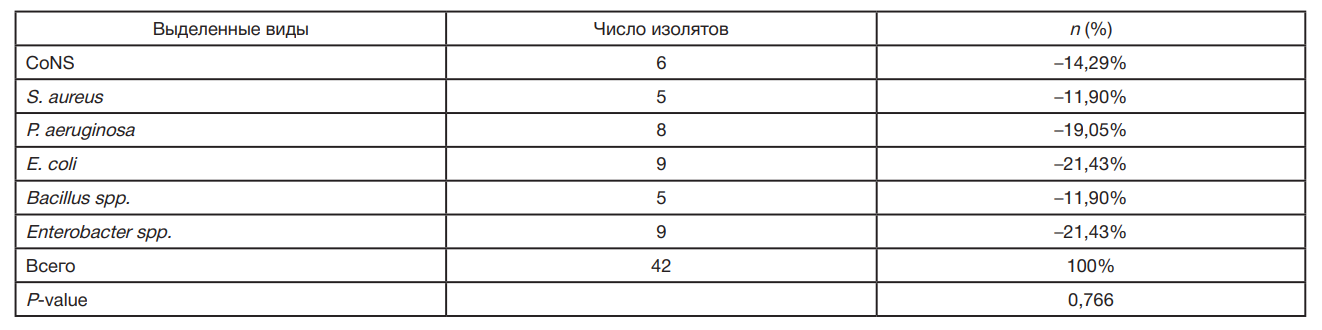
В ортопедических операционных были выявлены патогенные бактерии следующих шести типов: CoNS — 6 (14,29%), S. aureus — 5 (11,90%), P. aeruginosa — 8 (19,05%), E. coli — 9 (21,43%), Bacillus spp. — 5 (11,90%) и Enterobacter spp. 9 (21,43%). Значимые различия частотного распределения видов бактерий выявлены не были (табл. 1).
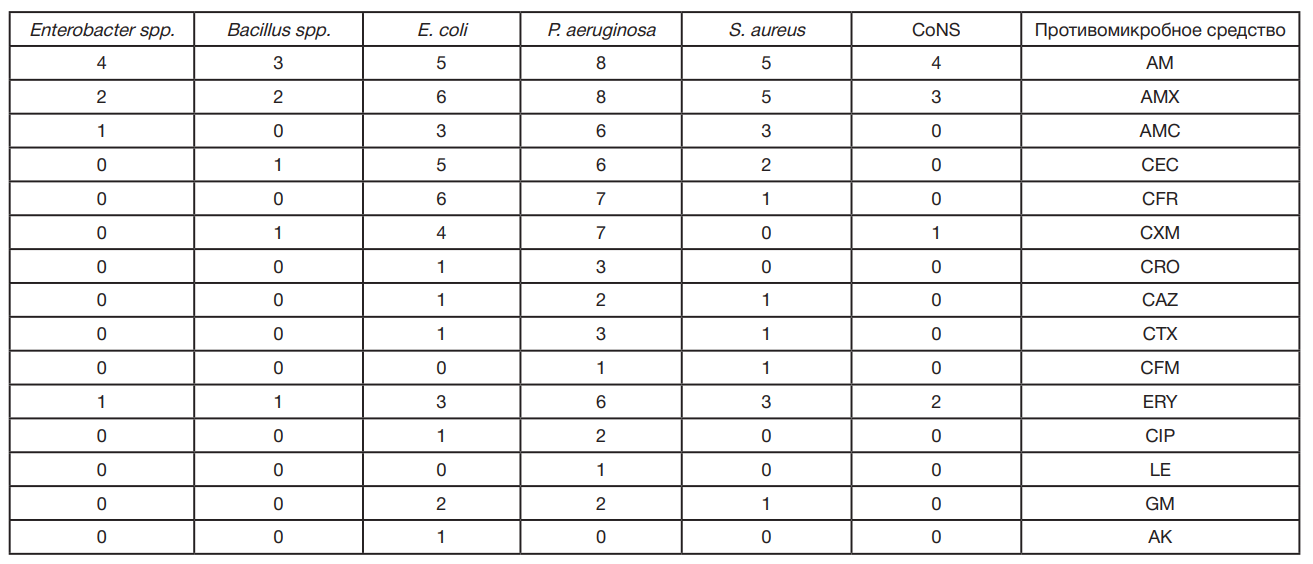
Мы наблюдали умеренную и высокую устойчивость (табл. 2) к амоксициллину и ампициллину, цефаклору, цефуроксиму, цефадроксилу, эритромицину. Все выявленные организмы продемонстрировали самую высокую устойчивость к амоксициллину и ампициллину. Устойчивость снижалась при добавлении к амоксициллину клавулановой кислоты.
S. aureus показал самую высокую устойчивость к ампициллину и амоксициллину (n = 5), за ними следовали амоксициллин/клавулановая кислота и эритромицин (n = 3), цефаклор (n = 2); только один изолят был устойчив к цефадроксилу, цефтазидиму, цефотаксиму, цефиксиму и гентамицину, при этом все изоляты были чувствительны к остальным исследуемым противомикробным средствам.
Самая высокая устойчивость выявлена у изолятов P. aeruginosa. За ними следует E. coli, показавшая разную устойчивость к 14 антибиотикам и чувствительность только к амикацину. Самая низкая устойчивость выявлена у CoNS, Enterobacter spp. и Bacillus spp., продемонстрировавших устойчивость к четырем, пяти, четырем противомикробным средствам соответственно. Показатели устойчивости к разным противомикробным средствам значимо различались (P-value < 0,05), при этом была выявлена наибольшая устойчивость к AM, AMX, ERY и наименьшая устойчивость к LE, AK, CFM. Помимо того, результаты показали, что E. coli и P. aeruginosa были значимо более устойчивыми к противомикробным средствам, чем другие бактерии (P-value < 0,05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Пациенты и их семьи могут столкнуться с тяжелыми последствиями послеоперационных инфекций, возникающих в результате бактериального обсеменения операционных. Для исследования каждого случая подозрения на внутрибольничную инфекцию (ВБИ) необходимо получение коллекции культур с разных участков тела пациента, а также с других пациентов, персонала и окружающей обстановки [20]. При сборе требуемых данных крайне важно тщательно отбирать образцы для культивирования. Инфекции приводят к увеличению продолжительности госпитализации, вызывают долгосрочные нарушения, повышают устойчивость к противомикробным средствам, приводят к летальным исходам и создают значительное дополнительное финансовое бремя для системы здравоохранения. Таким образом, решением может стать правильно реализованная программа контроля инфекций, которая повысит уровень образования и ответственности персонала.
Кроме того, необходимо провести исследования, чтобы адаптировать и валидировать контрольные (надзорные) процедуры к реалиям развивающейся страны для достижения приемлемой эффективности. Это может способствовать уменьшению частоты ВБИ примерно на треть [21]. Из всех процедур и положений, процедуры дезинфекции окружающей среды и стерилизации инструментов, несомненно, требуют самого строгого контроля.
В ходе исследования в мазках, продемонстрировавших рост бактерий, выявлены патогенные бактерии шести типов: CoNS (14,29%), S. aureus (11,90%), P. aeruginosa (19,05%), E. coli (21,43%), Bacillus spp. (11,90%) и Enterobacter spp. (21,43%). Эти патогены являются общеизвестными возбудителями внутрибольничных инфекций, и их присутствие в операционных вызывает беспокойство. S. aureus печально известен из-за роли, которую он играет в развитии послеоперационных раневых инфекций. Его может быть сложно лечить из-за устойчивости ко многим противомикробным препаратам. Относительно частая встречаемость E. coli и Enterobacter spp., составивших 21,43% всех выявленных патогенов, подчеркивает возможность заражения от таких источников, как хирургические инструменты или руки медицинских работников, что акцентирует внимание на потребности в строгих протоколах стерилизации.
Распределение культур с наличием роста в пределах ортопедических операционных демонстрирует тревожную картину: наиболее высокие показатели обсеменения получены для кушетки (28,57%), пола (26,19%) и стен (21,43%). Это позволяет предположить, что данные поверхности, с которыми часто соприкасаются пациенты, персонал и оборудование, представляют собой важнейшие источники заражения. Присутствие патогенов на кушетке, на которой пациент лежит во время хирургической операции, представляет собой непосредственную угрозу безопасности пациента, поскольку может стать причиной хирургических инфекций. Значительное обсеменение пола и стен также подчеркивает необходимость строгих протоколов уборки и регулярной дезинфекции всех поверхностей внутри операционной. Низкую частоту культур с наличием роста, напротив, продемонстрировали органические хирургические отходы (11,91%), антисептические растворы (7,14%) и тележки для анестезии (4,76%). В то же время отсутствие роста бактерий показано для марли и хирургических инструментов. Отсутствие обсеменения хирургических инструментов и марли — положительный результат, который подтверждает, что протоколы стерилизации этих критически важных предметов эффективно предотвращают трансмиссию патогенов. Это соответствует лучшим практикам инфекционного контроля, в которых приоритет отдается стерильности инструментов, используемых при проведении инвазивных операций. Показано, что в операционных присутствуют бактерии S. aureus [22], которые также были обнаружены в ходе настоящего исследования, и частота их встречаемости в хирургических отделениях составляет около 15% — это немного выше 10,34%, выявленных в Эн-Насирии.
Наблюдаемые различия можно объяснить тем, что в больницах разных регионов применяют разные санитарные меры и меры инфекционного контроля.
Соответствующее исследование обсеменения при проведении «чистых» ортопедических операций выявило коагулазонегативные стафилококки и Enterobacter spp. как типы бактерий [23]. Эти результаты согласуются с результатами нашего исследования, акцентирующими внимание на распространенности коагулазонегативных стафилококков и видов рода Enterobacter. Исследование подчеркнуло роль систем вентиляции с ламинарными потоками в предупреждении обсеменения и влияния бактерий, продемонстрировав улучшение условий в операционных в Эн-Насирии.
Escherichia coli и P. aeruginosa вызывают обеспокоенность по поводу стерильности среды во время проведения операций. P. aeruginosa, известная своей устойчивостью и связью с внутрибольничными инфекциями, обнаружена в 17,24% образцов. Это резко отличается от данных исследования, продемонстрировавшего распространенность Pseudomonas в хирургических отделениях [24], и подчеркивает заметный рост их численности.
Можно предположить, что используемые в Эн-Насирии методы инфекционного контроля могут быть неэффективными. Аналогичными образом, Escherichia coli была обнаружена в 24,14% образцов, что представляет собой намного более высокий показатель по сравнению с исследованием, в ходе которого E. coli была обнаружена более чем в 10% образцов [25]. Такие различия подчеркивают необходимость применения санитарно-гигиенических мер и стерилизации для предупреждения обсеменения. Влияние таких загрязнителей на пациентов невозможно переоценить. Послеоперационные инфекции могут приводить к послеоперационным осложнениям, обусловливающим более длительное пребывание в стационаре, увеличение числа хирургических вмешательств и рост медицинских расходов. Так, при оценивании последствий хирургических инфекций было установлено, что время пребывания инфицированных пациентов в стационаре удвоилось, а показатель повторных госпитализаций увеличился в пять раз [26]. У ортопедических пациентов имеет место риск возникновения поверхностных и глубоких инфекций, вызванных бактериями, выявленными в ходе исследования в Эн-Насирии, что может значительно затруднить их выздоровление и ухудшить общий исход.
При сравнении с результатами других исследований стало очевидно, что показатели обсеменения и выявленные типы патогенов согласуются с показателями, полученными в ходе аналогичных исследований ортопедических и прочих хирургических отделений. Так, в специализированной больнице наиболее часто встречающимися загрязнителями операционных были S. aureus и P. aeruginosa с показателями обсеменения в диапазоне 2–5% [27], аналогичными показателю обсеменения 3,09%, полученному в ходе настоящего исследования.
В другом исследовании, проведенном в больнице в Нигерии, Escherichia coli и Enterobacter spp. были одними из самых часто выделяемых в операционных бактерий [28], что подтверждает результаты настоящего исследования. Сравнение позволяет предположить, что типы бактерий, выявленные в ортопедических операционных больницы Имама Хусейна, характерны для хирургических отделений по всему миру, что подчеркивает общую проблему поддержания стерильности в соответствующих условиях.
Бактерии продемонстрировали самую высокую устойчивость к амоксициллину и ампициллину, за которыми следовали цефаклор, цефуроксим, цефадроксил и эритромицин. Устойчивость к амоксициллину снижалась при добавлении к амоксициллину клавулановой кислоты. S. aureus продемонстрировал самую высокую устойчивость к ампициллину и амоксициллину (пять изолятов), за которыми следовали амоксициллин/клавулановая кислота и эритромицин (три изолята), цефаклор (два изолята); только один изолят был чувствителен к цефадроксилу, цефтазидиму, цефуроксиму, цефиксиму и гентамицину, при этом все изоляты были чувствительны к остальным исследуемым противомикробным средствам. Самая высокая устойчивость выявлена у изолятов P. aeruginosa, за которыми следует E. coli, продемонстрировавшая разную устойчивость к 14 противомикробным средствам и чувствительность только к амикацину. Самая низкая устойчивость выявлена у коагулазонегативных стафилококков, Enterobacter spp. и Bacillus spp., продемонстрировавших устойчивость к четырем, пяти, четырем противомикробным средствам соответственно. Оценка антибиотикограммы патогенов и показателя обсеменения обычно служит индикатором раннего предупреждения для своевременного вмешательства. В ходе данного исследования обнаружена значительная устойчивость к амоксициллину и ампициллину; эта тенденция согласуется с данными исследования, проведенного в слаборазвитых странах [29].
Однако в ходе другого исследования изоляты продемонстрировали устойчивость еще к двум препаратам: эритромицину и гентамицину. Такая устойчивость должна вызывать беспокойство, поскольку это одни из наиболее часто используемых и наименее дорогостоящих противомикробных средств. Применение противомикробных препаратов может обусловливать различия устойчивости, что подчеркивает необходимость мониторинга противомикробной терапии [30].
Временное распределение культур с наличием роста продемонстрировало более высокие показатели обсеменения в феврале (28,57%), марте (38,10%) и апреле (23,81%) со спадом в мае (9,52%), что может свидетельствовать о сезонных изменениях микробиологической нагрузки или флуктуациях уровня загруженности операционной и активности персонала. Такая тенденция возможна вследствие роста числа пациентов и хирургических операций в первые месяцы, что потенциально может приводить к более высокому риску обсеменения. Кроме того, это может говорить о нарушении протоколов уборки в периоды повышенной нагрузки. Спад показателей обсеменения в мае может быть связан с более качественной уборкой, снижением хирургической активности и изменениями условий окружающей среды. Такие результаты подчеркивают необходимость постоянного мониторинга и корректировки мер инфекционного контроля на протяжении года для устранения сезонных изменений риска обсеменения.
Результаты исследования существенно влияют на практику инфекционного контроля в ортопедических операционных. Выявление специфических очагов обсеменения, таких как кушетка, пол и стены, позволяет получить ценную информацию для целенаправленных вмешательств, цель которых — снижение микробиологической нагрузки в соответствующих зонах. Регулярная тщательная очистка этих поверхностей и использование эффективных средств дезинфекции необходимы для минимизации риска воздействия на пациента опасных патогенов. Кроме того, исследование подчеркивает важность поддержания стерильности хирургических инструментов и других критически важных предметов, используемых в операционных, о чем свидетельствует отсутствие роста бактерий на марле и инструментах. Результаты позволяют также предположить, что проводимое обучение персонала и обучение практикам инфекционного контроля, в особенности в части обслуживания и уборки зон высокого риска, чрезвычайно важны для поддержания низких показателей обсеменения.
ВЫВОДЫ
Микробиологический анализ ортопедических операционных в больнице Имама Хусейна выявил в целом низкий, но существенный уровень бактериального обсеменения и специфические патогены, угрожающие безопасности пациентов. Результаты исследования согласуются с данными аналогичных исследований, проводимых во всем мире, что говорит об универсальности проблемы поддержания стерильности в хирургических отделениях. Выявление очагов загрязнения создает предпосылки для целенаправленных вмешательств. Одновременно с этим временное распределение культур с наличием роста говорит о необходимости постоянного мониторинга и корректировки мер инфекционного контроля. И, наконец, исследование подчеркивает крайнюю важность строгих мер инфекционного контроля для предотвращения внутрибольничных инфекций и обеспечения безопасности пациентов, которым делают ортопедические операции.
- Nimer NA. Nosocomial infection and antibiotic-resistant threat in the Middle East. Infection and drug resistance. 2022; p. 631–9.
- Menakaya C, et al. Consenting patients for elective procedures during the pandemic: Are we consenting for risk of nosocomial COVID-19 infection. Journal of Perioperative Practice. 2022; 32 (10): 270–4.
- Huang W. What Do We Need to Know to Prevent and Control Nosocomial Infections Completely?-Part 2. Acta Scientific MICROBIOLOGY (ISSN: 2581-3226). 2022; 5 (4).
- Chauveaux D. Preventing surgical-site infections: measures other than antibiotics. Orthopaedics & Traumatology: Surgery & Research. 2015; 101 (1): S77–S83.
- Li K, et al., Effectiveness of preoperative antibiotics in preventing surgical site infection after common soft tissue procedures of the hand. Clinical Orthopaedics and Related Research. 2018; 476 (4): 664–73.
- Yousufuddin S, et al., Surgical Site Infection in Hip Fracture Surgery; Reducing the Incidence of Infection and Correlation With co Morbidities and Blood Parameters. Int J Orthop. 2018; 5: 891–5.
- Stambough JB, et al. Decreased hospital costs and surgical site infection incidence with a universal decolonization protocol in primary total joint arthroplasty. The Journal of arthroplasty. 2017; 32 (3): 728–34.
- McQueen RH, Ehnes BL. Antimicrobial Textiles and Infection Prevention — Clothes and Inanimate Environment, in Infection Prevention: New Perspectives and Controversies. Springer, 2022; p. 139–49.
- Owen L, Laird K. The role of textiles as fomites in the healthcare environment: a review of the infection control risk. PeerJ. 2020; 8: e9790.
- Andersen BM, Andersen BM. Operation Department: Infection Control. Prevention and Control of Infections in Hospitals: Practice and Theory. 2019; p. 453–89.
- Swenson D. Review of current practice in preventing health care associated infections, in Assurance of Sterility for Sensitive Combination Products and Materials. Elsevier, 2020; p. 135–64.
- Bali RK. Operating room protocols and infection control. Oral and maxillofacial surgery for the clinician. 2021; p. 173–94.
- Dallolio L, et al. Surveillance of environmental and procedural measures of infection control in the operating theatre setting. International journal of environmental research and public health. 2018; 15 (1): 46.
- Graveto JM, Costa PJ, Santos CI. Cell phone usage by health personnel: preventive strategies to decrease risk of cross infection in clinical context. Texto & Contexto-Enfermagem. 2018; 27: e5140016.
- Chaman R, et al. Survey of prevalence and types of bacterial contamination of mobile phones of personnel employed in major wards of educational hospitals in Yasuj. Journal of Fundamental and Applied Sciences. 2018; 10 (2).
- Dancer SJ. Hospital cleaning: past, present, and future. Antimicrobial Resistance & Infection Control. 2023; 12 (1): 80.
- Schinas G, et al. Preventing multidrug-resistant bacterial transmission in the intensive care unit with a comprehensive approach: a policymaking manual. Antibiotics. 2023; 12 (8): 1255.
- Garba R, et al. Microbial pattern in urine samples of post repaired vesico-vaginal fistula patients at Laure Fistula Center, Kano, Nigeria. African Journal of Medicine and Medical Sciences. 2022; 51 (4): 275–85.
- Shukla A, et al. Surveillance of microbiological environment of operation theaters. Cureus. 2021; 13 (12).
- Infection prevention and control in-service education and training curriculum. World Health Organization, 2024.
- Odoom A, Tetteh-Quarcoo PB, Donkor ES. Prevalence of Hospital-Acquired Infections in Low-and Middle-Income Countries: Systematic Review and Meta-Analysis. Asia Pacific Journal of Public Health. 2024; p. 10105395251338002.
- Nedopil AJ, Howell SM. Operating Room Methods to Reduce Infection in Total Knee Arthroplasty. Infection in Knee Replacement. 2022; p. 339–46.
- Parvizi J, et al. Environment of care: Is it time to reassess microbial contamination of the operating room air as a risk factor for surgical site infection in total joint arthroplasty? American journal of infection control. 2017; 45 (11): 1267–72.
- Mwita JC, et al. Key issues surrounding appropriate antibiotic use for prevention of surgical site infections in low-and middle-income countries: a narrative review and the implications. International journal of general medicine. 2021; 515–30.
- Behera B, et al. Impact of modified CDC/NHSN surveillance definition on the incidence of CAUTI: a study from an Indian tertiary care hospital. Journal of Infection Prevention. 2021; 22 (4): 162–5.
- Totty JP, et al. The impact of surgical site infection on hospitalisation, treatment costs, and health–related quality of life after vascular surgery. International Wound Journal. 2021; 18 (3): 261–8.
- Okey-Kalu EU, et al. Antibiogram and Plasmid Profile of Bacterial Isolates from Intensive Care Units in a Tertiary Healthcare Facility in Umuahia. Journal of Human Environment and Health Promotion. 2022; 8 (1): 10–14.
- Abubakar S, et al. Spectrum of bacterial isolates among intensive care units patients in a tertiary hospital in northeastern Nigeria. Indian J Sci Resour Technol. 2014; 2 (6): 42–7.
- Ramírez NS, et al. Identification, resistance, and susceptibility of microorganisms on healthcare workers' hands: a systematic review and meta-analysis. Revista de Epidemiologia e Controle de Infecção. 2024; 14 (3): 1–13.
- Mohammed A, et al. Bacterial contamination of operating theaters at a tertiary hospital in Bauchi, Northatsern Nigeria. EJPMR. 2017; 4 (4): 182–8.