Статья размещена в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (CC BY).
ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
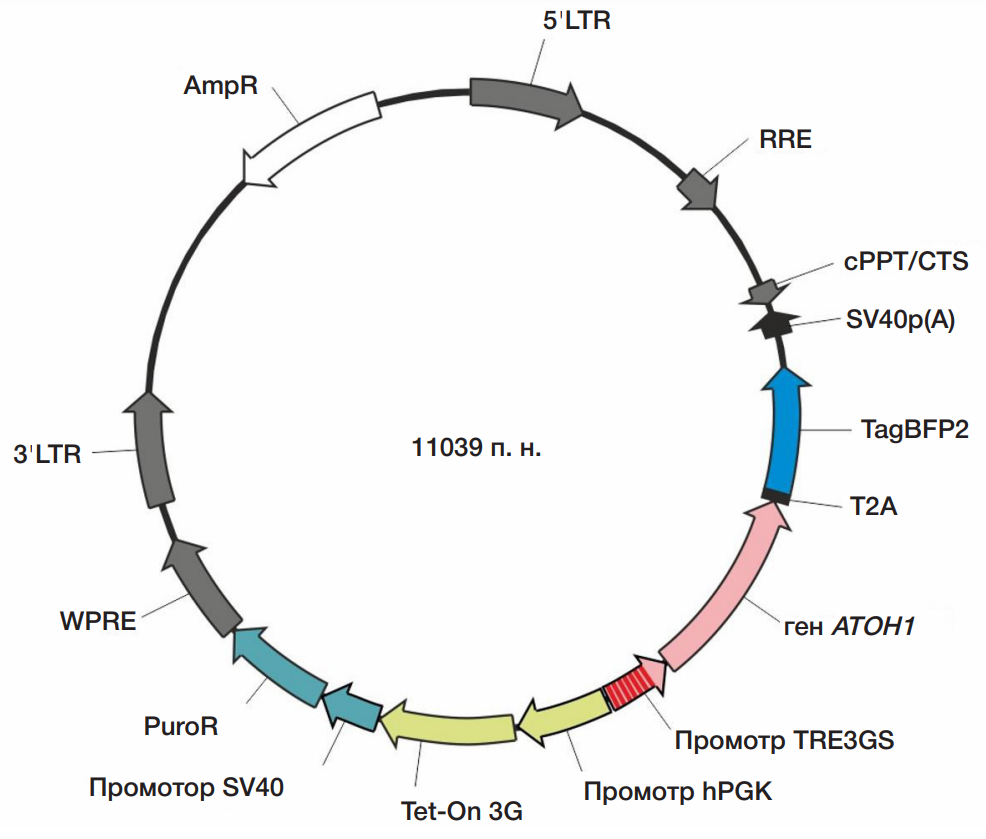
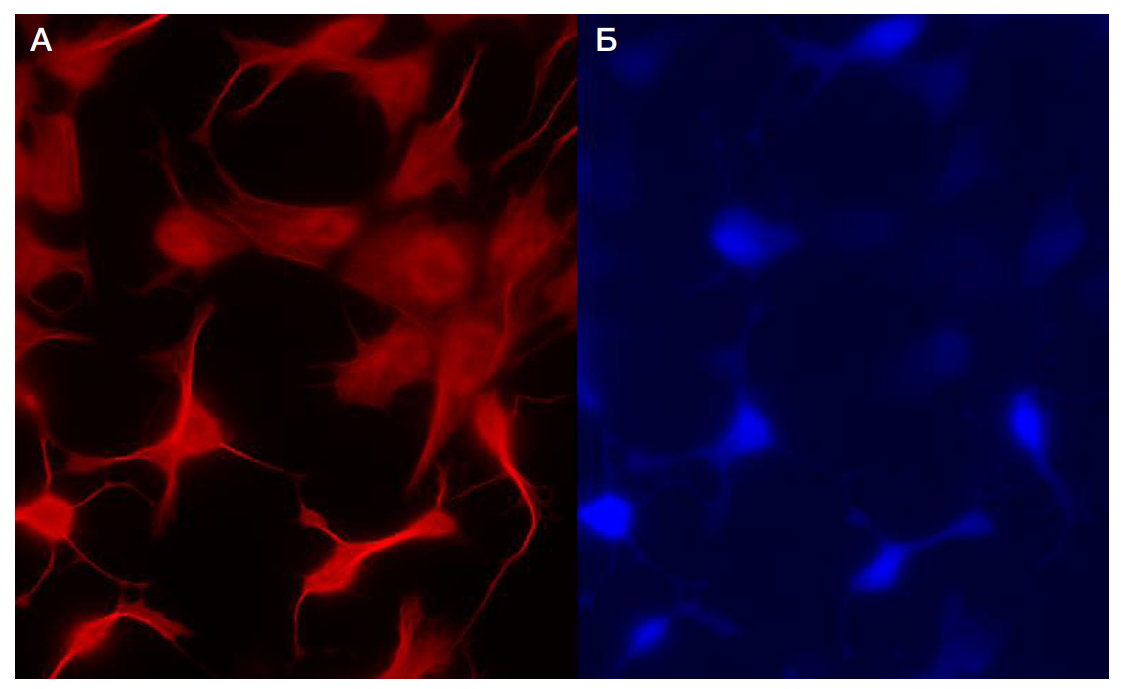
Экспрессия фактора ATOH1 индуцирует быструю дифференцировку иПСК в нейронном направлении
1 Сколковский институт науки и технологии, Центр молекулярной и клеточной биологии, Москва, Россия
2 Институт биоорганической химии имени М. М. Шемякина и Ю. А. Овчинникова, Москва, Россия
3 Российский национальный исследовательский медицинский университет имени Н. И. Пирогова, Москва, Россия
4 Московский государственный университет имени М. В. Ломоносова, Москва, Россия
Для корреспонденции: Надежда Георгиевна Гурская
ул. Островитянова, д. 1, стр. 1, г. Москва, 117997, Россия; ur.liam@ayaksrugn
Финансирование: работа была поддержана грантом РНФ № 22-14-00141.
Вклад авторов: А. И. Степанов — проведение эксперимента; Л. В. Путляева — планирование эксперимента, написание статьи; Д. А. Дидыч — дизайн и молекулярное клонирование элементов лентивирусной плазмиды, обработка рисунков; А. А. Галиакберова — культивирование клеток; Н. Г. Гурская — концепция и дизайн работы с ИПСК; К. А. Лукьянов — общее руководство исследованием.