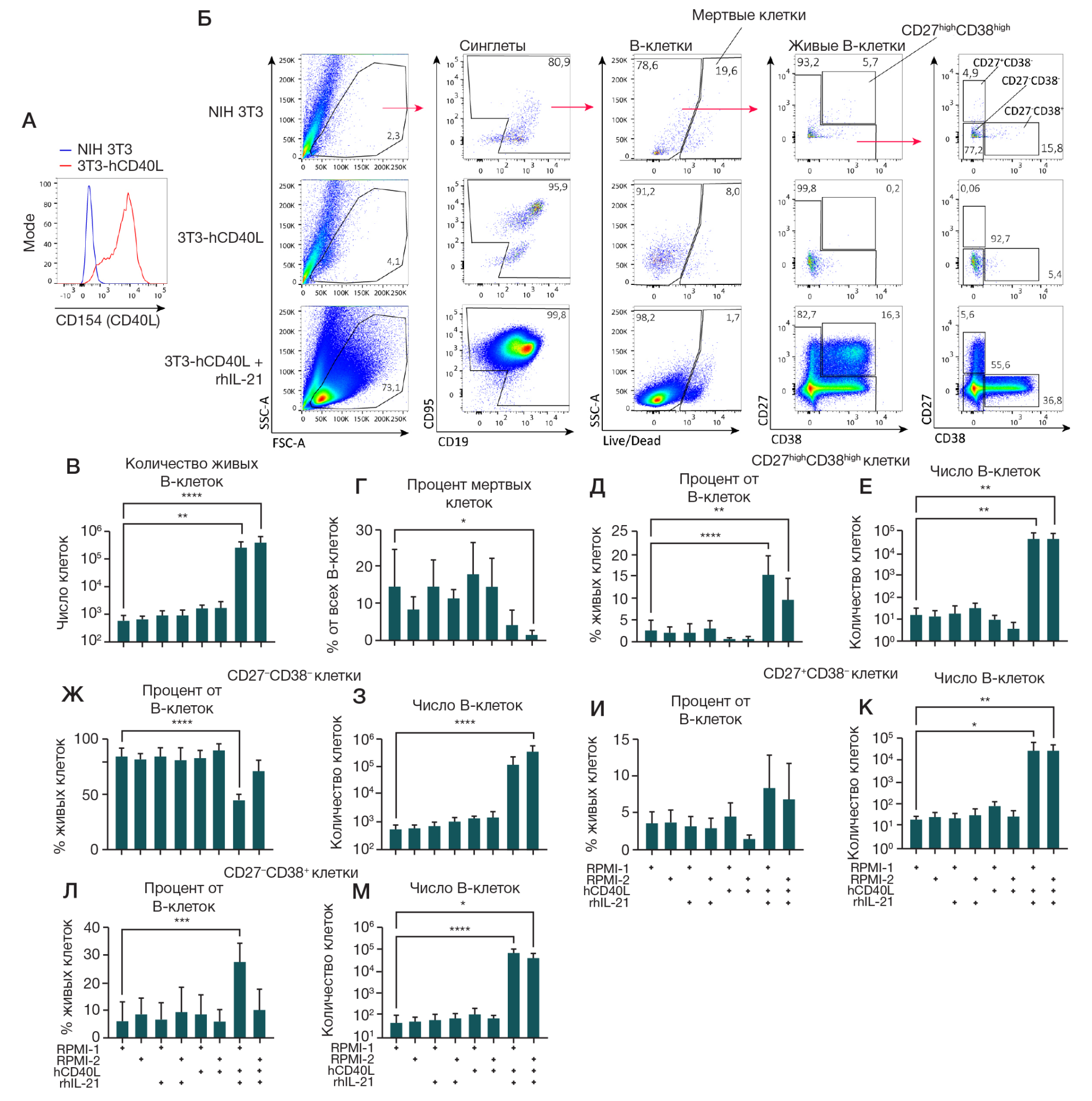
Рис. 1. Анализ влияния фидерной линии, экспрессирующей rhCD40L, цитокина IL-21 и состава культуральной среды на рост культуры В-клеток. Фидерная линия 3T3-hCD40L была получена путем трансфекции линии мышиных фибробластов NIH 3T3 плазмидой pcDNA3.1-hCD40L с получением клеточной линии, стабильно экспрессирующей трансген, и последующим отбором моноклона с наивысшим уровнем hCD40L. 1,5 × 104 (CD19+ CD20+) В-клеток, полученных в результате флуоресцентного сортинга из МНК периферической крови человека, культивировали на фидерной линии 3T3-hCD40L с/без добавления rhIL-21 (50 нг/мл) в двух различных по составу культуральных средах (RPMI-1 и RPMI-2) в течение 7 дней. Сравнение проводили относительно В-клеток, культивируемых в присутствии нетрансфецированной фидерной линии NIH 3T3. Анализ В-клеточных культур проводили методом проточной цитометрии. А. Гистограмма распределения уровня экспрессии hCD40L (CD154) на поверхности фидерных клеток 3T3-hCD40L (отмечена красной линией) в сравнении с контрольными нетрансфецированными фибробластами NIH 3T3 (отмечена синей линией). Б. Репрезентативные графики цитометрического анализа. Стратегия гейтирования указана стрелками. В, Г. Количество живых В-клеток (В) и процент мертвых В-клеток (Г) в культурах. Д–М. Количественный анализ процентного содержания среди живых В-клеток и общего числа живых В-клеток фенотипически разделенных по поверхностной экспрессии CD27 и CD38 на CD27high CD38high-плазматические клетки и плазмобласты (Д, Е), CD27-CD38– (Ж, З), CD27+CD38– (И, К) и CD27–CD38+-В-клетки (Л, М). На графиках представлены данные в виде среднего значения ± стандартное отклонение (SD) для четырех независимых опытов (n = 4), каждый опыт выполнен в двух репликах. Статистический анализ проводили методом однофакторного дисперсионного анализа (ANOVA) с использованием поправки Даннетта для множественных сравнений, *, * *, * * *, * * * * — p ≤ 0,05; 0,001; 0,0001; 0,0001 соответственно
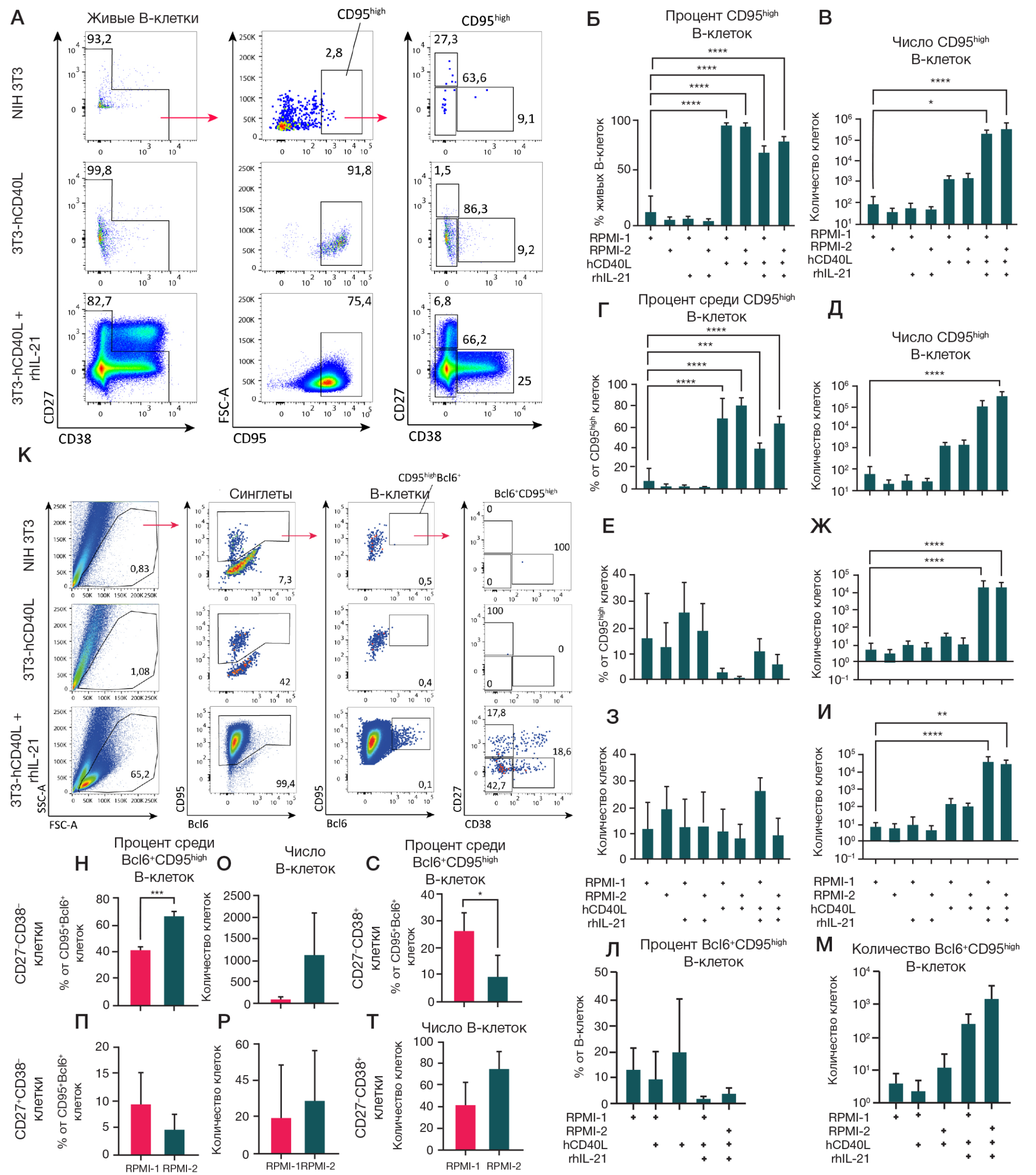
Рис. 2. Анализ влияния CD40L, IL-21 и состава культуральной среды на поверхностную экспрессию CD95 и внутриклеточную экспрессию транскрипционного фактора Bcl6 в В-клеточных культурах. А–И. Анализ поверхностной экспрессии CD95 и коэкспрессии CD27 и CD38 на В-клетках в культурах (исключающий CD27highCD38high-плазматические клетки). Репрезентативные графики цитометрического анализа (А). Стратегия гейтирования указана стрелками. Б, В. Количественный анализ процентного содержания (Б) и абсолютное число (B) CD95high-B-клеток в культурах. Г–И. Количественный анализ процентного содержания B-клеток и абсолютное число живых CD95high-B-клеток для CD27–CD38– (Г, Д), CD27+CD38– (Е, Ж) и CD27–CD38+ (З, И) В-клеток. К–Т. Культивированные в присутствии фидерной линии NIH 3Т3, экспрессирующей hCD40L, с/без rhIL-21 (50 нг/мл) в RPMI-1 или RPMI-2 культуры В-клеток были фиксированы и пермеабилизированы для окрашивания внутриклеточного транскрипционного фактора Bcl6. Сравнение проводили относительно В-клеток, культивируемых в присутствии нетрансфецированной линии NIH 3T3. Репрезентативные графики цитометрического анализа фиксированных В-клеток из культур. Стратегия гейтирования указана стрелками (К). Количественный анализ процентного содержания (Л) и абсолютного числа (М) Bcl6+CD95highB-клеток от общего количества В-клеток. Количественный анализ процентного содержания и абсолютного числа CD27–CD38– (Н, О), CD27+CD38– (П, Р) и CD27–CD38+ (С, Т) Bcl6+CD95high -В-клеток. На графиках представлены данные в виде среднего значения ± стандартное отклонение (SD) для четырехх независимых опытов (n = 4), каждый опыт выполнен в двух репликах. Статистический анализ субпопуляций CD95high-B-клеток (Б–И), а также Bcl6+CD95high-Bклеток (Л, М) проводили методом однофакторного дисперсионного анализа (ANOVA) с использованием поправки Даннета для множественных сравнений. Статистический анализ субпопуляций Bcl6+CD95high-B-клеток (Н–Т) проводили методом непaрного T-теста. *, * *, * * *, * * * * — p ≤ 0,05; 0,001; 0,0001; 0,0001 соответственно
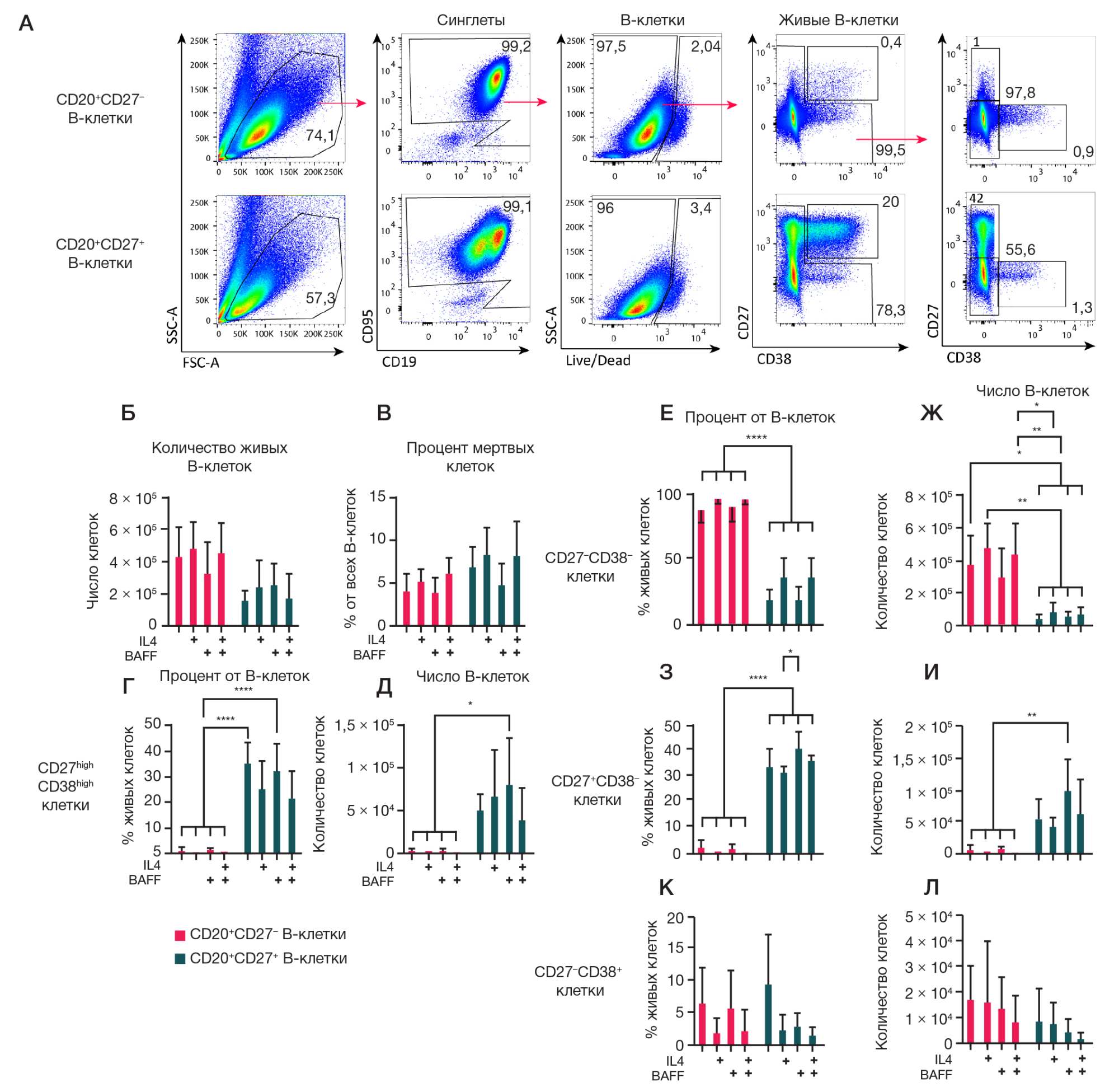
Рис. 3. Анализ влияния различных композиций цитокинов на культуры из CD27–-В-клеток и CD27+-В-клеток памяти. Преимущественно наивные В-клетки (CD19+CD20+CD27–) и В-клетки памяти (CD19+CD20+CD27–), полученные из МНК крови в результате FACS, в количестве 1,5 × 104 культивировали на фидерных клетках 3T3, экспрессирующих hCD40L, в культуральной среде RPMI-2 в присутствии rhIL-21 (50 нг/мл), c/без добавления цитокинов rhIL-4 (10 нг/мл) и rhBAFF (100 нг/мл) в течение 7 дней. Анализ клеточных культур производили методом проточной цитометрии. А. Репрезентативные графики цитометрического анализа. Стрелками указана стратегия гейтирования. Б, В. Количество живых В-клеток (Б) и процент мертвых В-клеток (В) в культурах. Г–Л. Количественный анализ процентного содержания среди живых В-клеток и абсолютного числа CD27highCD38high-плазматических клеток и плазмабластов (Г, Д), CD27–CD38– (Е, Ж), CD27+CD38– (З, И) и CD27–CD38+ (К, Л) В-клеток. На графиках представлены данные в виде среднего значения ± стандартное отклонение (SD) для четырех независимых опытов (n = 4), каждый опыт выполнен в двух репликах. Статистический анализ проводили методом двухфакторного дисперсионного анализа (ANOVA) с использованием критерия Тьюки для множественных сравнений, *, * *, * * *, * * * * — p ≤ 0,05; 0,001; 0,0001; 0,0001 соответственно
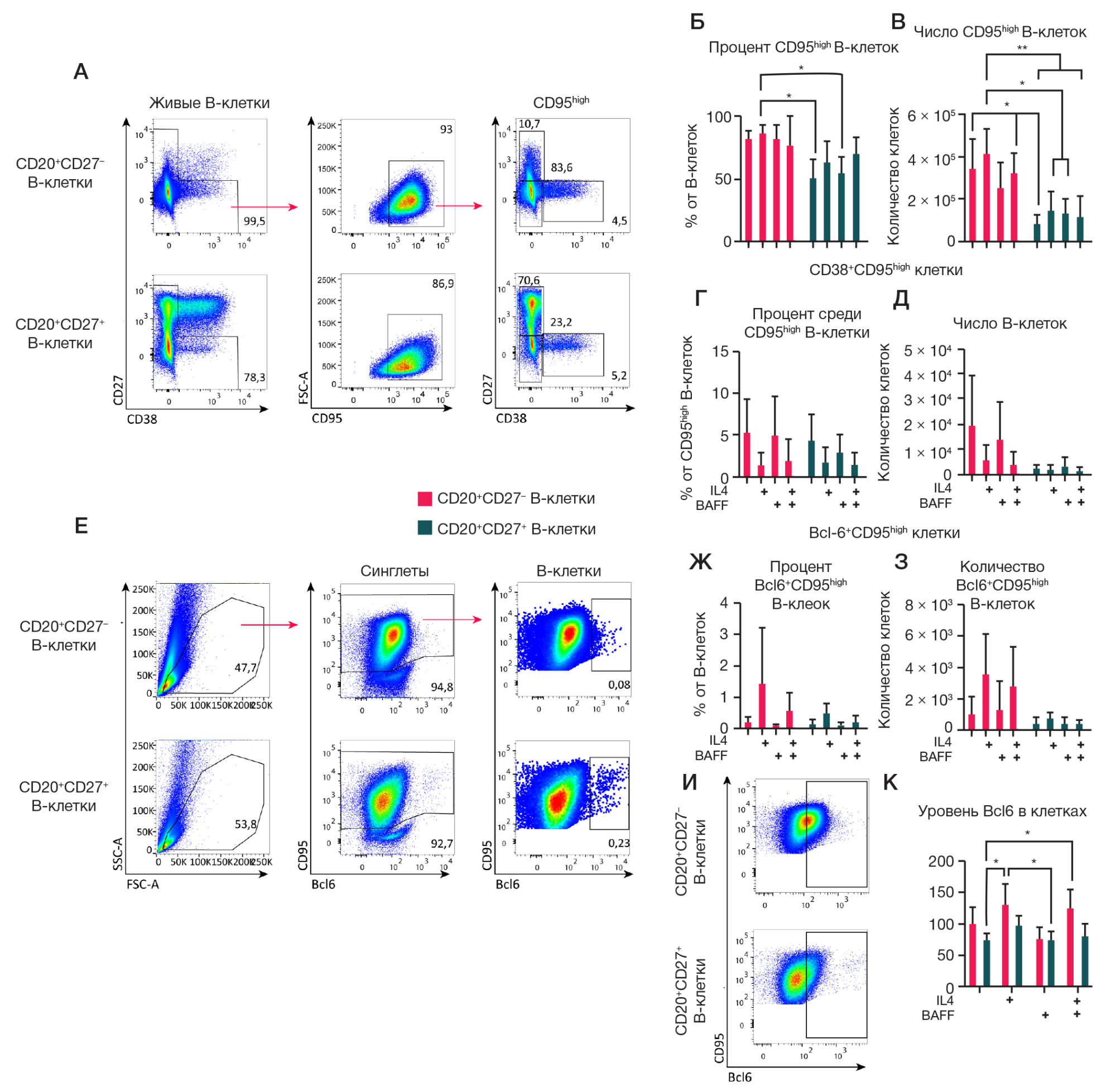
Рис. 4. Анализ влияния различных композиций цитокинов на поверхностную экспрессию CD95 и внутриклеточную экспрессию транскрипционного фактора Bcl6 на культуры из CD27–-В-клеток и CD27+-В-клеток памяти. 1,5 × 104 CD19+CD20+CD27– и CD19+CD20+CD27– В-клеток культивировали на фидерных клетках 3T3, экспрессирующих hCD40L, в культуральной среде RPMI-2 в присутствии rhIL-21 (50 нг/мл), c/без добавления цитокинов rhIL-4 (10 нг/мл) и rhBAFF (100 нг/мл) в течение 7 дней. А–Д. Анализ поверхностной экспрессии CD95 и коэкспрессии CD27 и CD38 на В-клетках в культурах (исключающий CD27highCD38high-плазматические клетки). A. Репрезентативные графики цитометрического анализа поверхностной экспрессии CD95. Стратегия гейтирования указана стрелками. Б, В. Количественный анализ процентного содержания среди живых В-клеток (Б) и абсолютное число (B) живых CD95high-B-клеток в культурах. Г, Д. Количественный анализ процентного содержания среди CD95high-B-клеток (Г) и абсолютное число живых CD38+CD95high-B-клеток (Д). Е–К. Анализ внутриклеточной экспрессии Bcl6 в клеточных культурах. Для этого клетки из культур были фиксированы и пермеабилизированы для окрашивания внутриклеточного транскрипционного фактора Bcl6. Репрезентативные графики цитометрического анализа (Е). Стратегия гейтирования указана стрелками. Процентное содержание (Ж) от В-клеток и абсолютное число (З) CD95highBcl6+-клеток. Репрезентативные панели цитометрического анализа, иллюстрирующие распределение по Bcl6 в клеточных культурах из CD20+CD27+ и CD20+CD27– В-клеток (И). Средняя интенсивность флуоресценции (MFI) транскрипционного фактора Bcl6 в клетках из культур (К). Данные количественных анализов представлены в виде среднего значения значения ± стандартное отклонение (SD) для четырех независимых опытов (n = 4), каждый опыт выполнен в двух репликах. Статистический анализ проводили методом двухфакторного дисперсионного анализа (ANOVA) с использованием критерия Тьюки для множественных сравнений, *, * *, * * *, * * * * — p ≤ 0,05; 0,001; 0,0001; 0,0001 соответственно
Таблица 1. Схема эксперимента для оптимизации условий культивирования CD19+CD20+ B-клеток

Таблица 2. Схема эксперимента для исследования культур из CD20+CD27–-наивных В-клеток и CD20+CD27+-В-клеток памяти