Статья размещена в открытом доступе и распространяется на условиях лицензии Creative Commons Attribution (CC BY).
ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ
Особенности иммунного ответа на опухолевые аллоантигены в условиях сокращенного клонального разнообразия Т-клеток
Национальный медицинский исследовательский центр онкологии имени Н. Н. Блохина Минздрава России, Москва, Россия
Для корреспонденции: Дмитрий Борисович Казанский
Каширское ш., д. 24, стр. 15, г. Москва, 115478, Россия; ur.xednay@1yksnazak
Финансирование: работа выполнена при финансовой поддержке гранта РНФ № 22-15-00342-П (https://rscf.ru/project/22-15-00342/).
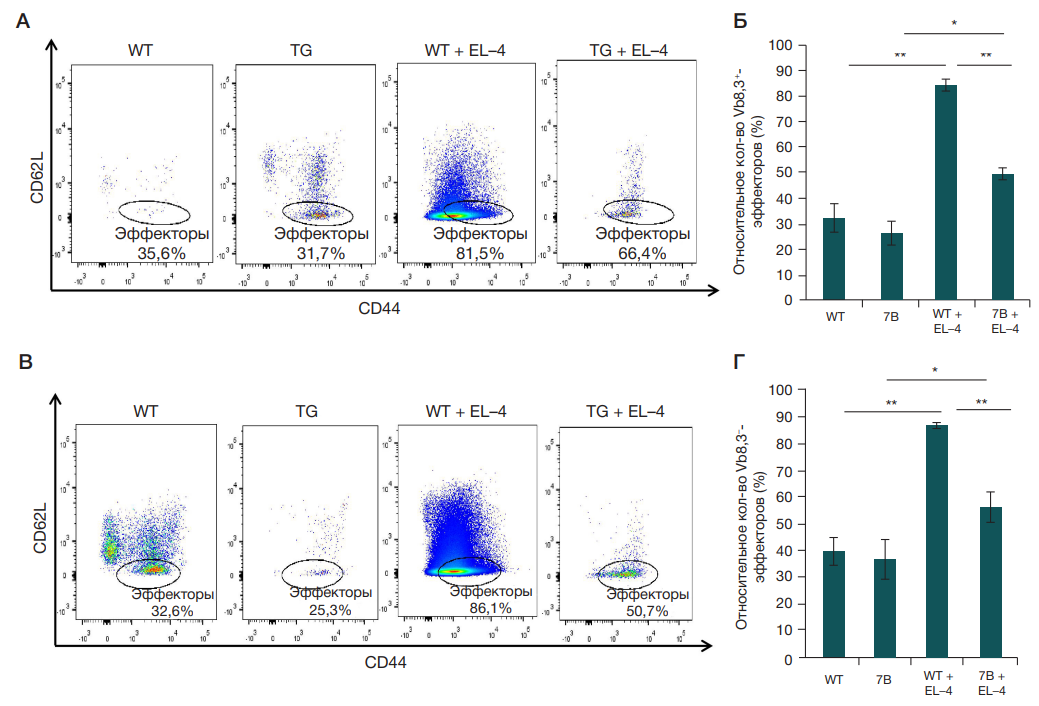
Вклад авторов: М. С. Короткова — проведение экспериментов, анализ результатов; Н. А. Персиянцева — проведение экспериментов, анализ результатов, редактирование; А. А. Калинина — планирование исследования, анализ и интерпретация результатов, анализ литературы, написание статьи, редактирование; Л. М. Хромых — редактирование; Д. Б. Казанский — планирование исследования, анализ и интерпретация результатов, анализ литературы, редактирование.
Соблюдение этических стандартов: исследование одобрено этическим комитетом ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России (протокол № 3П-10.06.2022 от 10 июня 2022 г.) и проведено в строгом соответствии с положениями Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.