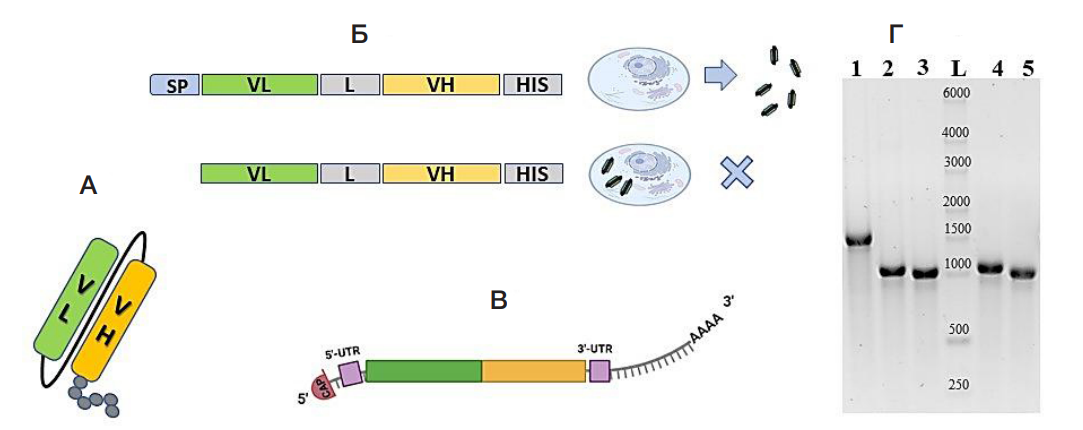
Рис. 1. Принципиальное строение разработанных scFv-фрагментов антител против вирусов гриппа А и В и кодирующих их экзогенных мРНК. А. Структура scFv-фрагмента антитела, состоящего из вариабельных доменов легкой (показан зеленым цветом) и тяжелой (показан оранжевым цветом) цепей. Черной линией отмечен линкерный пептид (G4S)4. Серыми кружками показана последовательность 6×His-tag на С-конце белка. Б. Структура кодирующих областей секретируемого (верхняя цепь) и цитозольного scFv. Принципиальным различием является наличие (или отсутствие) SP на N-конце. VL, VH — вариабельные домены легкой и тяжелой цепей соответственно, L — линкерный пептид, HIS — последовательность 6×His-tag. В. Структура экзогенной мРНК, используемой для трансляции внутриклеточных scFv: на 5ʹ-конце отмечен кэп (в работе использован m7GmAmG), далее сиреневым цветом обозначена 5ʹ-UTR регуляторная область, зеленым и оранжевым блоками — структура кодирующей области scFv, вторым сиреневым блоком — 3ʹ-UTR регуляторная область и протяженной серой линией с насечками — поли(А)-хвост. Г. Результат электрофоретического разделения полученных и очищенных препаратов экзогенных мРНК: 1 — мРНК, кодирующая тяжелую цепь иммуноглобулина к нерелевантному антигену (NC-RNA), расчетной длиной 1792 н.; 2 — мРНК, кодирующая scFv-FI6-SP, длиной 1219 н.; 3 — мРНК, кодирующая scFv-FI6-WO, длиной 1162 н.; 4 — мРНК, кодирующая scFv-2/3-SP, длиной 1201 н.; 5 — мРНК, кодирующая scFv-2/3-WO, длиной 1138 н. L — маркер молекулярного веса РНК RiboRuler High Range RNA Ladder (Thermo Fisher Scientific, США). Длины маркера (н.) подписаны на дорожке
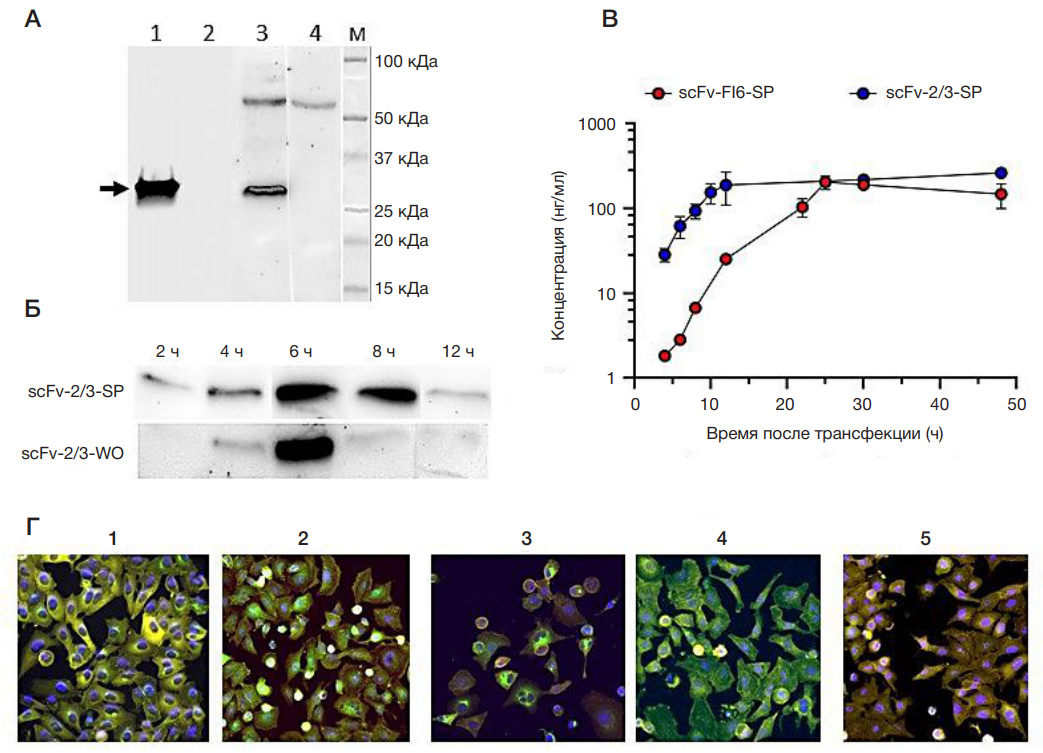
Рис. 2. Трансляционная активность экзогенных мРНК, кодирующих цитозольную (WO) и секретируемую (SP) формы scFv-фрагментов антител против вирусов гриппа А и В. А. Результаты вестерн-блоттинга scFv-2/3 фрагментов антител в культуральной жидкости (КЖ) и лизатах клеток MDCK с использованием антител к последовательности 6×His-tag (аналогичные результаты по scFv-FI6 не представлены). Дорожки 1, 2 — КЖ от клеток MDCK, трансфицированных мРНК, кодирующими scFv-2/3-SP и scFv-2/3-WO соответственно; дорожки 3, 4 — клеточные лизаты, полученные при трансфекции клеток мРНК, кодирующими scFv-2/3-SP и scFv-2/3-WO соответственно; М — белковый маркер молекулярного веса Precision Plus Protein Kaleidoscope Prestained Protein Standards (Bio-Rad; США), справа от дорожки подписаны соответствующие молекулярные массы в кДа. Все образцы были взяты через 24 ч после трансфекции клеток мРНК. Б. Результаты вестерн-блоттинга scFv-2/3 фрагментов антител в лизатах клеток MDCK в динамике с использованием антител к последовательности 6×His-tag. Верхняя панель — внутриклеточная продукция scFv-2/3-SP, нижняя — scFv-2/3-WO. Сверху в часах отмечено время отбора проб после трансфекции клеток мРНК. В. Кривые накопления scFv-фрагментов антител в КЖ после трансфекции клеток A549 мРНК, кодирующими scFv-FI6-SP (показаны красными точками) и scFv-2/3-SP (показаны синими точками). Результаты были получены методом ИФА. Точками показаны средние значения концентраций, рассчитанные для двух биологических повторов, ±СО. Г. Репрезентативные изображения, полученные в результате флуоресцентной микроскопии фиксированных препаратов клеток A549, трансфицированных экзогенными мРНК, кодирующими: 1 — scFv-FI6SP, 2 — scFv-FI6-WO, 3 — scFv-2/3-SP, 4 — scFv-2/3-WO и 5 — NC-RNA. Визуализацию актинового цитоскелета (показан желтым цветом) проводили родаминфаллоидином, клеточных ядер (показаны синим цветом) — хромосомным красителем DAPI. Для визуализации scFv-фрагментов (показаны зеленым цветом) использовали первичные мышиные моноклональные антитела к последовательности 6×His-tag с их последующим выявлением вторичными антителами Goat anti-Mouse, меченными флуоресцентным красителем Alexa Fluor 488. Изображения были получены с использованием системы визуализации клеток Cytell (40× увеличение), на этапе обработки (с использованием встроенного ПО) отдельные каналы изображения были псевдоокрашены в цвета RGB, на рисунке представлены увеличенные изображения
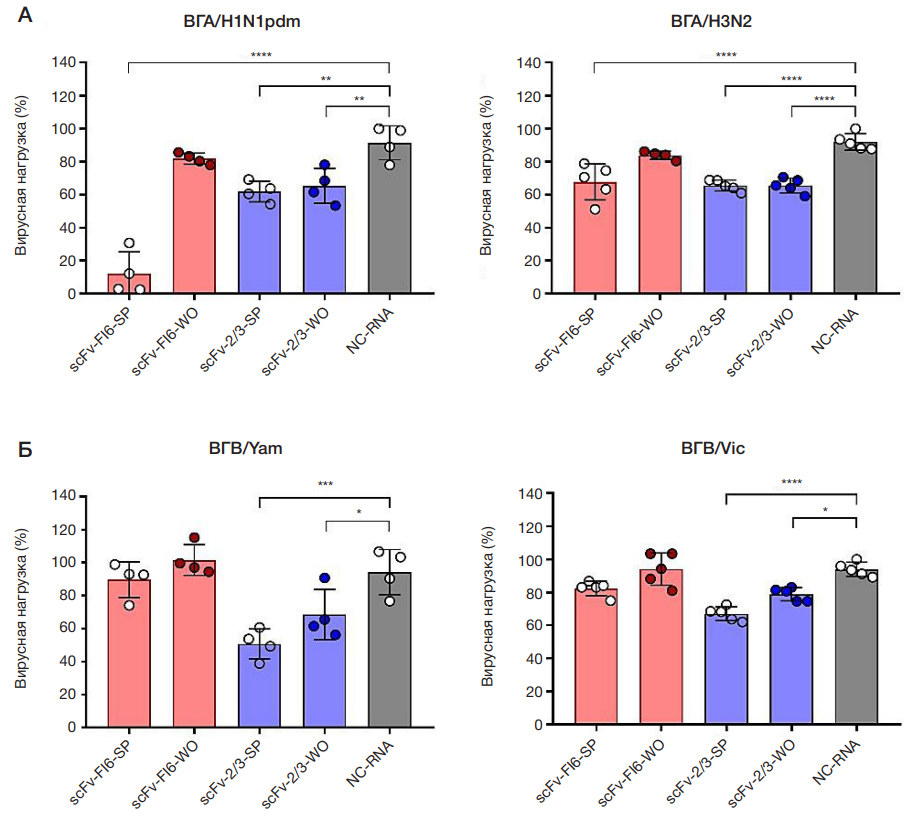
Рис. 3. Противовирусная активность экзогенных мРНК, кодирующих цитозольную (WO) и секретируемую (SP) формы scFv-фрагментов антител против вирусов гриппа А и В. Результаты были получены методом внутриклеточного ИФА. А. Графики, отражающие внутриклеточный уровень ВГА при инфицировании штаммами вируса гриппа A/California/07/09 (H1N1pdm) (слева) и A/Cambodia/e0826360/2020 (H3N2) (справа). Б. Графики, отражающие внутриклеточный уровень ВГB при инфицировании штаммами вируса гриппа B/Phuket/3073/13 (Yamagata) (слева) и B/Malaysia/2506/2004 (Victoria) (справа). Цветными столбиками показаны средние значения по выборке (n = 4) ± CO: красными — при лечебно-профилактическом введении экзогенных мРНК, кодирующих scFv-фрагменты к HA ВГА; синими — при лечебно-профилактическом введении экзогенных мРНК, кодирующих scFv-фрагменты к NP ВГB; серым столбиком показаны средние значения для клеток, которым по лечебно-профилактической схеме вводили экзогенную мРНК, кодирующую тяжелую цепь иммуноглобулина к нерелевантному антигену (отрицательный контроль). Для расчета статистической достоверности выявленных различий использовали одношаговый анализ ANOVA с тестом Холма–Шидака для множественных сравнений. Звездочками отмечены достоверные различия, выявленные при сравнении соответствующей группы с NC-RNA: * — Pvalue < 0,0332; * * — Pvalue < 0,0021; * * * — Pvalue < 0,0002; * * * * — Pvalue < 0,0001




